Как пить рифампицин при золотистом стафилококке
Нам 4 мес. Уже неделю у нас понос желто-зеленого цвета со слизью, сопровождается сильными потугами. Температуры нет, аппетит в норме. Вес не теряем. Ребенок веселый.Позавчера были в Малыше у Герасевой. Посмотрела нас и без аализов (будут готовы только завтра) сделала заключение- энтеровирус и выписала Рифампицин! А у меня была накануне температура 39.5 и не спадала. Она мне выписала ципрофлоксацин, который нельзя принимать при кормлении вообще. Типа от кишечной инфекции. У меня кроме этого грудь стала болеть, что могло тоже вызвать температуру и зуб до кучи! в общем все 33 удовольствия сразу! Я сдуру сразу же дала масику лекарство! ужесно мерзкое! Он его чуть не срыгнул! И сама конечно выпила! В общем 2 дня этой гадостью уже пичкаемся из назначеных 5! И тут я заглянула в инет и увидела, что этот самый Рифампицин нельзя принимать, тем кто перенес желтуху и он поднимает уровень биллирубина, который мы с таким трудом понижали с 1 мес, когда у нас не проходила желтушка! И тут то я схватилась за голову! Что делать. Можно ли бросать антибиотики?? А хуже не будет? Или начать пить бактериофаг? А вдруг не поможет? Анализы будут готовы только завтра! А что же до завтра пить антибиотики, кот поднимают биллирубин? Или бросить? А мне пить или не пить? Ведь его нельзя пить при лактации. Или не кормить пока или мне не пить. А вдруг темп снова подпрыгнет до 40! пока вроде бы спала до 37.. Голова кругом! А до 4 мес. у нас вообще запоры бешеные были! Одни крайности!
Помогите плиз люди добрые и знающие.
Извиняюсь ошиблась! ЭНТЕРОКОЛИТ!
А вы не хотели бы сходить к другому педиатру, чтобы подтвердили во-первых заболевание и во-вторых лечение. Да и конечно было бы лучше дождаться анализов! Не торопитесь. Врачи порой такое назначают. антибиотики - это крайность.
По поводу пить или не пить - не могу сказать не врач. А вот кормить или не кормить, однозначно кормить, а то всю флору погубить у малыша.
Пока болеете сами - ребенка лучше не кормить. Антибиотики, это еще один дополнительный негативный фактор. Возможно будет лучше несколько дней воздержаться от кормления ребенка воообще. Полечитесь спокойно. Молоко сцеживайте. А что касается самого ребенка, то возможно его понос - это как раз реакция на вашу болезнь. Сколько раз в день понос у малыша?
вы знаете, мой малыш плохо какает с рождения думаю потому, что мне еще в роддоме капали этот самый ципрофлоксацин, я с трудом вылечила этот его дисбактериоз, а недавно он затемпературил и начал опять плохо какать со слизью и наш педиатр прописата этот самый рифампицин, понос сразу прошел. и старшей дочери я давала, неплохой антибиотик. про герасеву скажу что она хороший детский инфекционист. а вы сами как температуру меряли? при кормлении грудью надо ставить градусник в локтевой сгиб, под мышкой она всегда высокая будет. есть у вас другие признаки болезни? дождитесь анализов и не бросайте назначенное лечение, аннотации к препаратам пишутся для обычных обывателей, что бы не навредили себе приемом их без консультации врача. и главное не паникуйте, хотя это трудно по себе знаю.
Всем огромное спасибо за участие и советы!
Получили анализы из инфекционки. У нас оказался стафилакокк золотистый. То чего я и боялась при выборе роддома. Рожала в Асымбековой. Но как мне и говорила мой гинеколог, стаф есть в каждо роддоме. Это вопрос везения! Месяц назад я сдавала молоко на стерильность. все чисто. Так вот. Антибиотик Рифампицин я всё таки решила прервать и сама пить свой тоже перестала. Кишечной то инфекции у меня нет. А вычитала в форуме о бактериофагах. Вот метеодом тыка решила попробовать антистафилакокковый. Надеюсь гады чувствительны на него. В любом случае он безвредный. Дороговатый конечно. 4 ампулы 880с. Говорят самое классное средство - это иммуноглобулин человека антистафилаккоковый. Нашла его еле еле в 1. аптеке! Ура, подумала я. Продавщица мне говорит: "А вы знаете сколько оно стоит?". Я думаю, за кого она меня принимает! Выгляжу видно не ахти.. Больше, думаю, сарафан этот не одену. Говорю:"Сколько бы ни стоил, для здоровья ребенка не жалко!". Она: "С вас 25тыс.750сом!" .
Я чуть не упала! 10 ампул! Ну ладно, говорю давайте бактериофаг лучше! Вот так вот! Даю два дня уже его. Пока изменений не наблюдается. Может надо весь курс пропить сначала. И вообще в интернете вычитала, что нельзя принимать антибиотики при стафилококке, т.к. убивается вся микрофлора, а сам стафилоккок ещё больше начинает свирепствовать. Не знаю чему верить. Ведь у нас в инфекционке сразу назначаю антибиотики по поводу и без! Кстати, нам нельзя ещё принимать рифампицин, потому, что мы только недавно победили высокий биллирубин. У нас долго не проходила желтушка и печень немного увеличина! Всё это я изложила Герасевой. Но она тем не менее назначила нам Рифаммцин, который увеличивает уровень биллирубина и запрещен тем, кто перенес фелтуху!
Самолечение, конечно, заниматься нельзя, но пока я решила сама давать масику Бактериофаг, линкс и ацитобак. А пока буду искать хорошего доктора.
А у меня оказалось температуру грудь дает! Застудила где-то. Мучаюсь теперь капуста не помогает, пробую сейчас камфорное масло. Посмотрим. И зуб ещё ко всему всю ночь болел. Не знаю что вперед лечить!
Сегодня мне ещё сказали, что в инфекционке часто анализы путают! Вот и думаю теперь! Может мы не от того вообще лечимся! Голова кругом!
BRIDE
я с дитем прошла тоже самое, что и у вас сейчас. Нам бактериофаг не помог, а помог именно иммуноглобулин. Вы поищите через инет, может знакомые в Алмате есть, там он стоит гораздо дешевле. Позвоните еще в сетьа птек, вам по крайней мере назовут те аптеки где он есть. мы года 1,5 назад платили около 4 тыс., но 10 ампул вам покупать и не надо. Нам хватило всего 1 штуки.
Обратитеь в инфекционку, там есть врач доцент Гуля Токтоболотовна, она вам обязательно поможет !
Ну вот, пришла к педиатру с нашими анализами. Она округлила глаза и сказала, что срочно нужно пить антибиотик. Рифампицин.
Вот только я никак своими мозгами понять не могу, в описании препарата написано, что рифампицин показан при ТУБЕРКУЛЕЗЕ и лепре и грамположительных бактерий, против грамотрицательных он малоэфективен. При чем вызывает быстрое привыкание бактерий к нему. Вызывает диарею у детей.
Почитала про ципрофлаксацин. Он от всего. очень мощный антибионтик, и легче переносится, чем рифампицин. Действует против кишечных инфекций, стафилококов, про рифампицин такого не сказано. Так ЗАЧЕМ его назначают.
Педиатр меня убеждала, что рифампицин нужно пить не менее 5 дней по 3(!) раза в день! Тогда как моей знакомой мальчику назначили его только на 2 дня!
При чем педиатр убеждала, что НИЧЕГО больше нет, кроме рифампицина! Я не понимаю!
Сказали, что лейкоциты в большом количестве и наличие крови в кале- это очень плохо. Вот так. Без антибиотика не выйдет. Как же дети раньше выживали?
рифампицин хороший антибиотик, хорошо переносится детками и спектр действия у него большой. а вот ципрофлоксацин дают детям, только когда нет другого выхода, он оказывает токсическое действие на метафизарный хрящ и замедляет рост ребенка и назначать его можно после 15 лет. а вы сдавали кал на посев? если нет сдайте с определением чувствительности микробов к антибиотику. это можно сделать в инфекционке и в лаборатории НГ, это где поликлиника ахмадеда, с торца. кроме рифампицина есть еще гентамицин, который можно давать пить, он хорош тем, что не всасывается со слизистой, действует только в просвете кишечника и как следствие не оказывает системного действия.
Тогда как моей знакомой мальчику назначили его только на 2 дня!
Сказали, что лейкоциты в большом количестве и наличие крови в кале
При стафилококковой пневмонии рекомендуется ванкомицин. Анаэробная инфекция поддается лечению клиндамицином в сочетании с гентамицином, ме тронидазолом в комбинации с антианаэробными бета-лактамами (пиперацил-лин + тазобактам, цефоперазон + сулбактам).
Грибковое поражение легких требует применения в/в амфотерицина В в ви де монотерапии или в комбинации с флуконазолом.
Пневмонии у больных с иммунодефицитом имеют свои особенности. Это связано с двумя обстоятельствами. Во-первых, для них высок риск забо леть не только обычными бронхо-легочными инфекциями, но и так называе мой оппортунистической инфекцией. Во-вторых, очень высока летальность, достигающая 45%, а в особых случаях (легочный аспергиллез при трансплан тации костного мозга или мультирезистентный туберкулез у ВИЧ-инфициро-ванных) составляющая 80%.
Альвеолярные макрофаги и полинуклеарные клетки играют большую защит ную роль, ограничивая проникновение и инвазию ингаляционных патогенов в ткань легких. Снижение количества или функциональная недостаточность этих клеток определяют высокий риск возникновения бронхо-легочной инфекции.
Дефицит иммуноглобулинов, особенно Ig G и 1д А, сниже ние уровня комплемента, нарушение функции реснитчато го эпителия слизистой трахеи и бронхов - факторы, опре деляющие неспособность легких противостоять инфекции.
Своеобразие пневмоний у больных с иммунодефицитом объясняется тем, что существует определенное соответствие между иммунным дефектом и возбудите лями инфекции. Клеточный иммунодефицит предрасполагает к развитию пневмо ний, вызываемых различными патогенами: грибами, бактериями, паразитами, ви русами, в том числе цитомегаловирусом, вирусом герпеса простого, герпеса зос тер, варицеллы зостер, аденовирусами, респираторным синцитиальным вирусом. При иммунодефиците обычно выявляют пневмококк и гемофильную палочку.
Вид легочного инфильтрата (локальный, диффузный, интерстициальный, цилиарный, с образованием полос тей) не может служить ориентиром для определения возбудителя, так как он неспецифичен для различных возбудителей бронхо-легочной инфекции.
Больных с иммунодефицитом подразделяют на 4 группы. В первую входят пациенты с гранулоцитопенией, острым началом пневмонии, быстрым уплотне нием, нейтропенией и гипоксемией. Высокая вероятность бактериальной пнев монии (до 55% случаев), ассоциирующейся с бактериемией, диктует необходи мость применения препаратов, воздействующих на синегнойную палочку. Хотя она не всегда высевается, тем не менее высокая летальность при этой инфек ции оправдывает применение бета-лактамов в комбинации с аминогликозидами.
При наличии нейтропении у больных хроническим лимфолейкозом, множествен ной миеломой, раком легких, с удаленной селезенкой высок риск не только инфици рования грамотрицательными бактериями, но и возникновения фульминантной пнев мококковой инфекции. Азтреонам или ципрофлоксацин при достаточной активнос ти против синегнойной инфекции слабо действуют на пневмококк. В таких случаях необходимо комбинировать эти препараты с пенициллином или ванкомицином.
У пациентов с нейтропенией, а также с возвратной или персистирующей лихорадкой, но с длительным легочным уплотнением (более 4 суток) и образо ванием популярных полостей чаще всего выявляют грибковое поражение лег ких (аспергиллез, мукормикоз или кандидоз). При грибковом поражении целе сообразно использовать амфотерицин В в дозе 1 мг/кг в день (общая суточная доза - до 2 г). Следует иметь в виду, что современные липосомальные формы амфотерицина В обладают более высокой биодоступностью и меньшим чис лом побочных эффектов. Имеются данные о высокой эффективности при ми козах легких флуконазола (дифлюкана), обладающего гораздо лучшей перено симостью и хорошими фармакокинетическими характеристиками.
Ко второй группе относят больных с Т-клеточным иммунодефицитом и полостями в верхних долях легкого. Нередко возбудителем такой инфекции становится мультирезистентная микобактерия туберкулеза. Подтверждением этого предположения могут служить анамнез, контакт с больными туберкуле зом и положительная туберкулиновая проба.
У тех, кто перенес системный микоз или ранее находился в эндемичных районах, можно предположить легочный кокцидиомикоз или гистоплазмоз. В этих случаях показан амфотерицин В. У имеющих контакт с домашними жи вотными нередко причиной пневмонии и распада легкого является Rodococcus equi. Поскольку это внутриклеточный патоген, антибиотик должен проникать внутрь клеток. В таких случаях длительно применяют комбинацию эритроми цина (или других новых макролидов) с рифампицином.
Если пневмония сочетается с подкожными абсцессами и абсцессом мозга, имеется большая вероятность инвазии нокардиями. Этот возбудитель чувстви телен к комбинации триметоприм + сульфаметоксазол или другие сульфанила мидные препараты.
Третью группу составляют пациенты с острым началом пневмонии и диф фузными альвеолярными инфильтратами, а также с диареей, головокружени ем, обмороками, поражением печени. Поскольку в таких случаях велика веро ятность инфицирования легионеллами, препаратами выбора являются фтор хинолоны, комбинации эритромицина с рифампицином или фторхинолоном. При аналогичной клинической картине у пациента с уртикариями, зудом, эози нофилией, находившегося ранее в эндемичных районах, можно предположить гельминтную инвазию. Пневмония, связанная с гельминтозом, хорошо подда ется лечению тибендазолом - 25 мг/кг в день в/в в течение 15 дней.
Четвертая группа - это пациенты с Т-клеточным иммунодефицитом, подо стрым началом пневмонии, диспноэ и гипоксией, интерстициальным инфильт ратом, у которых выделяют пневмоцистис карини. Возможно (но не обяза тельно) наличие ВИЧ-инфекции. Показано лечение триметоприм + сульфаме токсазол в дозе 20-100 мг/кг в день - в первые 4 дня в/в, а затем внутрь.
Интерстициальная пневмония в сочетании с поражением кожи и слизистых может быть вызвана вирусом герпеса. В этих случаях выраженный эффект ока зывает ацикловир. У пациентов с трансплантированными органами и тканями (особенно с пересаженным костным мозгом) или у больных СПИДом высок риск заболеть цитомегаловирусной пневмонией. В такой клинической ситуации важно отличить вирусную пневмонию от пневмоцистного поражения, что уда ется сделать, проведя анализ жидкости при бронхоальвеолярном лаваже.
Эффективность ацикловира при вирусной пневмонии у разных больных различ на. У страдающих СПИДом она выше (60-80%), чем у пациентов с транспланти рованным костным мозгом (10-40%). Дополнительное применение специфичес кого иммуноглобулина повышает выживаемость больных с цитомегаловирусной пневмонией. У больных с трансплантированными органами или костным мозгом интерстициальную пневмонию нередко вызывает токсоплазма гонди. При такого рода пневмонии оказывает эффект комбинация пириметамина с сульфадиазином.

Трофические язвы являются частым осложнением различных заболеваний. В основе патогенеза язвенного дефекта лежит глубокое нарушение трофики тканей кожных покровов, приводящее к образованию зоны некроза с перифокальным воспалением, отеком, нарушением микроциркуляции и иннервации [1].
Кожа является средой обитания различных микроорганизмов. Она представлена коагулазонегативными стафилококками (эпидермальным, сапрофитическим), липофильными и нелипофильными коринобактериями, анаэробными пропионобактериями. Реже встречаются коагулазопозитивные стафилококки (золотистый стафилококк), грамотрицательные бактерии (энтеробактерии). При сохраненной структуре и функции кожи нормальная микрофлора не проявляет патологического воздействия. С нарушением трофики кожи снижается ее барьерная функция и меняется микропейзаж, что ведет к гнойно-некротическим осложнениям [6,10].
У больных с нарушением венозного или артериального кровотока, на фоне отека и выраженных метаболических нарушений, образованию язвы может предшествовать механическое повреждение кожного покрова: укус насекомых, расчесы, трещины, царапины, бытовые и производственные травмы. Механические травмы при этом являются лишь пусковым моментом, с последующим развитием воспалительной реакции мягких тканей. В условиях венозного и лимфатического стаза незначительное инфицирование приводит к быстрому распространению инфекции с развитием острого индуративного целлюлита. На этом фоне площадь и глубина язвы увеличиваются, раневое отделяемое приобретает гнойный характер. Нередко отмечаются симптомы гнойно-резорбтивной лихорадки (гипертермия, лейкоцитоз, рост СОЭ и др.), свидетельствующие о наличии системной воспалительной реакции. В результате бактериальной агрессии расширяется площадь некробиотического процесса, развивается фиброз кожи и подкожной клетчатки, еще более ухудшаются лимфатический отток и микроциркуляция [1,6,10].
Антибактериальная терапия в комплексном лечении трофических язв показана при системной и/или выраженной местной воспалительной реакции. Практически у всех пациентов с длительно существующими трофическими язвами вследствие раздражения кожи обильным раневым отделяемым и различными мазевыми повязками имеет место перифокальный дерматит, пиодермия, экзема, иногда развивается рожистое воспаление. При проникновении стафилококковой инфекции глубоко в кожу развивается диффузная пиодермия, сопровождающаяся появлением гнойных фолликулов, импетиго и эрозий. Вторичное микробное поражение окружающей кожи приводит к увеличению размеров язвы и является показанием к применению антибиотиков. Обычно назначаются пенициллины, фторхинолоны, цефалоспорины и дополнительно – препараты имидазолового ряда (метронидазол). Местно используют антибактериальные мази [1,10,12]. Стандартная длительность антибактериальной терапии при венозных трофических язвах составляет 7-10 дней.
В амбулаторных условиях, как правило, не производятся микробиологические исследования раневого отделяемого трофических язв, тогда как от вида микроорганизма-возбудителя зависит характер раневого процесса и выбор антибактериальной терапии.
Возбудителями большего числа гнойно-септических заболеваний по-прежнему являются стафилококки. Обычно они чувствительны к бета-лактамным антибиотикам, макролидам, рифампицину, ко-тримоксазолу, фузидину, фосфомицину, клиндамицину. Некоторые штаммы стафилококков несут ген резистентности к бета-лактамам [16]. Маркером данного типа резистентности является резистентность к оксациллину. По данным многоцентрового исследования CERBERUS, в котором исследовались метициллинрезистентные стафилококки в 36 крупных городах России, удельный вес золотистого стафилококка резистентного к оксациллину (метициллину) варьировал от 13 до 75%. Уровень метициллинорезистентности эпидермального стафилококка (S. Epidermidis) – от 11 до 91%. Чаще всего эпидермальный стафилококк не является возбудителем инфекции, а лишь контаминирует биоматериал, но его выделение у иммунокомпрометированных больных может иметь клиническое значение и требовать назначения соответствующей антибактериальной терапии [9,11,19].
Раневая инфекция трофических язв оказывает непосредственное токсическое действие на окружающие ткани, снижает местный и общий иммунитет, вызывая специфическую микробную сенсибилизацию организма, усугубляя трофические расстройства. Учитывая все перечисленное, в первой фазе раневого процесса трофических язв результаты бактериологического исследования играют основное значение, определяющее тактику лечения и, в первую очередь, выбор антибактериального препарата [2,6].
Обычно применяемые методы определения вида микроорганизма и его антибиотикорезистентности (культуральный и диско-диффузионный соответственно) позволяют получить результат лишь на 3 сутки, поэтому для обоснованного эмпирического выбора антибактериального препарата необходимы данные локального микробиологического мониторинга видового состава и антибиотикорезистентности возбудителей.
Важно также стратифицировать пациентов по тяжести состояния и степени риска резистентных возбудителей и применять деэскалационную тактику антибактериальной терапии. При отсутствии факторов риска резистентной флоры для эмпирической антибактериальной терапии можно выбрать: внутрь – цефуроксим, амоксициллин/клавуланат; парентерально – цефазолин+/-цефтазидим; амоксициллин/клавуланат +/- цефтазидим. При тяжелом состоянии, наличии факторов риска резистентных возбудителей (предшествующие приемы антибиотиков, контакты с медицинскими учреждениями, иммуносупрессивная терапия и др.) препараты выбора должны перекрывать всех потенциальных возбудителей с учетом их вероятной резистентности: парентерально – карбапенемы (эртапенем, меропенем, имипенем, дорипенем) или ингибитор-защищенные антисинегнойные бета лактамы (пиперациллин/тазобактам, цефоперазон/сульбактам) + антибиотик с анти-MRSA активностью (цефтаролин, даптомицин, линезолид или ванкомицин). В монотерапии возможно применение тигециклина у больных средней степени тяжести, если нет риска псевдомонадной (в том числе синегнойной) инфекции. При легкой и средней степени тяжести состояния возможно проведение антибактериальной терапии пероральными препаратами, в тяжелых случаях показано внутривенное введение антибиотиков [7,8,11,18].
После идентификации возбудителя и получения антибиотикограммы необходимо провести оценку проводимой антибактериальной терапии. При выделении из раневого отделяемого оксациллин-чувствительных стафилококков препаратами выбора могут быть беталактамные антибиотики. В арсенале врача имеется достаточно препаратов как перорального, так и парентерального пути введения: цефалексин, цефуроксим, оксациллин, цефазолин, амоксициллин/клавуланат, ампициллин/сульбактам. Цефалоспорины III поколения (цефотаксим, цефтриаксон, цефоперазон, цефтазидим, цефокситин) обладают недостаточной противостафилококковой активностью [7,8,9].
При резистентности стафилококков к оксациллину все бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы) неэффективны [3]. Часто отмечается сочетанная резистентность метициллинрезистентных стафилококков к макролидам, тетрациклинам, фторхинолонам, линкозамидам, рифампицину. Препаратами выбора в таких случаях являются: ванкомицин, линезолид, цефтаролин, даптомици, тигециклин, телаванцин. [3,7,11]. Антибиотики других групп – фторхинолоны, фосфомицин, фузидин, рифампицин, макролиды, сульфаниламиды – могут назначаться лишь при подтвержденной чувствительности возбудителя. Таким образом, выбор адекватной антибактериальной терапии в случаях оксациллин/метициллин-резистентности существенно затруднен. Задача осложняется и тем, что линезолид и тигециклин обладают лишь бактериостатическим действием. В условиях нарушенной микроциркуляции страдает доставка лекарственных препаратов к очагу поражения и бактериостатические антибиотики могут оказаться неэффективными. Препаратов с бактерицидным действием, одобренных для применения при инфекции кожи и мягких тканей, немного: ванкомицин, даптомицин, цефтаролин и телаванцин. Однако, в последние годы в РФ и за рубежом большинство штаммов MRSA имеют сниженную чувствительность к ванкомицину, что ведет к его клинической неэффективности при использовании стандартного режима дозирования препарата. Детекция данного вида резистентности проводится с помощью Е-теста, позволяющего определять минимальную подавляющую концентрацию (МПК) ванкомицина. В случаях выделения штаммов со сниженной чувствительностью к ванкомицину возможно его назначение в дозе 3-4 г/сут. Исследований эффективности и безопасности при трофических язвах различной этиологии не проводилось. Возможны токсические, прежде всего нефротоксические, осложнения при данном режиме дозирования ванкомицина у больных с факторами риска. Кроме того, необходимо учитывать, что ванкомицин не активен в отношении обычных, чувствительных к оксациллину, штаммов стафилококков, что не позволяет включать его в схемы эмпирической антибактериальной терапии как универсальный антистафилококковый препарат. В отличие от ванкомицина, новые препараты с анти–MRSA активностью (даптомицин, цефтаролин, телаванцин) одинаково хорошо работают как в отношении MRSA, так и в отношении чувствительных к оксациллину штаммов стафилококков (MSSA) [3,7,15].
Резистентность к цефтазидиму – маркер выработки бета-лактамаз расширенного спектра. При выявлении у энтеробактерий резистентности к цефтазидиму не следует использовать цефалоспорины (I-IV поколения), даже в случаях их лабораторно подтвержденной чувствительности [15]. Препаратами выбора могут быть пиперациллин/тазобактам, цефоперазон/сульбактам. При детекции резистентности к карбапенемам целесообразно использовать высокие дозы антисинегнойных карбапенемов (имипенема, меропенема, дорипенема) путем продленных инфузий с дополнительным назначением ингибиторов бета-лактамаз (или препаратов их содержащих). При выделении из трофических язв псевдомонад так же необходимо учитывать данные антибиотикограммы [3,5,7,11,18]. Препаратами альтернативного выбора при выделении полирезистентных грамм-отрицательных возбудителей (энтеробактерий, псевдомогад) могут быть препараты полимиксина-Б для парентерального и местного применения [5, 7,11].
В связи с нарушением микроциркуляции, предпочтительно назначение максимальных доз антибиотиков и использование внутривенного пути введения, поэтому пациенты с трофическими язвами нижних конечностей для купирования инфекционного процесса должны проходить курс стационарного лечения [20].
В качестве местной терапии в дополнение к системной антибактериальной терапии, могут использоваться препараты бактериофагов, антисептики. Целесообразно определять чувствительность возбудителей и к бактериофагам, так как часть возбудителей к ним могут быть нечувствительны. Местное использование большинства антибиотиков в виде обкалывания, присыпания поверхности раны нецелесообразно: под действием кислой среды раневого отделяемого трофических язв они быстро расщепляются и инактивируются [3,7].
Таким образом, в 1 фазе раневого процесса результаты бактериологического исследования трофических язв играют основное значение при определении тактики лечения и, в первую очередь, выбора антибактериального препарата.
Возросший уровень резистентности микроорганизмов требует стратификации групп пациентов и дифференцированного выбора схемы антибактериальной терапии.
Антибактериальную терапию гнойных осложнений трофических язв предпочтительно осуществлять в условиях стационара в комплексе с интенсивной терапией основного заболевания, с парентеральным введением препаратов.

Наиболее трудными для лечения являются инфекции, вызванные метициллинорезистентными штаммами S. aureus (MRSA) и S. epidermidis (MRSE), в частности инфекции области хирургического вмешательства после больших ортопедических операций. Распространенность штаммов MRSA в России высока. Несмотря на то, что по данным многоцентрового исследования в структуре бактериальных возбудителей нозокомиальных инфекций за 2011–2012 гг. доля S. aureus составила 16,7 %, что сопоставимо с данными 2006–2008 гг. (19,5 %), существенно увеличилась значимость метициллинорезистентных штаммов данного возбудителя. Доля MRSA составляла 33,4 % в 2001–2002 гг. и 55,4 % в 2006–2008 гг., возросла до 66,9 % к 2011–2012 гг. [5]. Выделение метициллинорезистентных штаммов S. aureus и S. epidermidis из гнойного очага при перипротезной инфекции является неблагоприятным прогностическим признаком для эффективности антибактериальной терапии и лечения в целом. В РФ до настоящего времени препаратом выбора при MRSA- и MRSE-ассоциированных инфекциях остаётся гликопептидный антибиотик ванкомицин. Однако в настоящее время в научной медицинской литературе многие авторы отмечают снижение эффективности ванкомицина при антибактериальной терапии инфекций, вызванных метициллинорезистентными стафилококками, in vitro демонстрирующими чувствительность к ванкомицину [9]. Это определяет необходимость применения эффективных комбинаций уже известных лекарственных средств разных классов, обладающих синергидным действием в отношении лекарственноустойчивых микробных возбудителей. К примеру, сохранившие активность рифампицин и фузидиевую кислоту для достижения хорошего антистафилококкового эффекта необходимо сочетать c β-лактамами или фторхинолонами [8]. Многие зарубежные исследователи предлагают широко использовать комбинированную антибактериальную терапию при лечении инфекции протезированного сустава стафилококковой этиологии для усиления бактерицидного эффекта, воздействия на микробные биопленки и на клетки бактерий, расположенные внутриклеточно [8].
Целью настоящего исследования было оценить in vitro активность комбинации гентамицина и диоксидина, обладающих принципиально различным механизмом антимикробного действия, в отношении штаммов метициллинорезистентных стафилококков.
Материалы и методы исследования
FIX = FIC (одного антибиотика) + + FIC (второго антибиотика),
где FIC (fractional inhibitory concentrations) – фракционная ингибирующая концентрация исследуемого антибиотика, определяемая как отношение величины минимальной подавляющей концентрации (МПК) этого антибиотика в комбинации с МПК второго антибиотика. Характера взаимодействия препаратов определяли по величине коэффициента FIX согласно шкале: 4 антагонизм.
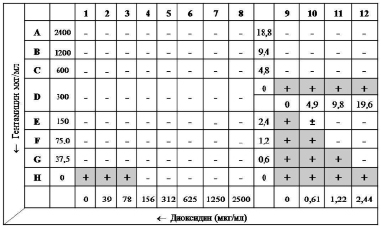
Технически метод осуществляли следующим образом: в каждую лунку 96-луночного планшета вносили по 50 мкл питательного бульона Мюллера-Хинтон (МХБ). Антимикробные препараты титровали серийно двукратно: гентамицин с концентрации 2400 до 0 мкг/мл (ряды A-H), диоксидин – с 2500 до 0 мкг/мл (колонки 1–12) (рис. 1).
Инокулюм каждой тест-культуры (0,5 McFarland) готовили в стерильном изотоническом растворе. В каждую лунку вносили по 100 мкл инокулюма и инкубировали планшет 18 ч при 37 °C. За МПК (в мкг/мл) принимали наименьшую концентрацию антимикробного средства, при которой не наблюдалось видимого роста микроорганизма. Далее для тестируемых штаммов S. aureus рассчитывали коэффициенты FIX. На основе значений фракционных коэффициентов FIC строили изоболограмму и оценивали ее характер.
Количественные результаты представлены в виде медиан, в качестве меры рассеивания использовали межквартильный интервал 25–75 % (МКИ 25–75 %).
Результаты исследования и их обсуждение
Установленные по результатам 3-х экспериментов медианы МПК (табл. 1) показали крайне невысокую активность диоксидина при воздействии как на штаммы устойчивые к метициллину (156 мкг/мл), так и чувствительные (39 мкг/мл). Кроме того, МПК гентамицина в отношении тестируемых изолятов MRSA также в 4 раза превысила МПК для чувствительных к метициллину референс-штаммов. Однако применение антимикробных препаратов в комбинации потребовало существенно меньших их концентраций для эффективного подавления возбудителей.
Медианы коэффициентов FIC и FIX взаимодействия гентамицина и диоксидина свидетельствуют (табл. 2) об эффективном действии изучаемой комбинации в отношении всех тестируемых культур стафилококков. Величина итоговых коэффициентов FIX во всех случаях не превысила 0,5 и составила для всех штаммов 0,09–0,26, что характерно для синергидного действия препаратов. Установлено, что, несмотря на выявленное синергидное действие в отношении метициллинорезистентных изолятов стафилококков устойчивых к гентамицину, коэффициент FIX для них был выше, чем для референс-штаммов, чувствительных к метициллину и гентамицину.
Читайте также:


