Как называется лекарство от стафилококка




Стерильный очищенный фильтрат фаголизатов бактерий рода Staphylococcus (с активностью по Аппельману - не менее 10 -5 ) - до 1 мл.
Представляет собой прозрачную жидкость желтого цвета различной интенсивности, возможен зеленоватый оттенок.
Препарат вызывает специфический лизис бактерий Staphylococcus.
Лечение и профилактика гнойно-воспалительных и энтеральных заболеваний, вызванных бактериями рода Staphylococcus у взрослых и детей:
заболевания уха, горла, носа, дыхательных путей и легких (воспаления пазух
носа, среднего уха, ангина, фарингит, ларингит, трахеит, бронхит, пневмония, плеврит);
хирургические инфекции (нагноения ран, ожоги, абсцесс, флегмона, фурункулы, карбункулы, гидроаденит, панариции, парапроктит, мастит, бурсит, остеомиелит);
урогенитальные инфекции (уретрит, цистит, пиелонефрит, кольпит, эндометрит, сальпингоофорит);
энтеральные инфекции (гастроэнтероколит, холецистит), дисбактериоз кишечника;
генерализованные септические заболевания;
гнойно-воспалительные заболевания новорожденных (омфалит, пиодермия, конъюнктивит, гастроэнтероколит, сепсис и др.);
другие заболевания, вызванные стафилококками.
При тяжелых проявлениях стафилококковой инфекции препарат назначается в составе комплексной терапии.
С профилактической целью препарат используют для обработки послеоперационных и свежеинфицированных ран, а также для профилактики внутрибольничных инфекций по эпидемическим показаниям.
Важным условием эффективной фаготерапии является предварительное определение чувствительности возбудителя к бактериофагу и раннее применение препарата.
Индивидуальная непереносимость или чувствительность к любому из компонентов препарата.
Целесообразно применение препарата при наличии инфекций, вызванных фагочувствительными штаммами стафилококков (по рекомендации врача).
Препарат используют для приема внутрь (через рот), ректального введения, аппликаций, орошений, введения в полости ран, вагины, матки, носа, пазух носа и дренированные полости. Перед употреблением флакон с бактериофагом необходимо взболтать и просмотреть. Препарат должен быть прозрачным и не содержать осадка.
16 августа 2016
- 9918
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
Рисунок 1. Staphylococcus aureus и лейкоциты.
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
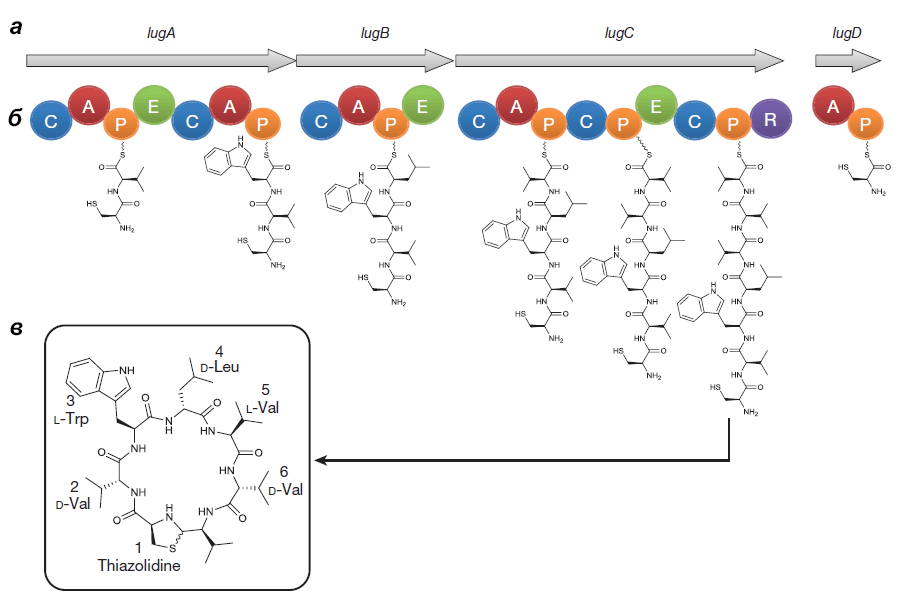
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
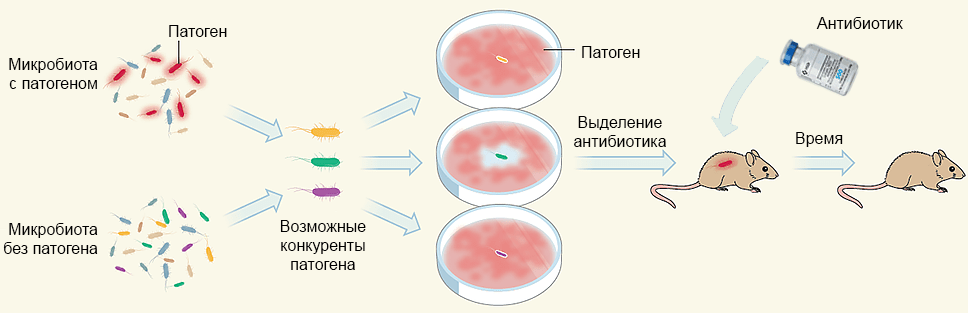
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
МРЗС передается при непосредственном физическом контакте с бактериями. МРЗС также передается через предметы, зараженные человеком, являющимся носителем бактерий, такие как повязки, полотенца, постельное белье или спортивный инвентарь. Обычно бактерии не передаются через воздух. Однако они могут передаваться при непосредственном контакте с жидкостью, выделяемой при кашле или чихании. Если у вас кожная инфекция МРЗС, существует риск рецидива в будущем.
При подозрении на инфекцию МРЗС врач может сделать посев выделений из раны (wound culture) для подтверждения диагноза. При наличии абсцесса он может быть дренирован. Вероятно, вам будет назначен один или несколько антибиотиков, которые действуют на МРЗС.
Уход в домашних условиях
Принимайте антибиотики в точном соответствии с назначением. Даже если вы почувствовали себя лучше, не прекращайте принимать их, пока они не закончатся, или до тех пор, пока не получите указание прекратить их прием от своего лечащего врача.
Если вам была назначена мазь с антибиотиком, применяйте ее в соответствии с полученными указаниями.
В течение 5 дней ежедневно мойте все тело (от волосистой части головы до пальцев ног) специальным мылом. Два раза в день чистите ногти пальцев рук в течение 1 минуты щеткой со специальным мылом.
Раны должны быть закрыты чистыми и сухими повязками. Если повязки загрязнились, их необходимо заменить. Каждый раз, когда вы меняете повязку или касаетесь раны, тщательно мойте руки.
Если у вас наращенные ногти или лак на ногтях, их необходимо снять.
Если у вас диагностировано возможное заражение инфекцией МЗРМ, ваши близкие, живущие вместе с вами, подвержены более высокому риску наличия бактерий на коже или в носу, даже при отсутствии признаков инфекции. Бактерии необходимо удалить с кожи всех членов семьи одновременно, чтобы они не передавались от одного к другому. Проинструктируйте их, как следует удалить бактерии:
Члены семьи должны использовать специальное мыло, как описано выше.
Если у кого-либо из членов семьи имеется кожная инфекция, ее должен лечить врач. Чтобы вылечить инфекцию МРЗС, мытья не достаточно.
Очистите столешницы и детские игрушки.
Каждый член семьи должен пользоваться только своими предметами личного обихода, такими как зубные щетки или бритвенные станки. При этом пользоваться общими очками, тарелками и столовыми приборами разрешается.
Часто мойте руки простым мылом и теплой водой. Обязательно очищайте зоны под ногтями, между пальцами и запястья. Вытирайте руки одноразовыми полотенцами (например, бумажными). Если нет возможности воспользоваться мылом и водой, можно использовать антисептик для рук на основе спирта. Втирайте антисептик по всей поверхности рук, пальцев и запястий до полного высыхания.
Не пользуйтесь чужими предметами личного обихода, такими как полотенца, бритвенные станки, одежда или униформа. Стирайте постельное белье, полотенца и одежду в горячей воде со стиральным порошком. Устанавливайте для сушилки режим высокой температуры, чтобы убить оставшиеся бактерии.
Если вы посещаете тренажерный зал, до и после каждого применения протирайте инвентарь антисептиком на основе спирта. Также протирайте все ручки и места, за которые беретесь руками.
Если вы занимаетесь спортом, после каждой тренировки принимайте душ с обычным мылом. Каждый раз после душа используйте чистое полотенце.
Последующее наблюдение
Приходите на контрольные приемы, назначенные вашим врачом, или в соответствии с указаниями, полученными от наших сотрудников. Если был сделан посев выделений из раны, получите результаты в указанное время. Если в ваш курс лечения будут внесены какие-либо изменения, вам о них сообщат.
Если у вас был диагностирован МРЗС, в будущем вам необходимо будет сообщать медицинскому персоналу о том, что вы проходили лечение от этой инфекции.
Когда необходимо обратиться за медицинской помощью
В любом из следующих случаев обратитесь в обслуживающее вас медицинское учреждение:
Усиливающееся покраснение, опухание или боль
Красные полосы в коже вокруг раны
Слабость или головокружение
Появление гноя или выделений из раны
Температура выше 100,4 ºF (38,0 ºС) или в соответствии с указаниями вашего лечащего врача
Недавно американские биохимики смогли разгадать одну из самых сложных загадок, которые загадывает людям золотистый стафилококк, пренеприятнейший и опаснейший для человечества микроорганизм. Ученые выяснили, каким образом он может нейтрализовать действия иммунных клеток. Оказалось, что бактерия использует для этого их же собственное оружие.

Одной из самых опасных для человечества болезнетворных бактерий является золотистый стафилококк (Staphylococcus aureus), постоянными носителями которого являются около 20 процентов населения Земного шара — он может достаточно долго сохраняться на кожных покровах и слизистых оболочках верхних дыхательных путей человека. Этот микроорганизм вызывает целый ряд заболеваний, начиная от кожных раздражений и фурункулов, и заканчивая такими опасными болезнями как пневмония, менингит, остеомиелит, эндокардит, инфекционно-токсический шок и сепсис. Однако самое опасное в нем то, что стафилококк не только весьма устойчив к действию антибиотиков (что происходит от способности бактерии быстро мутировать в "нужном направлении"), но и нечуствителен к "атакам" со стороны иммунных клеток человека.
Вообще, когда наблюдали за поведением этой бактерии в живом организме, то создавалось впечатление, что наши клетки-защитники смертельно боятся стафилококка. Обычно вокруг патогенного микроорганизма после попадания его в тело человека сразу же собираются стройные ряды тех, кто защищает наше здоровье. Причем первыми подходят клетки, известные как нейтрофилы — в их задачу входит задержать "нарушителя" до тех пор, пока не появится "тяжелая артиллерия" в виде макрофагов-моноцитов. Именно они-то и уничтожают носителя инфекции.
Однако, в случае со стафилококком, заключительного этапа данной "операции" почему-то не происходит — макрофаги совсем не стремятся приблизится к зловредному микроорганизму, словно он чем-то отпугивает их. Но что это может быть? Недавно группе ученых из медицинского центра Чикагского университета (США), которой руководил профессор Олаф Шнеевинд, удалось выяснить, каким именно образом стафилококку удается успешно отражать атаки иммунных клеток. И самым интересным оказалось то, что микроорганизм побеждает своих противников, используя их собственное оружие.
Сначала исследователи выяснили, что среди всех штаммов S. aureus имеется один, содержащий мутацию генов, кодирующих ферменты под названием стафилококковая нуклеаза и аденозинсинтетаза. Оба этих белка нужны для того, чтобы разрушать нуклеиновые кислоты (например, наследственное вещество вирусов-бактериофагов, что проникают в бактериальную клетку). После ряда экспериментов выяснилось, что именно особи этого мутантного штамма наиболее эффективно "отбивают" атаки макрофагов. Ученых заинтересовал один вопрос — не могут ли быть связаны данные мутации со способностью бактерий противостоять действиям клеток-защитников?
Оказалось, что связь между двумя этими явлениями действительно имеется. Как было сказано выше, сначала на пути инфекционного агента всегда встают клетки-нейтрофилы, которые, обнаружив "нарушителя", начинают выбрасывать из своих ядер собственное ДНК во внешнюю среду (сами они при этом погибают). Эта ДНК собирается в структуру, напоминающую сложную сеть, в которой и запутывается бактерия. Таким образом нейтрофилам ценой собственной жизни уудается задержать патогенный микроорганизм до того момента, когда к нему приблизятся макрофаги и убьют его.
Так вот, проведенные группой Шнеевинда эксперименты с нормальными и мутантными штаммами стафилококков показали, что когда макрофаги подходили к запутавшимся в ДНК-овой сети бактериям, то, в том случае, если это был мутант, они просто… погибали. Более подробное изучение ситуации показало, что микроорганизмы убивали их каким-то токсином — у погибших макрофагов были все признаки клеточного "отравления". Но откуда стафилококки брали этот яд? Оказывается, они с помощью модифицированных ферментов стафилококковой нуклеазы и аденозинсинтетазы превращали компоненты нитей нейтрофильной ловушки в вещество под названием 2'-дезоксиаденозин, который смертельно опасен для макрофагов.
Таким образом, стафилококк научился бороться с защитными клетками, используя их же собственное оружие. Именно поэтому в последнее время этот микроорганизм стал практически неуязвимым для человеческого иммунитета. И сразу же стало ясно, что прежняя стратегия борьбы с этим вредителем была совершенно не рациональной — она как раз подразумевала то, что если больной стафилококковой инфекцией будет принимать лекарства, стимулирующие иммунитет, то он сможет справится со стафилококком (эта стратегия была избрана после появления у стафилококка штаммов вроде MRSA, которые не чувствительны к действию антибиотиков). Но после открытия ученых из группы профессора Шнеевинда стало ясно, что этим микроорганизм не остановить — сколько не стимулируй иммунитет, он все равно взломает "линию обороны" клеток защитников.
Впрочем, авторы работы уверены в том, что отчаиваться не следует — нужно просто пересмотреть саму стратегию. Хотя с их точки зрения, справиться с вышеописанной особенностью бактерии, которая позволяет ей избавляться от макрофагов, будет непросто: если начать создавать препараты, блокирующие действия "мутантных" бактериальных ферментов и дезоксиаденозина, то есть риск того, что эти лекарства смогут повредить и человеческому организму. Однако все-таки, по мнению биохимиков, разработать такое вещество, которое смогло бы и бактерию ее оружия лишить, и больному хуже не сделать, все-таки возможно…
Читайте самое интересное в рубрике "Наука и техника"
В начале 1970-х годов врачи начали считать, что при наличии большого количества эффективных антимикробных препаратов практически все бактериальные инфекции можно вылечить. Однако их оптимизм постепенно начал угасать, поскольку появилась резистентность к различным антибиотикам у многих бактерий, в частности к Staphylococcus aureus. В настоящее время полимедикаментозная резистентность — это довольно распространенное явление при инфекциях, вызванных золотистым стафилококком, представляющее серьезную проблему для практических врачей.
Вероятно, Staphylococcus aureus является одним из самых сложных возбудителей, поскольку он имеет высокую вирулентность, мощный потенциал вызывать различные угрожающие жизни инфекции и уникальную способность адаптироваться к изменяющимся условиям окружающей среды (Lowy, 1998; Waldvogel, 2000) 1 . Золотистый стафилококк часто персистирует на кожных покровах и в носовой полости, не вызывая каких-либо заболеваний (Zeller, 2007) 2 . Тем не менее, нередко он является причиной тяжелых инфекций и даже смерти пациента.
Инфекции, вызванные метициллин-резистентным Staphylococcus aureus (MRSA), намного сложнее, так как указанные штаммы бактерий резистентны также и ко многим другим антибиотикам. Ежегодно приблизительно 19 000 лиц в США умирает вследствие инфекции MRSA. В 2005 году смертность от MRSA инфекций в США составляла 6,3 на 100 000 лиц (Klevens et al., 2007)3. Смертность от бактериемии, вызванной золотистым стафилококком, сохраняется на очень высоком уровне — 20–40%, несмотря на доступность эффективных антибиотиков (Mylotte et al., 1987) 4 .
В настоящее время Staphylococcus aureus является ведущей причиной внутрибольничных инфекций, частота которых возрастает (рис. 1), здесь доминирует MRSA (Klevens et al., 2007) 5 . Указанные инфекции чаще развивались у лиц старше 65 лет и у мужчин. Однако значение MRSA как причины внебольничных инфекций начинает возрастать (CDC, 2001; Diekema et al., 2001) 6 . Факторы риска внебольничных MRSA инфекций приведены в таблице 1.
Таблица 1. Факторы риска MRSA инфекций
Внутрибольничные MRSA инфекции
• Пребывание в заведениях длительного ухода
• Недавнее или продолжительное применение антибиотиков
Внебольничные MRSA инфекции
• Молодой возраст — несформированная иммунная система
• Участие в контактных видах спорта
• Передача полотенец и спортивного инвентаря
• Гипоиммунные состояния (например, СПИД)
• Проживание в условиях скученности и антисанитарии (например, тюрьмы)
Каждое третье лицо является носителем Staphylococcus aureus, но при этом всего лишь каждый сотый является носителем резистентных штаммов. MRSA выступает причиной 10% внутригоспитальных инфекций. Недавно было доказано, что MRSA встречается вдвое чаще, нежели предполагалось ранее (Sack, 2007) 7 .
Выбор оптимального лечения инфекций, вызванных S. aureus, сопряжен с двумя проблемами. Во-первых, нарастающая резистентность к различным антибиотикам. Во-вторых, сложность эрадикации золотистого стафилококка при внутриклеточной локализации.
Моксифлоксацин 9 является фторхинолоном нового поколения, обладающим расширенной активностью против грамположительных бактерий, включая стафилококки, а в нескольких исследованиях было доказано, что на фоне лечения данным препаратом селекция резистентных штаммов наблюдается намного реже, чем при приеме других антимикробных препаратов. Моксифлоксацин 10 можно считать идеальным антибиотиком для лечения стафилококковых инфекций, поскольку он сохраняет высокую бактерицидную активность против внутриклеточных S. aureus (данная локализация возбудителя довольно часто наблюдается при указанных инфекциях), а также он угнетает продукцию лейкотоксинов и факторов вирулентности золотистого стафилококка.
Фторхинолоны называют “последним самураем” в “противомикробной войне”. На них возлагаются большие надежды. Тем не менее. Резистентность к фторхинолонам более старых поколений становится все более распространенным явлением (Lowy, 2003) 11 .
Засвидетельствовано, что моксифлоксацин сохраняет высокую активность in vitro против ципрофлоксацин-резистентных стафилококков и при лечении данным препаратом вероятность селекции резистентных штаммов ниже (Ince et al., 2003) 12 . Причиной этого служит способность моксифлоксацина проявлять эффективность против Staphylococcus aureus и в других местах, в отличие от фторхинолонов предыдущих поколений (Durham et al., 1998) 13 . Из этого можно сделать вывод, что резистентность к фторхинолонам предыдущих поколений не означает резистентность к моксифлоксацину и, соответственно, снижение эффективности данного антибиотика.
Также есть сообщения, что моксифлоксацин сохраняет чрезвычайно низкую минимальную ингибирующую концентрацию (МИК) против ципрофлоксацин-резистентных штаммов S. aureus (Entenza et al., 2001) 14 , а следовательно, очень высокую активность. Активность моксифлоксацина против S. aureus намного выше, чем левофлоксацина (Lemmen et al., 2003) 15 . Также доказана высокая активность моксифлоксацина против золотистого стафилококка, резистентного к тейкопланину (один из новых антибиотиков с высокой противостафилококковой активностью) и ванкомицину (один из антибиотиков, наиболее активных против S. aureus) (табл. 2).
Таблица 2. Активность моксифлоксацина, ванкомицина и тейкопланина против S. aureus (Tarasi et al., 2003) 16
| Препарат | МИК M-C-RSA (мкг/мл) | МИК M-C-SSA(мкг/мл) | |
|---|---|---|---|
| МИК (мг/л) | |
|---|---|
| MSSA | MRSA |


