Инструкция по диагностике лечению и профилактике криптоспоридиоза животных
УТВЕРЖДАЮ
Руководитель Департамента ветеринарии В.М.Авилов
1 ноября 1997 г.
С утверждением настоящей Инструкции утрачивают силу "Временные методические указания по лабораторным исследованиям на криптоспоридиоз животных" от 09.06.88 г.
Криптоспоридиоз - зоонозная антропургическая протозойная болезнь с фекально-оральным механизмом передачи возбудителя. Характеризуется преимущественно поражением пищеварительного тракта, обезвоживанием организма и снижением массы тела. Возбудители криптоспоридиоза - паразитические простейшие (кокцидии) рода Cryptosporidium.
Криптоспоридии были впервые описаны как вид C.muris у мышей (Tizzer, 1907 г.), но их роль в этиологии кишечных инфекций животных и человека стала очевидной лишь в последние полтора десятилетня.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
Криптоспоридии относятся к классу Sporozoa, подклассу Coccidia. Их развитие протекает по схеме гомоксенного (однохозяинного) жизненного цикла кокцидии, т.е. полное развитие паразита происходит в организме хозяина (животного или человека) и завершается выделением с фекалиями ооцист диаметром 4-5 мкм, устойчивых к выделению неблагоприятных факторов, способных длительно сохраняться во внешней среде и заражать новых хозяев.
Заражение криптоспоридиями происходит при заглатывании ооцист с загрязненным кормом, водой или с предметом ухода за животными. Из ооцисты, попавшей в желудок животного, выходит 4 спорозоита, которые с содержимым желудочно-кишечного тракта проникают в задние участки тощей и подвздошную кишку и закрепляются на поверхности эпителия микроворсинок. Здесь они развиваются по схеме гомоксенного (однохозяинного) цикла кокцидии.
Процесс споруляции, т.е. формирование инвазионных спорозоитов в ооцисте совершается у криптоспоридии в кишечнике. Это имеет большое значение, так как выделяемые во внешнюю среду ооцисты оказываются инвазионными и способными заразить нового хозяина при попадании, а его пищеварительный тракт непосредственно после выделения из кишечника больного животного или паразитоносителя.
Весь процесс развития от попадания ооцисты в организм хозяина до выделения ооцист нового поколения у Криптоспоридии млекопитающих занимает 3-7 дней. При профузной диарее во внешнюю среду выделяются тонкостенные и толстостенные ооцисты, кроме того, в фекалиях обнаруживаются стадии развития - шизонты, содержание меронты, мерозоиты и возможно и другие стадии развития. Не все сформировавшиеся ооцисты выделяются во внешнюю среду: часть ооцист с тонкими оболочками могут вызывать аутоинвазию макроорганизма, обуславливая тем самым хроническое течение криптоспоридиоза.
Толстостенные ооцисты выделяемые во внешнюю среду могут сохранять свою инвазионность в течение нескольких месяцев. Они устойчивы ко многим дезинфектантам.
Криптоспоридии млекопитающих известны как паразиты преимущественно кишечного тракта. Однако они выявлены также и в других органах, тканях и биологических жидкостях (мокрота, бронхиальная слизь, рвотные массы).
У телят и поросят криптоспоридии обнаруживаются не только в кишечнике, а также в печени, трахее, конъюнктиве глаза и, возможно, в других органах.
Важной чертой патогенеза криптоспоридиоза является возможность его возникновения за счет экзо- и эндогенного заражения.
В первом случае заражение начинается с попадания ооцист в организм хозяина из внешней среды, во втором случае инвазия развивается вследствие аутоинвазии за счет мерозоитов и спорозоитов, сформировавшихся в тонкостенных ооцистах.
ДИАГНОСТИКА
Диагноз устанавливается на основании эпизоотологических и клинических данных, патоморфологических изменений и результатов лабораторных исследований.
Эпизоотологические данные. Животные заболевают в первые 2-3 суток после рождения. Источником заражения являются больные и переболевшие животные. Факторы передачи - инвазированные ооцистами окружающие предметы, молозиво, руки и спецодежда обслуживающего персонала. Заболевание возникает чаще в зимне-весенний период года. Предрасполагающими факторами являются нарушение ветеринарно-санитарных правил содержания, кормления свиноматок и гипогаммаглобулинемия новорожденного молодняка.
Клинические признаки. Препатентный период 1-3 суток, инкубационный период - 3-7 суток. Течение острое. Главные клинические симптомы - диарея. У больных поросят отмечают угнетение общего состояния, анорексию, прогрессирующее исхудание. Температура тела в начале болезни кратковременно повышается до 40,7 °С, с развитием токсикоза падает ниже 36 °С.

Анализ многочисленных литературных источников [1; 2; 4; 8] свидетельствуют о высоком интересе к проблеме криптоспоридиоза. Криптоспоридиоз – протозойная инвазия человека и животных, особенно опасная для молодняка сельскохозяйственных животных с иммунодефицитом. Инфекции желудочно-кишечного тракта, вызванные криптоспоридиями, зарегистрированы во всех регионах РФ и странах СНГ, а также на всех континентах, за исключением Антарктиды. Такое широкое распространение инвазии связано с большим количеством ее природных и синантропных резервуаров, низкой инфицирующей дозой и высокой резистентностью возбудителя к дезинфектантам и противопаразитарным препаратам. Криптоспоридии паразитируют преимущественно в кишечном тракте, но были обнаружены также в других органах, тканях и жидкостях (рвотные массы, мокрота, бронхиальная слизь).
Роль криптоспоридий в этиологии заболеваний животных в настоящее время установлена, но мало изучена [3]. Основные гистологические изменения наблюдаются в кишечнике больных животных. На слизистой оболочке отмечаются деформация ворсинок, единичные клетки слущенного эпителия, лимфоциты, гистиоциты и плазматические клетки. Криптоспоридии локализуются в просвете ворсинок, на их верхушках и боковых поверхностях, в микроворсинках эпителиального слоя тощей, подвздошной и в криптах слепой кишок [5; 6; 7]. В результате поражения микроворсинок нарушается всасывание питательных веществ, воды и электролитов, существенно страдает ферментативная деятельность кишечника.
Однако до сих пор криптоспоридиоз в ветеринарной практике почти не диагностируется и не указывается в ветеринарных отчетах. Причиной этого является неподготовленность ветеринарных специалистов и трудность диагностики ввиду микроскопического размера паразитов и частого участия в этиологии болезни наряду с другими патогенами.
Для диагностики криптоспоридиоза в настоящее время используются следующие методы: метод прямой микроскопии фекалий больных животных, окраска ооцист криптоспоридий в мазках фекалий или содержимого кишечника методом Циля – Нильсена, Романовского – Гимзы и по Граму, а также метод полимеразной цепной реакции – ПЦР. Основным методом, применяемым на практике, является паразитологический, заключающийся в обнаружении возбудителя при микроскопии материала. Как правило, криптоспоридии ищут в свежих фекалиях, из которых готовят тонкие мазки на предметных стеклах в 1–2 каплях изотонического раствора NaCl. Мазки сушат на воздухе не менее 30 мин, фиксируют смесью Никифорова 10–15 мин и снова сушат на воздухе. В дальнейшем их окрашивают различными красителями. Чаще применяют окрашивание карбол-фуксином по Цилю – Нильсену с последующим докрашиванием препаратов малахитовым зеленым. При этом ооцисты криптоспоридий приобретают ярко-красный цвет. Они имеют вид округлых образований диаметром до 5 мкм, внутри некоторых из них видны удлиненные спорозоиты. Сопутствующая микрофлора окрашивается в зеленый цвет. Капли жироподобных веществ и глыбки детрита также окрашиваются в ярко-красный цвет, но они не имеют четких контуров и какой-либо внутренней структуры.
Необходимо провести дифференциальную диагностику. Оценка делается по показателям, предложенным M. Bulgin (1983), после окраски по Граму.
- В поле зрения микроскопа почти чистая культура грамотрицательных мелких, толстых, с закругленными концами палочек, расположенных кучками. Ориентировочный диагноз – кишечная колиинфекция.
- В мазках-отпечатках преобладают грамположительные толстые, с прямоугольными концами бациллы, расположенные одиночно, парами или короткими цепочками. Ориентировочный диагноз – энтеротоксемия.
- При микроскопии мазков в поле зрения преобладают нейтрофильные клетки с микробами. Ориентировочный диагноз – сальмонеллез.
- В мазках имеются не окрашенные по Граму образования, по величине и форме напоминающие эритроциты, часть их имеет светлый ободок. Ориентировочный диагноз – криптоспоридиоз.
- В мазках-отпечатках содержится разнообразная микрофлора, среди которой трудно определить преобладающую. Такая картина характерна для инфекций, вызванных вирусами. Окончательно наличие эшерихиозных возбудителей определяется исследованиями патологического материала, предусмотренными методическими указаниями по бактериологической диагностике колибактериоза животных.
Для увеличения концентрации ооцист в исследуемом материале используют различные методы обогащения, чаще всего флотацию и седиментацию, так как нередко количество ооцист в фекалиях больных животных может быть настолько незначительным, что их выявление с помощью микроскопии окрашенных мазков представляет трудную задачу. В связи с этим используют методы обогащения, хорошо известные в гельминтологии. Флотационными жидкостями являются насыщенные растворы разных веществ. В качестве вспомогательного средства применяют флотацию без центрифугирования, флотацию с центрифугированием, методом седиментации.
В качестве флотационных жидкостей используют насыщенные растворы хлорида натрия (плотность раствора составляет 1,20 мг/см3), нитрата аммония (1,31 мг/см3), сахарозы (1,25 мг/см3), сульфата цинка (1,39 мг/см3), жидкость Дарлинга (1,20 мг/см3), среду Бреза (смесь насыщенных растворов сульфата магния, тиосульфата натрия и водопроводной воды в соотношении 3:3:1), смесь Павласека (хлорид цинка – 220 г, хлорид натрия – 210 г, водопроводная вода – 800 мл) и некоторые другие солевые растворы.
В последующем во избежание потерь собранных ооцист в процессе высушивания мазка и последующей его обработки рекомендуется предварительно нанести на покровное стекло небольшое количество плазмы или альбумина и высушить при комнатной температуре или в термостате при 37 °С.
Для длительного сохранения ооцист используют 2,5 % раствор бихромата калия. Через несколько дней вследствие исчезновения остаточного тела спорозоиты внутри ооцист видны более отчетливо. Материал можно хранить как при комнатной температуре, так и в холодильнике, но последнее предпочтительнее.
Перед заражением экспериментальных животных обязательно нужно проводить биопробу на мышах. Для постановки биопроб необходимо скормить небольшие порции фекалий новорожденным или 2–5-дневным белым мышам. При наличии в пробах ооцист криптоспоридий в фекалиях мышей через 5–8 дней будут обнаруживаться ооцисты. При вскрытии мышей в более ранний период (на 3–7-й день) в гистологических препаратах кишечника (предпочтительно использовать препараты подвздошной кишки) будут выявляться эндогенные стадии развития криптоспоридий, локализующихся в зоне щеточной каемки.
При постановке биопроб на животных можно к гомогенату фекалий добавлять антибиотики (пенициллин, стрептомицин, гентамицин), которые подавляют сопутствующую микрофлору, но не влияют на инвазивность ооцист криптоспоридий.
Количество ооцист криптоспоридий подсчитывают с помощью камеры Горяева, используемой в гематологической практике. После инкубации, стимулирующей эксцистирование ооцист, можно таким же способом подсчитывать и количество паразитов. Для количественной оценки можно также подсчитывать общее количество ооцист в окрашенном мазке, приготовленном из определенного количества фекалий (например, из 0,2 г).
Выводы
Согласно литературным данным и результатам собственных исследований, для выявления ооцист криптоспоридий наиболее приемлемым, особенно в условиях производства, является окраска мазков методом Циля – Нильсена. Для получения большой массы ооцист криптоспоридий следует использовать метод флотации с насыщенным раствором сахарозы. Культуру в последующем можно использовать при проведении экспериментальных исследований, а также для постановки биопроб на животных.
Рецензенты:
Столяров В.А., д.в.н., профессор кафедры морфологии и физиологии животных, Мордовский государственный университет им. Н.П. Огарева, г. Саранск;
1.1. Методические указания устанавливают методы приготовления модельных жидкостей, содержащих цисты лямблий и (или) ооцист криптоспоридий, и применения их для гигиенической оценки эффективности водоочистки различными технологиями.
3.1. Этапы проведения методики
3.1.1. Подготовка модельной жидкости (воды), содержащей определенное (не менее 15) число лямблий в 1 дм 3 (л).
3.1.2. Обработка не менее 50 дм 3 модельной жидкости (1 проба) на испытуемом водоочистном устройстве (фильтрация, адсорбция, разрушение и прочие способы инактивации цист) как минимум в 3-х повторностях.
3.1.3. Контроль за содержанием цист лямблий и их жизнеспособностью в конечном продукте, получаемом после обработки модельной жидкости на испытуемом устройстве.
3.1.4. Оценка эффективности барьерной функции в отношении цист лямблий и выдачи соответствующего заключения.
3.2. Подготовка модельной жидкости
Лаборатории, осуществляющие сертификационные испытания водоочистных устройств по паразитологическому показателю, должны иметь запас максимально очищенной взвеси цист лямблий ( Giardia lamblia - Lamblia intestinalis ) в объеме не менее 25 мл с содержанием цист не менее 10000 экз. в 1 мл.
При испытании водоочистных устройств, использующих химические и физические (УФ-лучи, МИО, озон и др.) факторы воздействия, используются только жизнеспособные тест-объекты. Цисты лямблий, выделенные из фекалий человека, сохраняют свою жизнеспособность в полном объеме в течение 10 суток при условии хранения их при 4 °С.
3.2.1. Материалом для получения жизнеспособных цист лямблий могут служить фекалии больных лямблиозом лиц и лиц-цистоносителей. Материал может быть получен в инфекционных больницах (особое внимание должно быть обращено на детские отделения), кишечных кабинетах поликлиник, гастроэнтерологических отделениях больниц и клиник, паразитологических лабораториях центров Госсанэпиднадзора.
Специалист, осуществляющий подготовку взвесей тест-объектов, должен руководствоваться СП 1.2.731-99 (п. 28).
Цисты лямблий выделяют из оформленных или полуоформленных фекалий инвазированных лямблиями людей. Для этого используются методы обнаружения цист лямблий, описанные в нормативно-методических документах МУК 4.2.735-99 (п.п. 2.3).
Фекалии, в которых обнаруживаются цисты лямблий более 100 экз. в одном поле зрения при 200-кратном увеличении микроскопа (окуляр ×10, объектив ×20), следует подвергать соответствующей дальнейшей обработке.
3.2.1.1. Для получения взвеси цист лямблий фекалии, их содержащие, в количестве 3 - 5 г (чайная ложка) отмывают изотоническим раствором (0,85 %) хлорида натрия (NaCl) путем повторного центрифугирования (3 мин×1500 об./мин) до образования прозрачной надосадочной жидкости, которую осторожно удаляют путем пипетирования. В оставшийся осадок фекалий добавляют флотирующий раствор объемом, в 3 - 4 раза превышающим объем фекалий (рис. 1).
3.2.1.2. В качестве флотационной жидкости используется насыщенный (30 %) раствор сахарозы (насыщение достигается при условии нерастворения кристаллов сахарозы в воде с температурой около 50 °С при перемешивании или встряхивании).
Раствор следует остудить до 18 - 20 °С. Обработка осадка фекалий флотирующим раствором должна сопровождаться интенсивным перемешиванием с помощью пипетки или стеклянной палочки.
Для ускорения перехода цист лямблий из осадка в поверхностную пленку флотанта и очищения их, пробирки центрифугируют при 1500 об./мин в течение 5 мин.
После 10 - 15-минутной экспозиции поверхностную пленку флотанта снимают металлической петлей (из медной или алюминиевой проволоки) с внутренним диаметром 5 - 6 мм и переносят в пробирку с изотоническим раствором хлорида натрия или жидкости Барбагалло (3 %-ным раствором формальдегида на физиологическом растворе). Процедуру повторяют не менее 3-х раз. Вместо петли можно использовать пипеточный дозатор 0,1 мл, которым осторожно снимают поверхностную пленку. Для получения концентрированной взвеси цист в работе должно быть задействовано 10 и более пробирок (емкостью 10 - 15 мл) с фекалиями и флотантом.
3.2.1.3. Для более высокой очистки взвеси цист от фекального загрязнения ее подвергают дополнительной обработке 8 %-ным раствором сахарозы следующим образом: взвесь цист центрифугируют 3 мин при 1500 об./мин, надосадочную жидкость удаляют, осадок осторожно переносят на поверхность 8 %-ного раствора сахарозы (6 мл и более) в центрифужной пробирке. Эту суспензию вновь центрифугируют в течение 2 мин при 2000 об./мин. Надосадочную жидкость удаляют, а взвесь, обогащенную отмытыми цистами, хранят в пробирках с резиновыми пробками при 4 °С.
Жизнеспособность отмытых цист при данном режиме консервации сохраняется в течение 10 суток. Даже если суспензия не подвергалась дополнительно очистке, ее следует освободить от остатков сахарозы путем 2 - 3-кратного промывания, что резко снизит возможность развития в суспензии плесени и бактериальной флоры.
При получении взвеси формалинизированных цист лямблий в качестве начального этапа обработки фекалий может быть использована методика формалин-эфирного осаждения (см. МУК 4.2.735-99, стр. 13, 14, 25, 26). При этом могут быть использованы и фекалии, законсервированные в фиксирующих жидкостях (Барбагалло, Турдыева и др.).
Полученный после такой процедуры осадок, содержащий цисты лямблий, подвергается затем флотации выше описанным способом. При этом в качестве флотанта можно использовать 33 %-ный водный раствор семиводного сернокислого цинка ( ZnSO 4 H 2 O ).
3.2.2. Количественное определение цист лямблий в полученной взвеси. Взвесь интенсивно встряхивают путем постукивания пальцем по пробирке или размешивания стеклянной палочкой. Пипеточным дозатором отбирают 0,1 мл и переносят на предметное стекло. Образовавшуюся на стекле каплю накрывают покровным стеклом и микроскопируют при 200-кратном увеличении микроскопа (окуляр ×10, объектив ×20). При таком увеличении микроскопа покровное стекло размером 24×24 мм накрывает площадь, соответствующую 2935 полям зрения. Просматривают не менее 20 полей зрения и подсчитывают число цист лямблий в каждом из них. Числа суммируют и делят на число просмотренных полей; получается среднее число цист в одном поле зрения. Это число умножают на 2935 и получают усредненное число цист, содержащихся в 0,1 мл взвеси. При умножении на 10 получают содержание в 1 мл взвеси с поправкой ±5 %. Это - маточная взвесь, которая должна содержать около 200000 цист лямблий в 1 мл.
3.2.2.2. Взвесь тест-объектов (цисты лямблий) вносят в воду объемом не менее 50 л (дм 3 ), предназначенную для приготовления модельной жидкости с таким расчетом, чтобы содержание их в 1 л (дм 3 ) модельной жидкости составляло, как минимум, 15 ± 2 единицы. Оптимальный вариант 20 ± 2 единицы. Это достигается внесением 0,01 мл рабочей взвеси на каждый литр модельной жидкости или 0,5 мл на 50 л. Таким образом, общее число цист в пробе модельной жидкости должно находиться в пределах 750 - 1000 единиц. Модельную жидкость затем тщательно (1 - 1,5 мин) размешивают.
3.3. Проведение обработки модельной жидкости на испытуемом устройстве
Обработка модельной жидкости на водоочистном устройстве проводится в соответствии с инструкцией по эксплуатации данного устройства. Обрабатывается не менее 3-х проб (по 50 л) модельной жидкости.
3.4. Контроль за содержанием цист лямблий и их жизнеспособностью в конечном продукте после технологической обработки
Модельная жидкость после обработки на водоочистном устройстве исследуется на наличие цист лямблий в соответствии с действующими нормативными документами и оценочными показателями паразитарной безопасности (п. 2.4).
3.5. Оценка эффективности барьерной функции водоочистного устройства
При отсутствии цист лямблий в 3-х пробах конечного продукта эффективность противопаразитарной барьерной функции испытуемого водоочистного устройства фильтрационного или абсорбционного действия оценивается как 100 %-ная.
При обнаружении в конечном продукте одной цисты эффективность устройства оценивается в 99,96 %.
При обнаружении большего числа цист лямблий в 3-х пробах конечного продукта эффективность барьерной функции водоочистного устройства рассчитывается по формуле:
А - эффективность барьерной функции, %;
в - число цист лямблий, внесенное в 3 пробы модельной жидкости (в среднем около 3000 единиц);
с - число цист лямблий, обнаруженное в 3-х пробах конечного продукта.
При оценке барьерной функции водоочистного устройства реагентного действия формула расчета эффективности выглядит так:
А - эффективность барьерной функции устройства, %;
Д - число жизнеспособных цист, внесенное в модельную жидкость (в 3 пробы);
д - число жизнеспособных цист, обнаруженное в конечном продукте.
3.6. Оборудование и материалы
3.6.1. Оборудование, перечень материалов (реактивов) - см. МУК 4.2.964-00, стр. 6 - 8; дополнение: акридиновый оранжевый ЧДА.
3.6.2. Приготовление рабочих растворов. 33 %-ный водный раствор семиводного сульфата цинка: 331 г семиводного сульфата цинка растворяют в 1 л кипящей дистиллированной воды; 30 %-ный водный раствор сахарозы: 300 г сахарозы чда растворяют в 1 л горячей (70 - 80 °С) дистиллированной воды. После приготовления флотанта и снижения его температуры до 18 °С контролируют его удельную плотность ареометром. Она должна составлять 1,2.
Приготовление рабочего раствора акридинового оранжевого - 0,2 г красителя растворяют в 100 мл дистиллированной воды.
Этапы методики те же, что и для цист лямблий (см. п. 3.1).
Материалом для получения ооцист криптоспоридий могут быть фекалии молодняка домашних животных (телят, поросят и др.). Материал может быть получен на животноводческих комплексах и фермах.
4.1.1. Получение очищенной взвеси ооцист криптоспоридий. Фекалии, их содержащие, в количестве 3 - 5 г (чайная ложка) помещают в центрифужные пробирки емкостью 30 - 50 мл и отмывают изотоническим раствором хлорида натрия (0,85 %) путем повторного центрифугирования (3 мин при 1500 об./мин) до образования прозрачной надосадочной жидкости, которую осторожно удаляют путем пипетирования (прилож. 2, рис. 1 и 2).
4.1.2. Осадок заливают 30 %-ным раствором сахарозы при t = 30 - 35 °С в количестве, равном трем объемам осадка, и маркером отмечают верхний уровень жидкости.
4.1.3. Проводят тщательное размешивание стеклянной палочкой или пипеткой и центрифугируют в режиме 2000 об./мин в течение 5 мин. После центрифугирования смеси дают отстояться 15 мин. Затем на поверхность флотанта осторожно наслаивают 10 - 15 мл дистиллированной воды и очень осторожно с помощью стеклянной палочки эту воду над раствором сахарозы (граница между сахарозой и водой отмечена маркером) слегка помешивают, чтобы ооцисты, находящиеся в верхнем слое флотанта, переместились из верхнего слоя сахарозы в находящуюся над ней воду. Эту воду затем с помощью пипеточного дозатора отсасывают до отмеченного маркером уровня и переносят в чистую пробирку емкостью 50 мл, размешивают и центрифугируют в прежнем режиме до образования прозрачной жидкости. Промывку ооцист с помощью центрифугирования повторяют не менее 4 раз.
4.1.4. После последнего промывания и осторожного удаления надосадочной жидкости (пипетированием) оставшийся осадок переносят в центрифужные пробирки емкостью 10 мл и центрифугируют при 3000 об./мин в течение 5 мин. Надосадочную жидкость удаляют путем пипетирования, а образовавшуюся после всех манипуляций взвесь ооцист используют в дальнейшей работе.
4.1.5. Количественное определение содержания ооцист в полученной взвеси проводят аналогичным для цист лямблий путем либо подсчетом в камере Горяева. Ооцисты подсчитывают в 20 прямоугольниках (полученное число соответствует их содержанию в 2 мм 3 ), сумму умножают на 50000 и получают содержание ооцист в 1 мл взвеси.
Дальнейшую работу проводят в соответствии с пунктами 3.2.2.1 - 3.3.
4.2. Контроль за содержанием ооцист криптоспоридий в конечном продукте после технологической обработки
После этого мазки быстро проводят над пламенем горелки и окрашивают карболовым фуксином (см. раздел 4.3) в течение не менее 20 мин. Мазки промывают дистиллированной водой, обесцвечивают (дифференцируют) 5 - 10 %-ной серной кислотой в течение 10 - 20 с и снова промывают. Затем дополнительно окрашивают 0,2 %-ным водным раствором метиленового синего или 5 % малахитовой зелени в 10 %-ном этиловом спирте в течение 3 - 5 мин. Промывают дистиллированной водой, тщательно высушивают на воздухе и исследуют с масляной иммерсионной системой микроскопа с увеличением не менее 1000×.
Ооцисты криптоспоридий окрашиваются в разные оттенки ярко красного (малинового, вишневого) цвета и имеют вид округлых образований диаметром 5 - 6 микрон с отчетливо видимой оболочкой и структурированным содержимым (можно наблюдать наличие 4-х веретенообразных темноокрашенных спорозоитов) на синем или зеленом основном фоне.
4.3. Оценка эффективности барьерной функции водоочистного устройства
Оценку эффективности проводят так же, как и в отноше нии цист лямблий (см. 3.5).
4.4. Оборудование и материалы
Оборудование и материалы аналогичны тем, которые применяются для анализа цист лямблий (см. раздел 3.6).
4.4.1. Камера Горяева.
4.4.2. Дополнение 1: фуксин основной чда, фенол чда, малахитовая зелень чда, мет иленовый синий чда, серная кислота (10 %), масло иммерсионное пихтовое.
4.4.3. Дополнение 2: приготовление карболового фуксина (по Цилю-Н ильсену): 2,0 основного фуксина разводят в 12 мл 96°-ного этилового спирта, а 5,0 мл фенола разводят в 100 мл дистиллированной воды при 30 - 35 °С, затем оба этих раствора соединяют вместе. Срок хранения смеси - 2 месяца.
Приготовление раствора малахитовой зелени: 5,0 малахитовой зелени растворяют в 100 мл 10 %-ного этилового спирта. Срок хранения - 2 месяца.
1. Бейер Т.В. и соавт. Лабораторная диагностика криптоспоридиоза у детей. Л., 1987. 21 с.
2. Бейер Т.В. и соавт. Диагностика, клиника, лечение и профилактика криптоспоридиоза: Методические рекомендации. Л., 1987. 22 с.
5. Шарапов М.Д. Совершенствование и применение метода культивирования лямблий для изучения некоторых вопросов эпидемиологии лямблиоза // Дисс. канд. мед. наук. М., 1977.
6. Ford Т . Е . Microbiology Safety of drinking water: United States and Global Perspectives // Environm. Health Perspectives. 1999. V.107, S.I.
7. Pavlasek I. Kryptosporidie: biologie, diagnostica, hostitelske spektrum, specifita a vztah k zivotinu prostredi. Remedia - Klinicka mikrobiologie 1999: 3 (9) S. 290 - 300.
1. Лямблии ( Lamblia intestinalis , синоним Giardia lamblia ). Одноклеточные паразитические животные организмы из класса жгутиконосцев (Flagellata). Возбудители лямблиоза (жиардиазиса) - заболевания, могущего проявиться в различных формах. Кишечная форма характеризуется диарейн ым синдромом, может симулировать аппендицит или язвенную болезнь желудка и 12-перстной кишки. Почечная форма дает картину холецистита, желчнокаменной болезни. Нервная форма проявляется в виде головных болей, раздражительности, слабости, крапивницы.
Лямблии могут существовать в двух формах: 1 - трофозоита (вегетативной, активной формы в организме хозяина, размер 8 - 10×14 - 16 микрон) и 2 - цистной - во внешней, в т.ч. и водной среде.
Удельный вес цист - 1,06 - 1,09. Цисты устойчивы к воздействию многих дезинфектантов (свободного хлора, диоксина хлора, озона и др.). Кипячение воды убивает цисты в течение 5 мин. Заражающая (инвазионная) доза = 10 цистам лямблий.
3. Криптоспоридии ( Cryptosporidium parvurn ). Одноклеточные паразитические животные организмы из класса споровиков (Sporozoa ) со сложным жизненным циклом, протекающим в организме одного хозяина и включающим в себя мерогонию и споруляцию. Они являются возбудителями криптоспоридиоза человека и животных, заболевания, характеризующегося очень частой (до 20 раз в сутки) водянистой диареей, рвотой, лихорадкой, головной болью, спастическими болями в животе, миалгией.
В водную среду криптоспоридии попадают с фекалиями зараженного хозяина и представлены спорулированными ооцистами.
5. Водоочистное устройство. Техническое приспособление или сооружение с полной заводской готовностью, предназначенное для освобождения (задержания или инактивации) от жизнеспособных возбудителей кишечных паразитарных заболеваний (цист и ооцист патогенных кишечных простейших, яиц и личинок гельминтов) воды, обрабатываемой на данном техническом устройстве и предназначенной в дальнейшем для хозяйственного и питьевого использования.
Целью обработки исходной воды на водоочистном устройстве является ее полное или на 99,99 % освобождение от жизнеспособных и инвазионных возбудителей кишечных паразитозов при сохранении всех необходимых ингредиентов, обеспечивающих полную физиологическую ценность воды.
6. Конечный продукт. Вода, получаемая на выходе после обработки на водоочистном устройстве природной воды или из систем централизованного и децентрализованного питьевого водоснабжения, прошедшая неудовлетворительную подготовку и предназначенная для питьевого и хозяйственно-бытового использования.
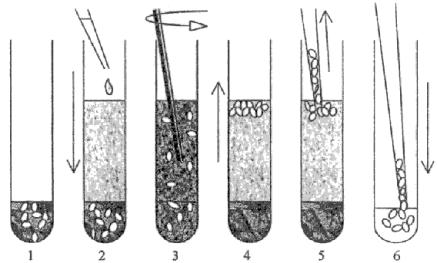
Рис. 1. Схема получения очищенной взвеси цист лямбий.
1 - предварительно отмытые фекалии, 2 - внесение флотанта, 3 - интенсивное размешивание, 4 - центрифугирование и отстаивание, 5 - снятие цист лямблий с поверхностной пленки флотанта (пипеточным дозатором или металлической петлей), 6 - перенесение цист лямблий в физиологический раствор или 3 %-ный р-р формалина на физрастворе.

Рис. 2. Схема получения очищенной взвеси ооцист криптоспоридий.
1 - флотация, 2 - наслаивание дистиллированной воды, 3 - размешивание, 4 - отсасывание ооцист.

Рис. 3. Lamblia intestinalis
1 - наружная оболочка, 2 - ядра, 3 - аксостиль, 4 - цитоплазма, 5 - жгутиковый аппарат, 6 - медиальные тела.

Рис. 4. Ооциста Cryptosporidium parvum
Читайте также:


