Гост на стафилококковый энтеротоксин
федеральная служба по ветеринарному и фитосанитарному надзору
Стафилококк в йогурте
5 июня 2014 г. — ФГБУ Ставропольская МВЛ|
Staphylococcus aureus (золотистый стафилококк) - это весьма распространенный микроорганизм имеющий несколько видов, большинство из которых образует золотистый пигмент. Некоторые виды золотистого стафилококка могут служить причиной тяжелых пищевых отравлений, так как продуцируют опасное токсическое вещество – энтеротоксин, являющийся непосредственной причиной интоксикации. В настоящее время установлено шесть серологических типов стафилококковых энтеротоксинов: А, В, С, D, Е, F. Staphylococcus aureus – очень распространен, и его можно найти повсюду. Особенно благоприятны в качестве условий для его размножения пищевые продукты – молоко, мясо. Очень устойчив к любым условиям и способен выживать в замороженных продуктах в течение полугода. Стафилококк не боится кислой среды, высокой температуры, щелочей. Для того чтобы нейтрализовать заражение, нужен долгий процесс кипячения или прожаривания при температуре не ниже 75-80 градусов. Излюбленной средой для размножения Staphylococcus aureus является молоко и все молочные продукты, именно молоко чаще всего становится источником токсикоинфекции. Микроорганизмы могут размножиться при температуре от 16-18 до 37-40 градусов, для осеменения молочного продукта порой достаточно 4-5 часов. Энтеротоксин вырабатывается, как правило, в продуктах, изготовленных из некипяченого или непастеризованного молока. Источником заражения является свежая брынза, сырковая масса, сметана, сыры, изготовленные с помощью сычужного фермента. Также опасны все сладкие кондитерские изделия с кремовой прослойкой, особенно с заварным кремом на молоке. Сахар, влажная молочная среда, крахмал – это благоприятные условия для жизнедеятельности стафилококка. Образование энтеротоксина возможно также в кипяченом и пастеризованном молоке. Известны случаи отравлений мороженым, изготовленным из молока, содержащего энтеротоксин. Реже стафилококк осеменяет мясо и мясные продукты. Он поражает больных животных с ослабленной иммунной системой или размножается на мясной пище, хранящейся в ненадлежащих условиях. Органолептические свойства молочных, мясных или овощных блюд, осемененных стафилококком, не меняются, поэтому на вкус и запах пища абсолютно не отличается от здоровой, незараженной. Источником заражения пищевых продуктов патогенными стафилококками является человек. Наиболее частый путь заражения продуктов - воздушно-капельный, поскольку больные стафилококковыми заболеваниями верхних дыхательных путей активно выделяют их в окружающую среду при дыхании, кашле, чиханье. Опасным источником обсеменения продуктов являются работники со стафилококковыми поражениями кожи которые контактным путем загрязняют стафилококками оборудование, инвентарь, посуду. Источником стафилококковой инфекции являются также животные, больные маститом и другими воспалительными заболеваниями. Продукты животного происхождения могут заражаться стафилококками при жизни животных (молоко при мастите вымени) или при разделке туши. К профилактическим мероприятиям, предупреждающим обсеменение патогенными стафилококками пищевых продуктов, относятся своевременное выявление лиц с гнойными воспалительными процессами кожи, верхних дыхательных путей и отстранение их от контакта с пищевыми продуктами. Особое место принадлежит соблюдению правил личной гигиены работниками, занятыми изготовлением готовых кулинарных и кремовых изделий. Чрезвычайно важным является создание условий, препятствующих образованию энтеротоксина в пищевых продуктах. Для хранения оптимальной является температура 2-4 °С, при которой не происходят размножение и накопление энтеротоксина. Большое значение имеет также соблюдение установленных сроков реализации скоропортящихся продуктов. Не менее важно в профилактике стафилококковых токсикозов обеспечение высокого санитарного уровня, благоустройства и механизации производственных процессов, а также систематическое повышение гигиенических знаний по вопросам профилактики пищевых отравлений.
Основными источниками обсеменения стафилококками пищевых продуктов являются люди и животные с гнойно-воспалительными процессами (абсцессы, фурункулы, гнойные раны и др.), а также носители этих микроорганизмов. Перенос стафилококков от людей на пищевые продукты может происходить воздушно-капельным путем, при непосредственном контакте людей с продуктами, оборудованием, в процессе убоя скота и разделки туш. Чаще всего причиной стафилококковых токсикозов является употребление молока, мяса и мясных изделий, кондитерских изделий с заварным кремом и др., контаминированных патогенными стафилококками. Органолептические свойства продуктов, в которых размножаются стафилококки и накапливаются энтеротоксины, не изменяются [2]. Энтеротоксигенные стафилококки размножаются в пищевых продуктах даже при содержании в них около 40% влаги. Они могут развиваться в продуктах, содержащих от 7% до 12% хлорида натрия. Сахар угнетает развитие стафилококков при концентрациях 30–40%. Некоторые микроорганизмы (В. сеreus, дрожжи из рода Саndidа и др.) оказывают на стафилококки стимулирующий эффект (они усиливают образование энтеротоксина). Энтеротоксин стафилококков обладает высокой термоустойчивостью. Инактивирование (разрушение) токсина происходит только через 2,5–3 часа кипячения. При автоклавировании (120°С) токсин разрушается через 20 мин. При благоприятных температурных условиях энтеропатогенные стафилококки быстро размножаются в продуктах и продуцируют токсин. Пищевые токсикозы, вызванные энтеропатогенными стафилококками, протекают в форме острого гастроэнтерита, сопровождающегося рвотой, реже диареей, головной болью. Инкубационный период очень короткий – от 30 мин до 6 ч. Длится заболевание один, реже – два, три дня [1]. Выявление и определение количества этих микроорганизмов в пищевых продуктах проводят в соответствии с ГОСТ 31746-2012. Продукты пищевые. Методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus. Настоящий стандарт распространяется на пищевые продукты, кроме молока и молочных продуктов, и устанавливает методы выявления и определения количества коагулазоположительных стафилококков и Staphylococcus aureus посевом: в жидкую селективную среду (с предварительным обогащением) и на (в) агаризованные селективно-диагностические среды [4]. Метод определения наиболее вероятного числа (НВЧ) коагулазоположительных стафилококков и S. aureus посевом в жидкую селективную среду предназначен для пищевых продуктов, содержащих в 1 г твердого продукта менее 150 или в 1 см Метод определения количества коагулазоположительных стафилококков и S. aureus посевом на агаризованные селективно-диагностические среды предназначен для пищевых продуктов, содержащих в 1 г твердого продукта более 1500 или в 1 см Метод выявления и метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus посевом с предварительным обогащением основаны на высеве навески продукта и (или) разведений навески продукта в жидкую селективную среду, инкубировании посевов, пересеве культуральной жидкости на поверхность агаризованной селективно-диагностической среды, подтверждении по биохимическим признакам принадлежности выделенных типичных и (или) атипичных колоний к коагулазоположительным стафилококкам и S. aureus. При пересеве на агаризованную среду с кроличьей плазмой и бычьим фибриногеном выросшие типичные колонии без подтверждения по биохимическим признакам относят к коагулазоположительным стафилококкам. Определенное количество жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции вносят в жидкую селективную питательную среду [6]. Перед посевом анаэробные условия в среде создают кипячением при (100±1) °С в течение 15 мин, наслоением агара или парафина в каждую пробирку после посева, а также с помощью альтернативной процедуры - инкубирования пробирок в емкости или инкубаторе в анаэробных условиях. Пробирки с посевами инкубируют при температуре 37 °С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков на Жиолитти-Кантони бульоне определяется по редукции теллурита калия, а на глюкозном или солевом бульоне - по помутнению среды [3]. Поверхность одной из агаризованных селективно-диагностических сред (Байрд-Паркер агара, молочно-солевого, яично-желточно-азидного, яично-желточно-солевого агара, агара с кроличьей плазмой и бычьим фибриногеном), инокулируют из предположительно положительных пробирок после 24 ч и все оставшееся пробирки после 48 ч. Чашки Петри с посевами инкубируют при температуре 37°С в течение 24-48 ч. Предположительное присутствие коагулазоположительных стафилококков определяется по редукции теллурита калия и яично-желточной реакции (лецитиназной активности) [7]. На агаре с кроличьей плазмой и бычьим фибриногеном после инкубирования присутствие коагулазоположительных стафилококков определяется по типичным колониям, показавшим специфичную реакцию (бычий фибриноген/кроличья плазма). Подтверждение принадлежности типичных и (или) атипичных колоний к коагулазоположительным стафилококкам проводят по изучению отношения выявленных микроорганизмов к окраске по Граму, определению присутствия у них каталазы и коагулазы. Подтверждение принадлежности коагулазоположительных стафилококков к S. aureus проводят по определению образования ацетоина, определению ферментации в аэробных условиях мальтозы и, при необходимости, определению термостабильной нуклеазы и гемолитической активности. Результаты выявления коагулазоположительных стафилококков и S. aureus выражают: "обнаружены" или "не обнаружены"[5]. Метод НВЧ - определение количества коагулазоположительных стафилококков и S. aureus. Навески продукта и (или) серию разведений навески продукта вносят в жидкую селективную питательную среду. Наиболее вероятное число коагулазоположительных стафилококков и S. aureus в 1 см или в 1 г продукта определяют для подтвержденных посевов, пользуясь НВЧ-таблицей по ГОСТ 26670. Методы определения количества коагулазоположительных стафилококков и S. aureus посевом на (в) агаризованные селективно-диагностические среды основаны на высеве навески продукта и/или разведения навески продукта на (в) агаризованную селективно-диагностическую среду, инкубировании посевов, подсчете типичных и (или) атипичных колоний, подтверждении по биохимическим признакам принадлежности выделенных колоний к коагулазоположительным стафилококкам и S. aureus [4]. Проводят посев определенного количества жидкого продукта или определенное количество исходной суспензии при использовании продукта другой консистенции на (в) агаризованную селективно-диагностическую питательную среду на две параллельные чашки Петри. Аналогично проводят посев десятикратных разведений испытуемого продукта. Посевы в чашках Петри инкубируют при температуре 37 °С в течение 24-48 ч. Количество коагулазоположительных стафилококков в 1 см При посеве в (на) агаризованную среду с кроличьей плазмой и бычьим фибриногеном определяют только типичные колонии и без подтверждения по биохимическим признакам их относят к коагулазоположительным стафилококкам. Количество S. aureus в 1 см При выявлении коагулазоположительных стафилококков в определенной навеске исследуемого продукта или его эквивалентном разведении с предварительным обогащением эту навеску или разведение вносят в одну из питательных сред [6,7]. Перед использованием Жиолитти-Кантони бульон прогревают кипячением при (100±1) °С в течение 15 мин для удаления воздуха. Охлаждают до 44 °С - 47 °С и с соблюдением правил асептики прибавляют раствор теллурита калия. В 10 см модифицированного Жиолитти-Кантони бульона нормальной концентрации или сред вносят 1 см Соотношение между количеством высеваемого продукта или его разведением и питательной средой нормальной концентрации 1:10. При использовании среды двойной концентрации соотношение между количеством высеваемого продукта или его разведением и питательной средой 1:1 [3]. Если при последующем подтверждении принадлежности коагулазоположительных стафилококков к S. aureus не определяют наличие термостабильной нуклеазы и гемолитической активности, то допускается проводить посев в Жиолитти-Кантони бульон без прогрева перед посевом и без наслаивания голодного агара или парафина после посева. Посевы инкубируют при температуре (37±1) °С в течение (24±2) ч. Если появилось почернение или черный осадок в Жиолитти-Кантони бульоне или помутнение в солевом или сахарном бульоне, то проводят подтверждение принадлежности выросших микроорганизмов к коагулазоположительным стафилококкам. Если почернения, черного осадка или помутнения нет, то посевы инкубируют еще (24±2) ч [2]. Для получения изолированных колоний стерильной петлей делают пересевы культур из каждого посева на поверхность чашки Петри с одной из агаризованных селективно-диагностических сред: Байрд-Паркер агара, Байрд-Паркер агара с кроличьей плазмой и бычьим фибриногеном, молочно-солевого агара, яично-желточно-азидного агара или яично-желточно-солевого агара. Пересевы проводят также из пробирок, в которых нет видимых признаков роста. Чашки Петри с пересевами инкубируют в термостате при температуре (37±1) °С в течение (24±2) ч или (48±2) ч. После 24 ч инкубирования чашек Петри по отмечают на дне чашек присутствие типичных и атипичных для коагулазоположительных стафилококков колоний [1]. На Байрд-Паркер агаре после инкубирования в течение 24 ч коагулазоположительные стафилококки образуют типичные колонии черного или серого цвета, блестящие и выпуклые, окруженные прозрачной зоной, диаметр колоний около 1,0-1,5 мм и до 1,5-2,5 мм после инкубирования в течение 48 ч. После инкубирования в течение 24 ч непосредственно около колонии в прозрачной зоне может появиться опалесцирующее кольцо, окружающее колонию. Принадлежность выявленных коагулазоположительных стафилококков к S. aureus проводят по определению их способности образовывать ацетоин и ферментировать мальтозу в аэробных условиях [5]. Определение образования ацетоина (реакция Фогес-Проскауера). Культуру высевают в пробирки со средой Кларка. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. После инкубирования посевов к 1 см Определение ферментации мальтозы в аэробных условиях. Способность ферментации мальтозы в аэробных условиях определяют с целью дифференциации S. aureus от других коагулазоположительных видов S. intermedius и S. hyicus. Для определения ферментации мальтозы в аэробных условиях культуры, подлежащие исследованию, высевают уколом петлей в среду Гисса с мальтозой. Посевы инкубируют при температуре (37±1) °С в течение 48 ч. При ферментации мальтозы в аэробных условиях с образованием кислоты цвет среды Гисса изменяется. S. aureus ферментирует мальтозу в аэробных условиях [4]. Оценка результатов подтверждения принадлежности коагулазоположительных стафилококков к S. aureus. Если коагулазоположительные стафилококки образуют ацетоин и сбраживают мальтозу в аэробных условиях, то считают, что выявленные коагулазоположительные стафилококки относятся к S. aureus. Для биохимической идентификации допускается использование тест-систем промышленного производства, зарегистрированных на территории государства, принявшего стандарт. Оценка результатов посевов в жидкие среды. При определении НВЧ коагулазоположительных стафилококков или S. aureus или при их выявлении в определенной навеске продукта посевы считают положительными (то есть коагулазоположительные стафилококки или S. aureus выявлены в испытуемой навеске продукта), если при последующем пересеве на агаризованные селективно-диагностические среды и подтверждении типичных и (или) атипичных колоний, выросших на этих средах, хотя бы в одной колонии будут обнаружены коагулазоположительные стафилококки или S. aureus [6]. Результаты выявления коагулазоположительных стафилококков или S. aureus записывают: обнаружены (не обнаружены) в 1 г (см3) продукта; масса или объем продукта, в котором выявляли коагулазоположительные стафилококки или S. aureus. Стафилококковые энтеротоксинСтафилококковые энтеротоксины представляют собой простые токсины, молекула которых состоит из одной полипептидной цепи. Известно несколько серологически различных типов стафилококковых энтеротоксинов, обозначенных соответственно буквами латинского алфавита от А до F. Все стафилококковые энтеротоксины независимо от типа, обладают сходным биологическим действием, что свидетельствует об общности отдельных участков их структуры, хотя полная идентичность их молекулярного строения отсутствует. Молекулярная масса стафилококковых энтеротоксинов в пределах 30000 дальтон и зависит от метода выделения и очистки, а также способов определения молекулярной массы. [1] Для биологической активности стафилококковых энтеротоксинов характерен энтеротоксический эффект. [2] Наибольшее внимание зарубежных военных спецна-листов привлекают стафилококковые энтеротоксины , продуцируемые золотистыми стафилококками ( Staphylo - coccus aureus) различных штаммов. Эти бактерии ши роко распространены в природе. В виде шаров диамет ром 0 8 - 1 1 мкм, скомпонованных в виноградные гроздья, они способны депонироваться в тканях всех растений и животных, насыщенных липидными и углеводными компонентами, в том числе в подкожных тка нях челозека и животных. Они склонны к размножению с выделением экзотоксинов в кислородсодержащей среде, когда подавлены другие виды микроорганизмов, особенно продуцирующих протеолитические ферменты. [3] Наибольшее внимание зарубежных военных специалистов привлекают стафилококковые энтеротоксины , продуцируемые золотистыми стафилококками ( Staphylo-coccus aureus) различных штаммов. Эти бактерии широко распространены в природе. В виде шаров диаметром 0 8 - 1 1 мкм, скомпонованных в виноградные гроздья, они способны депонироваться в тканях всех растений и животных, насыщенных липидными и углеводными компонентами, в том числе в подкожных тка нях человека и животных. Они склонны к размножению с выделением экзотоксинов в кислородсодержащей сред, когда подавлены другие виды микроорганизмов, особенно продуцирующих протеолитические ферменты. Наиболее типично заражение теми или иными штаммами золотистых стафилококков молока, сладких творожных масс, кондитерских кремов и других подобных продуктов питания, что и создает опасность пищевых интоксикаций. [4] Наличие двух полуцистиновых остатков в молекуле других типов стафилококковых энтеротоксинов свидетельствует о существовании у них одной дисульфиднои связи, сходства в строении. Наличие ци-стиновой петли является характерной особенностью для всех типов стафилококковых энтеротоксинов. В поддержании устойчивой структуры молекулы токсина играют остатки тирозина, которые формируют по-видимому внутреннее ядро структуры. Блокирование всех остатков тирозина гуанидинхлоридом приводит к полной инактивации токсина. [5] В рамках работы комитета проведена экспертиза ряда проектов ГОСТ Р, посвященных, в частности, анализу стафилококковых энтеротоксинов , обнаружению фальсификатов спиртных напитков, определению массовой концентрации витамина С, идентификации водок и водок особых, определению подлинности спирта этилового, измерению массовой концентрации йода, идентификации генетически модифицированных источников питания, выявлению радиационно-обрабо-танных продуктов. [6] Неизвестно о существовании неактивных предшественников токсинов. Все стафилококковые энтеротоксины в нативном состоянии устойчивы к действию протеолитических ферментов, таких, как трипсин, папаин, хемотрипсин и ренин. Они термоустойчивы, но антигенные и токсические сайты по-разному реагируют на высокие температуры, а это подтверждает их различную локализацию в белковой части молекулы токсина. [7] Стафилококковые энтеротоксины представляют собой простые токсины, молекула которых состоит из одной полипептидной цепи. Известно несколько серологически различных типов стафилококковых энтеротоксинов , обозначенных соответственно буквами латинского алфавита от А до F. Все стафилококковые энтеротоксины независимо от типа, обладают сходным биологическим действием, что свидетельствует об общности отдельных участков их структуры, хотя полная идентичность их молекулярного строения отсутствует. Молекулярная масса стафилококковых энтеротоксинов в пределах 30000 дальтон и зависит от метода выделения и очистки, а также способов определения молекулярной массы. [8] По антигенной специфичности токсины делятся на ряд типов, к каждому можно получить гомологические антитела, однако в сыворотке можно обнаружить и гетерологичные антитела, которые свидетельствуют об общности некоторых антигенных детерминант у энтеротоксинов различных серотипов. По сравнению с другими белковыми токсинами стафилококковые энтеротоксины являются слабыми антигенами. [9] Наличие двух полуцистиновых остатков в молекуле других типов стафилококковых энтеротоксинов свидетельствует о существовании у них одной дисульфиднои связи, сходства в строении. Наличие ци-стиновой петли является характерной особенностью для всех типов стафилококковых энтеротоксинов . В поддержании устойчивой структуры молекулы токсина играют остатки тирозина, которые формируют по-видимому внутреннее ядро структуры. Блокирование всех остатков тирозина гуанидинхлоридом приводит к полной инактивации токсина. [10] Стафилококковые энтеротоксины представляют собой простые токсины, молекула которых состоит из одной полипептидной цепи. Известно несколько серологически различных типов стафилококковых энтеротоксинов, обозначенных соответственно буквами латинского алфавита от А до F. Все стафилококковые энтеротоксины независимо от типа, обладают сходным биологическим действием, что свидетельствует об общности отдельных участков их структуры, хотя полная идентичность их молекулярного строения отсутствует. Молекулярная масса стафилококковых энтеротоксинов в пределах 30000 дальтон и зависит от метода выделения и очистки, а также способов определения молекулярной массы. [11] Стафилококковые энтеротоксины представляют собой простые токсины, молекула которых состоит из одной полипептидной цепи. Известно несколько серологически различных типов стафилококковых энтеротоксинов, обозначенных соответственно буквами латинского алфавита от А до F. Все стафилококковые энтеротоксины независимо от типа, обладают сходным биологическим действием, что свидетельствует об общности отдельных участков их структуры, хотя полная идентичность их молекулярного строения отсутствует. Молекулярная масса стафилококковых энтеротоксинов в пределах 30000 дальтон и зависит от метода выделения и очистки, а также способов определения молекулярной массы. [12] Показано, что действие стафилококкового энтеротоксина типа В приводит у кроликов к нарушению обмена аденозинтрифосфата и ионов Mg2, поражаются функции митохондрий отдельных чувствительных тканей. При введении токсина в кровяное русло до 15 - 20 %, его обнаруживают в лейкоцитах, а остальная часть содержится в альбуминовой фракции сыворотки. Лейкоциты, содержащие энтеротоксин, в основном, локализуются в легочной ткани. Что касается желудочно-кишечного тракта, то токсин вызывает поражение слизистой, а, именно, эрозию, разрушение ворсинок, расширение лимфатических сосудов. Было установлено действие энтеротоксина на рвотный центр, находящийся в желудочке продолговатого мозга через парасимпатическую нервную систему, а при внутривенном введении он действует на рвотный центр через симпатическую нервную систему. Для защиты от биологического действия токсина необходимо блокировать оба звена. Механизм биологического действия стафилококковых энтеротоксинов тем не менее остается неизвестным, так как еще до конца не ясна его структура. [13]
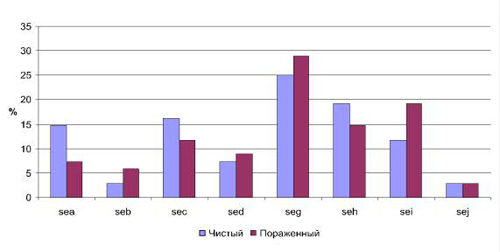
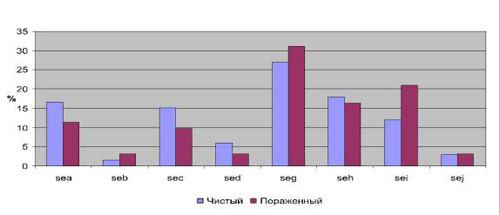
В последние годы не угасает интерес к эпидемиологии стафилококков как этиологических агентов многих инфекционных заболеваний, поcкольку стафилококковое бактерионосительство служит причиной формирования серьезных осложнений в условиях госпитализации. Особую актуальность этот вопрос приобретает в связи с широким распространением и циркуляцией как в природной популяции, так и госпитальной среде метициллинрезистентных штаммов золотистого стафилококка (MRSA). Принципиально важным для дифференциации таких штаммов является исследование генных комплексов, входящих в состав стафилококковых хромосомных кассет mec (staphylococcal chromosome cassette mec, SCCmec), а также определение генов, детерминирующих синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока (TSST). Для большинства стафилококков естественной средой обитания является поверхность кожи человека, слизистые, где они персистируют, не причиняя вред организму хозяина. Однако, как показывают работы последних лет [1, 3], при хронических дерматозах происходят изменения микробиоценозов кожи, в частности, возрастает степень обсемененности кожи представителями рода Staphylococcus, особенно S.aureus. В этой связи встает вопрос об этиопатогенетической роли этих бактерий в развитии кожных патологий. Поскольку основными поражающими факторами воздействия стафилококков на эукариотические клетки и ткани являются секретируемые факторы вирулентности и патогенности (токсины), целью настоящей работы явилось исследование вариабельности геномных комплексов стафилококков, выделенных с кожи людей при хронических дерматозах. Материал и методы исследования Бактериальные штаммы. В работе были использованы 185 штаммов стафилококков, из них – 91 штамм S. aureus (49,1 %), полученные от лиц в возрасте от 18 до 80 лет, находящихся в стационаре областного кожно-венерологического диспансера г. Ульяновска с хроническими дерматозами: псориаз (57/144, 39,6 %), экзема (68/144, 47,2 %), атопический дерматит (19/144, 13,2 %). Забор материала осуществляли с пораженных и интактных участков кожи ватным тампоном, смоченным 0,85 % раствором хлористого натрия. Смывы в количестве 0,1 мл засевали на селективные питательные среды, через 48 часов подсчитывали количество выросших колоний и пересчитывали на 1 см 2 кожи (Иванов, 1984). Результаты пересчитывали на КОЕ/см 2 . Первичную родовую и видовую идентификацию стафилококков осуществляли на основании морфологии колоний, окраски по Граму, данных каталазного и коагулазного тестов. Качественное и количественное исследование микробиоценозов кожи осуществляли на базе бактериологической лаборатории городской клинической больницы № 1 г. Ульяновска (зав. лабораторией – Волгина Т.И.). Полученные данные подвергали статистической обработке с использованием пакета прикладных программ Microsoft Еxcel 2003. Видовая идентификация стафилококков прямым масс-спектрометрическим профилированием. Свежие бактериальные клетки (1–2 колонии) переносили в 300 мкл деионизированной воды, перемешивали и добавляли 900 мкл этанола. Осадок после центрифугирования (15 мин×14000 об/мин) растворяли в 20 мкл смеси 50 % ацетонитрила (АЦН), 35 % муравьиной кислоты. Полученный в результате последующего центрифугирования супернатант анализировали времяпролетной МАЛДИ масс-спектрометрией. Все использованные реактивы, включая воду, были аналитической чистоты или специальные для масс-спектрометрии. В качестве матрицы применяли a-циано-4-гидроксикоричную кислоту ( a -cyano-4-hydroxycinnamic acid, a-CHCA, BrukerDaltonics, Германия) в виде насыщенного раствора в смеси 50 % АЦН, 2,5 % трифторуксусной кислоты (ТФУ). Для сокристаллизации матрицы и образца 1 мкл аналита наносили на ячейки стальной мишени для масс-спектрометрии (MSP 96 target ground steel, BrukerDaltonics, Германия), давали подсохнуть 1–2 минуты и сверху наслаивали 2 мкл насыщенного раствора матрицы. Кристаллы оставляли на воздухе в течение 5–10 мин до полного высыхания. Влажность и температуру при этом не контролировали. Масс-спектрометрический анализ осуществляли с помощью времяпролетного МАЛДИ масс-спектрометра MicroflexTM (BrukerDaltonics, Германия), оснащенного азотным лазером 337 нм. Все измерения проводили в линейном режиме, детектируя положительные ионы. Для накопления масс-спектров мощность лазерного излучения устанавливали на уровне минимального порогового значения, достаточного для десорбции-ионизации образца. Параметры масс-спектрометра оптимизировали для диапазона m/z от 2000 до 20000. Внешнюю калибровку проводили с использованием точных значений масс известных белков E. coli. Для записи, обработки и анализа масс-спектров использовали программное обеспечение компании Bruker Daltonics (Германия): flexControl 2.4 (Build 38) и flexAnalysis 2.4 (Build 11). Точность измерения масс составляла ± 2 Да. Видовую идентификацию бактерий проводили путем сопоставления получаемых масс-спектров с имеющимися базами данных с помощью программного пакета MALDI Biotyper 2.0 (Bruker Daltonics, Германия). Генетическое тестирование стафилококков Для установления наличия генов, детерминирующих синтез стафилококковых энтеротоксинов (гены sea – sed, sei – sej), токсина синдрома токсического шока (ген tsst) и лейкоцидина (гены lukS – lukF) применена традиционная ПЦР с использованием предложенных ранее праймеров [9, 10]. Амплификацию исследуемых фрагментов ДНК выполняли в реакционной смеси, содержащей 10 мМ Tris-HCl, pH 9,0; 50 мM KCl; 2 мM MgCl2, по 250 мкМ каждого дНТФ, 1 едTaq-полимеразы (Promega, USA) и по 10 пмоль каждого праймера в объеме 25 мкл. Реакцию амплификации проводили в программируемом термостате DNA EngineTetrad 2 (MJ Research, USA), используя следующий профиль амплификации: 94 ° С – 5 мин., 30 циклов: 94 ° С – 1 мин, 60 ° С – 1 мин, 72 ° С – 1 мин. Продукты реакции анализировали в 2 % агарозном геле. Результаты исследования и их обсуждение Согласно данным бактериологического и масс-спектрометрического тестирования установлен видовой состав стафилококков, выделяемых от пациентов с дерматитами. Среди проанализированных 185 штаммов, 91 штамм (49,1 %) принадлежал к виду S. aureus, 28 штаммов (15,1 %) – к S. epidermidis, 30 штаммов (16,2 %) составили S. hominis, 18 (9,7 %) штаммов – S. haemolyticus, S. capitis– 4 (2 %), на такие виды как S. saprophyticus, S. warneri, S. pattenkoferi приходилось по 0,5 %. Также результаты генетического типирования показали наличие среди выделенных штаммов Micrococcus luteus и Corynebacteriumaurim ucosum в 0,5 % случаев. Исследуемые штаммы продемонстрировали наличие гена mecA в 15 случаях из 185 (8,1 %), причем данный признак был обнаружен только среди коагулазоотрицательных стафилококков: S. hominis – 7 штаммов из 30 (23,3 %); S. epidermidis – 4 штамма из 28 (14,3 %); S. haemolyticus – 4 штамма из 18 (22,2 %). Наличие стафилококковой хромосомной кассеты SCCmec у коагулазоотрицательных стафилококков, по мнению некоторых авторов [4], свидетельствует о ее участии в функции горизонтального обмена генами. Считается, что первыми стафилококками, получившими SCCmec, были S. haemolyticus, и только в последующем произошла передача этого элемента другим коагулазоотрицательным стафилококкам и S. aureus [2]. Полученные результаты по отсутствию гена mecA среди изученных штаммов S. aureus согласуются с данными литературы. Cобранные нами штаммы относятся к внебольничной популяции стафилокококков, среди которых процент устойчивых к метициллину штаммов составляет не более 30 %, тогда как ген mecA, кодирующий устойчивость к метициллину, обнаруживается преимущественно среди госпитальных стафилококков – до 40 %. Следующую группу молекулярных маркеров составили расположенные на МГЭ гены, детерминирующие синтез энтеротоксинов A, B, C и др., токсина синдрома токсического шока, т.е. те гены, продукты которых обладают суперантигенной активностью (PTSAgs) и могут оказать влияние на состояние иммунореактивности макроорганизма. Определение наличия генов PTSAgs позволяет выявить патогенный потенциал и охарактеризовать отдельные штаммы. Проведенные исследования показали наличие генов, детерминирующих токсинообразование стафилококков у 40,5 % изученных штаммов (75 клинических изолятов). Следует отметить, что частота встречаемости указанных генов у штаммов золотистого стафилококка составила 86,7 %, у коагулозоотрицательных штаммов – 13,3 % случаев. Обнаружена значительная вариабельность в наборе генов, детерминирующих синтез этих токсинов у клинических изолятов стафилококков. Так, изученные штаммы имели от одного до четырех генов в различных сочетаниях. В геноме 35 изолятов обнаружен только один ген из sea – sei. У 20 штаммов преобладали по два гена и у 20 – от трех до четырех генов. При этом установлено, что коагулазоотрицательные штаммы, несущие mec A, не обладали ни одним из перечисленных генов. В целом из общего количества генетических детерминант токсинообразования преобладали гены seg – 26,8 %, seh – 17,1 % случаев. Исходя из значительной видовой вариабельности грамположительной флоры в микробиоценозе кожи исследуемых больных, была проанализирована частота встречаемости генов, определяющих токсинообразование стафилококков в зависимости от видовой принадлежности штаммов. Так, наибольшим разнообразием генов обладали штаммы золотистого стафилококка, среди которых преобладал ген seg. В связи с тем, что среди коагулазоотрицательных штаммов стафилококков наибольшую частоту встречаемости показали гемолитический и эпидермальный стафилококки, а доля остальных оказалась незначительна, то анализ генов, детерминирующих токсинообразование, осуществляли только у этих видов стафилококков, что показало у S. haemolyticus наличие только генов seb и sed, у эпидермального стафилококка только seh. Значительный интерес представлял анализ полученных результатов в зависимости от участка кожи, с которого были выделены микроорганизмы. В соответствии с этим все полученные штаммы разделили на две группы: 1-я – штаммы, выделенные с чистых участков кожи, 2-я – штаммы, выделенные с пораженных участков кожи (рис. 1). Таким образом, наиболее значимые различия по частоте встречаемости детерминант токсинообразования можно отметить для генов sea (14,7 % в 1-й группе и 7,3 % во 2-й) и sei (11,7 % в первой группе, 19,1 % – во второй). Причем ген sea достоверно чаще обнаруживался в стафилококках, изолированных на чистых участках кожи, тогда как ген sei – на пораженных. Частота встречаемости данного признака в указанных группах в зависимости от вида микроорганизмов показала различия только для S. aureus (рис. 2). Для остальных видов из рода Staphylococcus, наиболее часто обнаруживаемых на коже, результаты следующие: S. epidermidis показал ген энтеротоксина sei в одном случае с чистого участка кожи. А S. haemolyticus – наличие 1 случая из двух, наличие гена sed – в одном из четырех случаев. Рис. 1. Частота встречаемости энтеротоксинов a, b, c, d, g, h, I, j в зависимости от участка кожи Рис. 2.Частота встречаемости детерминант токсинообразования у S. aureus, выделенных с чистого и пораженного участка кожи Ген TSST обнаружен только в 10,8 % случаев от всего количества исследуемых штаммов, причем в двух случаях параллельно с наличием хромосомной кассеты mecA у S. epidermidis. При этом в 55 % случаев ген TSST обнаруживали у штаммов, выделенных с чистых участков кожи, в 45 % случаев – с пораженных участков. Сравнительный анализ хромосомной ДНК стафилококков, выделенных при хронических кожных патологиях, показал, что изученные штаммы Staphylococcus spp. обнаруживают значительную вариабельность в наборе генетических детерминант, характеризующих их патогенный потенциал. Кассета mecA, рассматриваемая как фактор устойчивости к метициллину, была обнаружена в 8,1 % случаев и только среди коагулазоотрицательных стафилококков. Гены токсинообразования наиболее часто встречались среди коагулазоположительных стафилококков (S. aureus). Наиболее часто в проанализированной выборке встречались гены seg – 26,8 %, и seh – 17,1 % случаев. Штаммы, изолированные с разных участков кожи, значимо отличались по частоте обнаружения маркеров генов энтеротоксинов A, С и I. Таким образом, молекулярно-генетический анализ ДНК и генотипирование стафилококков может иметь теоретическое и практическое значение в целях обеспечения более качественной диагностики стафилококковой инфекции, эффективного мониторинга и лечения. Нестеров А.С., д.м.н., профессор, зав. Циклом кожных и венерических болезней кафедры инфекционных и кожно-венерических болезней медицинского факультета Ульяновского государственного университета, г. Ульяновск; Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|