Эритромицин мазь от стафилококка
Совершенствование микробиологической диагностики стафилококковых инфекций и экологические аспекты их возбудителей
Совершенствование микробиологической диагностики стафилококковых инфекций и экологические аспекты их возбудителей: (1)
Лаборатория микробиологической диагностики и лечения инфекций в онкологии Российского онкологического научного центра им. Н.Н. Блохина РАМН, Москва
Мультирезистентные госпитальные штаммы золотистых стафилококков ответственны за многие гнойные заболевания и раневые инфекции в клиниках. Доказана роль золотистых стафилококков при назальном носительстве в возникновении раневых инфекций посредством аутоинфицирования. Не только больные, находящиеся в стационаре, но и больничный персонал может быть в высокой степени колонизирован коагулазопозитивными стафилококками. Персистирование золотистого стафилококка у медицинского персонала способствует распространению этих микроорганизмов в окружающей среде. Поэтому выявление "здоровых" носителей золотистого стафилококка среди медицинского персонала и эрадикация возбудителя позволяют контролировать вспышки стафилококковой инфекции в стационаре. Оценена клиническая эффективность назальной мази мупироцина у носителей золотистых стафилококков среди сотрудников отделения реанимации и интесивной терапии Онкологического научного центра. Назальное носительство золотистого стафилококка было выявлено у 17 (26%) из 65 человек. Все штаммы были чувствительны к оксациллину . Через 5-7 дней после окончания применения назальной мази мупироцина эрадикация S.aureus была в 100%. Через 1 месяц эффект сохранялся у 94%, через 5-6 месяцев - у 76%, через 8-9 месяцев - у 60%. Авторы полагают, что интраназальная мазь мупироцина ("Бактробан") является удобной в применении, малотоксичной и высокоактивной для санации назальных носителей золотистого стафилококка.
В течение первой недели жизни 90% новорожденных являются назальными носителями золотистых стафилококков. В первые 2 года жизни только у 20% детей обнаруживаются золотистые стафилококки в полости носа, а к 4-6 годам они обнаруживаются у 30-50% [2]. Внегоспитальное носительство у взрослых колеблется в пределах 12-50%.
Среди больных, поступивших в стационар, 20-30% из них становятся носителями преимущественно больничных штаммов золотистых стафилококков. Особенно это касается больных, леченных антибиотиками, больных диабетом, пациентов, находящихся на гемодиализе, иммунодефицитных больных, а также больных инфекционными заболеваниями. Госпитальные штаммы золотистых стафилококков ответственны за многие гнойные заболевания и раневые инфекции в клиниках. Доказана роль золотистых стафилококков при назальном носительстве у больных в возникновении раневых инфекций посредством аутоинфицирования [3].
Среди медицинского персонала назальное носительство золотистого стафилококка может достигать 35% [4]. Персистирование золотистых стафилококков у медицинского персонала способствует распространению этих микроорганизмов в окружающей среде, поэтому назальное носительство золотистых стафилококков среди медицинского персонала должно быть выявлено и пролечено, что может контролировать стафилококковые вспышки в стационаре.
Целью настоящего исследования явилось определение клинической эффективности назальной мази мупироцина у назальных носителей золотистых стафилококков - сотрудников отделения реанимации и интенсивной терапии.
Подсчет производился следующим образом: количество выросших колоний х 10 х 5. Массивность обсеменения, выражающаяся показателем 10 2 микробных клеток, снимаемых с тампона, являлась показателем умеренной обсемененности верхних дыхательных путей. При таком обсеменении попадания возбудителя во внешнюю среду, как правило, не происходит. Более высокая обсемененность является показателем высокой обсемененности, при которой происходит выделение возбудителя во внешнюю среду, как при различных экспираторных актах, так и при спокойном дыхании [5].
У выделенных штаммов золотистых стафилококков определялась чувствительность к 9 антибиотикам диско-диффузионным методом.
Обследованию подлежали 65 сотрудников отделения реанимации и интенсивной терапии (врачи, младший и средний медицинский персонал). При выделении из полости носа золотистых стафилококков исследования производили повторно через 7-10 дней. Только при наличии двукратного положительного анализа на золотистый стафилококк сотрудник включался в исследование.
Мупироцин ("Бактробан") является антибиотиком широкого спектра действия, активным в отношении метициллинорезистентных стафилококков. Использовалась 2% назальная мазь в небольшом количестве (со "спичечную головку"), которая наносилась в передние отделы каждого носового хода 2-3 раза в день в течение 5 дней.
Контрольный забор материала у назальных носителей золотистых стафилококков производился на 5-7-е сутки по окончании лечения, через 1, 5-6 и 8-9 месяцев от начала терапии.
| Таблица 1. Динамика числа колоний S.aureus, выделенных у назальных носителей после лечения назальной мазью мупироцина | |||||
| N пробы | Число колоний S.aureus, выделенных из носа | ||||
| до лечения | 5-7-е сутки после окончания лечения | через 1 месяц | через 5-6 месяцев | через 8-9 месяцев | |
| 1 | 1x10 4 | 0 | 0 | 0 | 0 |
| 2 | 2x10 3 | 0 | 0 | 0 | 0 |
| 3 | 7x10 3 | 0 | 0 | 0 | 0 |
| 4 | 2x10 3 | 0 | 0 | 0 | 0 |
| 5 | 1x10 2 | 0 | 0 | 1x10 4 | - |
| 6 | 1x10 4 | 0 | 0 | 0 | 0 |
| 7 | 1x10 4 | 0 | 0 | 0 | 0 |
| 8 | 1x10 4 | 0 | 0 | 0 | - |
| 9 | 1,5x10 3 | 0 | 0 | 0 | 0 |
| 10 | 2,5x10 2 | 0 | 0 | 0 | 2x10 4 |
| 11 | 5x10 2 | 0 | 0 | 0 | 2,5x10 2 |
| 12 | 5x10 2 | 0 | 7,5x10 2 | - | - |
| 13 | 1x10 4 | 0 | 0 | 0 | 0 |
| 14 | 1x10 2 | 0 | 0 | 0 | - |
| 15 | 1,5x10 2 | 0 | 0 | 2,5x10 2 | - |
| 16 | 2,7x10 3 | 0 | 0 | 1,55x10 3 | - |
| 17 | 1x10 2 | 0 | 0 | 0 | 0 |
При контрольном обследовании 17 человек через 5-7 дней по окончании лечения роста золотистых стафилококков не отмечено ни в одном случае. Эффект составил 100%. При обследовании через 1 месяц по окончании терапии рост золотистого стафилококка отмечен у 1 (5,9%) из 17 человек. Эффект составил 94,1%. Через 5-6 месяцев рост выявлен у 3-х (18,8%) из 16 человек. Суммарный эффект составил 76,4%. Через 8-9 месяцев рост золотистых стафилококков обнаружен еще у 2 (18,2%) из 11 медицинских работников (2 человека выбыли из исследования на данном этапе). Общий суммарный эффект составил 60%. Из 6 случаев повторной контаминации у 2-х человек золотистый стафилококк определялся в несколько большем количестве, у 4-х - в том же количестве, что и до лечения.
Таким образом, через 5-9 месяцев бактериологический эффект сохранялся в 60% случаев (у 9 из 15 человек).
Все выделенные штаммы золотистых стафилококков до лечения мупироцином были чувствительны к оксациллину и ципрофлоксацину , более 90% штаммов были чувствительны к карбенициллину и гентамицину , 88,2% штаммов были чувствительны к цефазолину , и 76,4% штаммов были чувствительны к эритромицину ; чувствительность к доксициклину , левомицетину (хлорамфениколу) и ампициллину была очень низкой (табл. 2).
| Таблица 2. Распределение 17 штаммов S.aureus, выделенных от назальных носителей, по степени чувствительности к антибиотикам (диско-диффузионный метод) | |||
| Антибиотики | Kоличество штаммов | ||
| Ч | Сч | У | |
| Оксациллин | 17 (100%) | - | - |
| Ампициллин | 7 (42%) | 5 (29%) | 5 (29%) |
| Kарбенициллин | 16 (94%) | - | 1 (5,9%) |
| Цефазолин | 15 (88,2%) | 2 (11,8%) | - |
| Эритромицин | 13 (76,4%) | 2 (11,8%) | 2 (11,8%) |
| Доксициклин | 10 (58,8%) | 2 (11,8%) | 5 (29,4%) |
| Гентамицин | 16 (94%) | 1 (5,9%) | - |
| Хлорамфеникол | 6 (35,3%) | 1 (5,9%) | 10 (58,8%) |
| Ципрофлоксацин | 17 (100%) | - | - |
Носовая полость 3 человек была повторно контаминирована золотистыми стафилококками с тем же спектром чувствительности, что и до лечения (штаммы были чувствительны ко всем исследуемым препаратам). В 2 случаях возникла повторная контаминация штаммами, резистентными к эритромицину и доксициклину, и в 1 случае - штаммом, более чувствительным к антибиотикам.
Побочные эффекты отмечены в 1 случае на вторые сутки применения мупироцина у врача, страдающего поливалентной лекарственной аллергией, и выражались в аллергической реакции сопровождающейся кожным зудом, гиперемией кожи, отеком тканей лица.
Ранее предпринимаемые попытки лечения и профилактики носителей золотистых стафилококков заключались в использовании интраназальных мазей, содержащих хлоргексидин, хлоргексидиновые шампуни, флуклоксациллин, но они не были столь эффективны и не обеспечивали долгосрочную эрадикацию.
С учетом генетической предрасположенности носителей золотистых стафилококков к этому микроорганизму, считается целесообразным проведение повторных курсов терапии интраназальной мазью мупироцина с периодичностью 1 раз в 6-9 месяцев. В нашем исследовании только 40% лиц на сегодня нуждаются в повторных курсах лечения . Причем для снижения вероятности повторного заражения необходимы выявление и санация носителей золотистого стафилококка, а также признано целесообразным лечение членов семей носителей золотистых стафилококков и даже имеющихся у них домашних животных, если у них был обнаружен золотистый стафилококк. Целесообразным является также проведение одновременной санации всего медицинского персонала конкретного лечебного учреждения, которые являются носителями золотистых стафилококков.
Таким образом, 2% интраназальная мазь мупироцина ("Бактробан") является удобной в применении, малотоксичной и высокоактивной при санации назальных носителей золотистых стафилококков.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 2000-N3, стр. 35-38.
2. Willems F.T.C. Epidemiology of nasal carriage of Staphylococcus aureus. In: Nasal Carriage of Staphylococcus aureus. Ed.JWM van der Meer. Exсerpta Medica 1990; 3-4.
3. Frank U., Lenz W., Damrath E. et al. Hospital staff and nasal carriage. In: Nasal Carriage of Staphylococcus aureus. Ed. J.W.M. van der Meer. Ibid; 15-19.
4. Van der Meer. J.M.M. Nasal Carriage of Staphylococcus aureus. In: Nasal Carriage of Staphylococcus aureus. Ed.: J.W.M. van der Meer. Ibid; 1-2.
5. Приказ МЗ СССР N720 от 31 июля 1978 г "Об улучшении медицинской помощи больным с гнойными хирургическими заболеваниями и усилении мероприятий по борьбе с внутрибольничными инфекциями".
Резюме. Под наблюдением находились 33 больных с пиодермией. Возраст пациентов — от 7 до 46 лет. Острая форма пиодермии в виде распространенного импетиго диагностирована у 10 больных, глубоких множественных рецидивирующих фолликулитов волосистой части головы — у 5, поверхностной диффузной стрептодермии голеней (пиококковый эпидермит) — у 7. Для лечения больных местно 2 раза в день применяли мазь БАКТРОБАН (мупироцин), оказывающую бактерицидное действие на возбудителей пиодермии. Полное клиническое выздоровление больных с импетиго отмечали на 5–6-й день, сикозом — в течение 2 нед, с фолликулитом волосистой части головы — в течение 9–11 дней; из 7 пациентов с диффузной стрептодермией голеней у 3 больных — в течение 14–18 дней, еще у 4 — достигнуто улучшение состояния. В группу сравнения вошли 22 больных с импетиго и 50 — со стафилококковым сикозом. Излечение импетиго у этих больных достигнуто в течение 8–12 дней, при стафилококковом сикозе отмечено лишь некоторое улучшение состояния больных. На основании результатов наблюдений и данных литературы автор рекомендует БАКТРОБАН для широкого применения в дерматологической практике.
БАКТРОБАН новый антибиотик широкого спектра действия для наружного (местного) применения.
Препарат получают при ферментации Pseudomonas fluorescens в виде активной субстанции кальциевой соли мупироцина, которая ингибирует изолейцин-транспортную РНК-синтетазу. Это приводит к торможению синтеза бактериального белка и последующей гибели микроорганизма.
Такой механизм действия препарата практически исключает или существенно замедляет формирование резистентности к нему. Препарат широко применяют в Европе и Америке более 10 лет, а резистентность к нему не превышает 1% (Leyden J. J., 1997).
Препарат эффективен в отношении штаммов микроорганизмов, резистентных к эритромицину и другим антибиотикам (Ohana N. et al., 1989).
БАКТРОБАН в зависимости от концентрации обладает выраженной бактерицидной активностью в отношении возбудителей гнойничковых заболеваний кожи.
Препарат эффективен в отношении золотистого (патогенного), эпидермального и сапрофитного стафилококков, а также в отношении β-гемолитических стрептококков (Str. pyogenes) и некоторых других микроорганизмов.
Кроме того, пероральное применение антибиотиков имеет ряд существенных недостатков, часто сопровождается побочными явлениями со стороны пищеварительного тракта (тошнота, диарея, дисбактериоз, кандидоз и др.), а также возникновением аллергических реакций, вплоть до развития анафилактического шока.
К тому же быстрыми темпами повышается устойчивость микроорганизмов к таким основным антибиотикам, как эритромицин, цефалексин и флуклоксациллин и др. (Finnerty E.F., Folan D.W., 1979; Leyden J.J., 1990).
БАКТРОБАН не обладает системным и локальным токсическим эффектом, поскольку предназначен только для наружного применения, поэтому он не оказывает негативного влияния на флору пищеварительного тракта и не взаимодействует с антибиотиками и другими препаратами для перорального применения.
При наружном применении мупироцин практически не всасывается. Следовые количества его, абсорбированные с кожи, быстро метаболизируются путем гидролиза в неактивную мониевую кислоту, которая выводится из организма с мочой. Результатами многочисленных исследований установлено, что монотерапия мазью (кремом) БАКТРОБАН (мупироцин) превышает или аналогична по эффективности пероральной терапии эритромицином, пенициллином, клоксациллином и цефалексином (Ohana N. et al., 1989; Leyden J.J., 1990, 1992; Martin de Nicolas M.M. et al., 1995; Kraus S. et al., 1997; Leyden J.J., 1997).
Все исследователи при лечении поверхностных пиодермий единодушно отдают предпочтение БАКТРОБАНУ среди многих других антибиотиков (Atherton D.J., 1996; Williams R.E.A., 1996; Kraus S. et al., 1997; Leyden J.J., 1997).
В прошлом году БАКТРОБАН появился в аптечной сети Украины. Препарат выпускается в виде 2% мази для наружного применения в тубах по 15 г, для интраназального применения в тубах по 3 г (эта форма предназначена для элиминации назального носительства S. aureus).
Цель работы изучить терапевтическую эффективность 2% мази БАКТРОБАНА (мупироцина) при некоторых гнойничковых заболеваниях кожи.
Наблюдали 33 больных с пиодермией. Возрастпациентов от 7 до 46 лет.
Острая форма пиодермии в виде импетиго выявлена у 17 больных: у 12 детей в возрасте от 6 до 12 лет и у 2 женщин в возрасте от 20 до 22 лет. Ранее 5 детей безуспешно лечили линиментом хлорамфеникола и эритромициновой мазью, 2 бетаметазоном, что привело к диссеминации гнойничков.
У всех наблюдаемых нами больных проявленияимпетиго локализовались в области верхних конечностей, у 5 на лице, у 3 из них с образованием в углах рта трещин (заеды), у 2 женщин и у 4 детей и в области нижних конечностей.
Всех больных импетиго лечили 2% мазью БАКТРОБАН. Мазь наносили на очаги поражения 2 раза в сутки. Перед наложением мази пустулы и фликтены вскрывали.
Заметное улучшение состояния больных отмечали на 2-е3-и сутки. Полное выздоровление всех больных (отторжение корок, полная эпителизация эрозий) наступило на 57-й день.
В группу сравнения вошли 22 ребенка с импетиго в возрасте 512 лет. При лечении 10 из них использовали 510% линимент хлорамфеникола, 12 эритромициновую мазь. Терапевтический эффект при таком лечении был намного хуже, чем при лечении мазью БАКТРОБАН.
Клиническое излечение в течение 1015 дней отмечено у 6 больных при использовании линимента хлорамфеникола.
Под нашим наблюдением также находились 12 больных (все мужчины) с рецидивирующим фолликулитом волосистой части головы (7) и стафилококковым сикозом бороды и усов (5).
Мазью БАКТРОБАН смазывали очаги поражения 2 раза в сутки. Излечение у всех больных с фолликулитом волосистой части головы наступило на 811-е сутки. До назначения БАКТРОБАНА у 3 из них безуспешно применяли анилиновые краски в сочетании с мазями, содержащими антибиотики.
В группу сравнения вошли 15 больных с фолликулитом волосистой части головы, которых безуспешно лечили 5% линиментом хлорамфеникола в течение длительного времени. Клиническое излечение этих больных было достигнуто только при сочетании местного лечения антибиотиксодержащими мазями с пероральным приемом доксициклина. Излечение с помощью 2% мази БАКТРОБАН 5 больных с сикозом бороды и усов было достигнуто на 1415-й день.
В группу сравнения вошли 50 больных с сикозом, которых лечили антибиотиксодержащими мазями (эритромициновой, тетрациклиновой, линиментом хлорамфеникола и др.), 1% желтой или 2% белой ртутной мазью.
У всех больных этой группы было достигнутолишь улучшение их состояния. Только после применения общей стимулирующей и антибактериальной системной терапии (в основном доксициклином) были излечены 42 больных.
Из 7 больных с поверхностной диффузной стрептодермией голеней (стрептококковый эпидермит голеней) клиническое излечение в течение 14 18 дней достигнуто только у 3, у 4 отмечено значительное улучшение состояния.
Применение линимента хлорамфеникола, эритромициновой и тетрациклиновой мазей у пациентов с аналогичной патологией способствует лишь временному улучшению их состояния.
При использовании 2% мази БАКТРОБАН осложнений и побочных явлений не наблюдали.
На основании результатов наблюдений и данных литературы можно прийти к выводу о том, что БАКТРОБАН в настоящее время наиболее эффективный препарат, применяемый наружно у больных с поверхностной пиодермией. Местная терапия БАКТРОБАНОМ при поверхностной пиодермии более приемлема и эффективна, чем системная терапия антибиотиками.
БАКТРОБАН соответствует всем требованиям, предъявляемым к лекарственным препаратам для наружного применения:
- по терапевтической активности превосходит эффективность других антибиотиков, применяемых перорально и местно;
- не содержит системно действующих компонентов;
- активен в отношении всех возбудителей пиодермии;
- хорошо переносится, не оказывает побочных эффектов и не вызывает осложнений.
Полученные результаты позволяют рекомендовать БАКТРОБАН для широкого применения в дерматологической практике как один из наиболее эффективных препаратов для лечения больных с пиодермией.
- Atherton D.J. (1996) The clinical efficacy of mupirocin in the treatment of primary skin infections. Int. Clin. Pract. Ser., 12: 25 35.
- Finnerty E.F., Folan D.W. (1979) Changing antibacterial sensitivities of bacterial skin diseases: office practice 19771978. Cutis, 23: 227230.
- Kraus S. et al. (1997) Comparison of a new formulation of mupirocin calcium with oral cephalexin in the treatment of secondarily infected traumatic lesions (SITL). Proceedings of 37 th ICAAC, Toronto, Canada.
- Leyden J.J. (1997) Therapy for acne vulgaris. New. Engl. J. Med., 336(16): 11561162.
- Leyden J.J. (1990) Mupirocin: a new topical antibiotic. J. Amer. Acad. Dermatol., 22(5Pt1): 879883.
- Leyden J.J. (1992) Review of mupirocin ointment in the treatment of impetigo. Clin. Pediatr. (Phila), 31(9): 549553.
- Martin de Nicolas M.M. et al. (1995) In vitro activity of mupirocin and eleven other antibiotics against 1500 Spanish clinical isolates of Staphylococcus aureus causing hospital infections/ Rev. Esp. Quimioterap., 8(2): 145150.
- Ohana N. et al. (1989) Skin-isolated community-acquired Staphylococcus aureus: in vitro resistance to methicillin and erythromycin J. Amer. Acad. Dermatol., 3: 544546.
- Williams R.E.A. (1996) The clinical efficacy of mupirocin in the treatment of secondary skin infections. Int. Clin. Pract. Ser., 12: 923.
Глухенький Борис Тихонович
Резюме. Під спостереженням знаходились 33 хворих з піодермією. Вік пацієнтів — від 7 до 46 років. Гостра форма піодермії у вигляді поширеного імпетиго діагностована у 10 хворих, глибоких множинних рецидивуючих фолікулітів волосистої частини голови — у 5 хворих, поверхневої дифузної стрептодермії гомілок (піококовий епідерміт) — у 7. Лікування означених хворих проводили маззю БАКТРОБАН (мупіроцин), яка виявляє бактерицидну дію на збудників піодермії. Мазь застосовували місцево 2 рази на день. Повне клінічне одужання хворих з імпетиго відзначали на 5–6-й день, з сикозом — протягом 2 тиж, з фолікулітом волосистої частини голови — 9–11 днів; у 3 пацієнтів з дифузною стрептодермією гомілок — протягом 14–18 днів, ще у 4 — досягнуто поліпшення їх стану. До групи порівняння ввійшли 22 хворих з імпетиго, 50 — зі стафілококовим сикозом. Вилікування імпетиго у цих хворих досягали на 8–12-й день, у хворих зі стафілококовим сикозом відзначали лише деяке поліпшення їх стану. Результати спостережень і дані літератури дають підстави рекомендувати БАКТРОБАН для широкого застосування в дерматологічній практиці.
Ключові слова:імпетиго, сикоз, піококовий епідерміт, місцеве лікування, БАКТРОБАН, мупіроцин
Gloukhenkiy Boris T
Summary. We had 33 patients, age from 7 to 46 years, with pyogenic skin infections under our observation. Ten patients had acute disseminated impetigo, 5 patients — chronic staphylococcal siccosis, 5 patients – deep recurrent folliculitis of the scalp, 6 patients – superficial diffuse pyococcal epidermitis. All the patients under observation were treated with BACTROBAN (mupirocin) ointment, acting bactericidally against pyogenic pathogens of the skin. The ointment was applied two times a day. Complete clinical recovery was achieved in 5–6 days after initiation of treatment in patients with impetigo, 2 weeks – in patients with siccosis, 9–11 days – in patients with folliculitides of the scalp. In patients with pyococcal epidermitis clinical recovery was achieved after 14–18 days of therapy in 3 patients and 4 patients showed significant improvement. The control group was comprised of 22 patients with impetigo, 50 patients with staphylococcal siccosis. Recovery from impetigo was achieved in 8–12 days, while patients with staphylococcal siccosis demonstrated just a slight improvement. Based on our observations and literature data we deem it expedient to recommend BACTROBAN ointment for broad implementation into dermatological clinical practice for management of pyogenic infections of the skin.
Key words: inimpetigo, siccosis, pyococcal epidermodermitis, topical treatment, BACTROBAN, mupiroc
Глухенький Борис Тихонович
254112, Киев, ул. Дорогожицкая, 9
Киевская медицинская академия
последипломного образования
им. П.Л. Шупика МЗ Украины,
кафедра дерматовенерологии
16 августа 2016
- 9980
- 7,0
- 0
- 6
Структурная формула нового пептидного антибиотика.
Немецкие ученые обнаружили новое оружие для борьбы с больничным монстром — мультирезистентным золотистым стафилококком. Долгие годы оно скрывалось не в вечной мерзлоте или Марианской впадине, а прямо под нашим носом. Вернее — в нём.
В последние годы во всем мире увеличилось количество инфекционных заболеваний, вызванных устойчивыми к антибиотикам бактериями. Организмы с множественной лекарственной резистентностью (multidrug-resistant organisms, MDRO), такие как метициллин-резистентный золотистый стафилококк, нечувствительные к ванкомицину энтерококки или резистентные к цефалоспоринам третьего поколения грамотрицательные бактерии, в ближайшие десятилетия могут стать более частыми причинами смерти, чем рак [1].
Несколько лет назад удалось обнаружить, что представители человеческой микробиоты способны производить бактериоцины, поражающие близкородственных бактерий [2]. Например, в 2014 году из человеческого комменсала Lactobacillus gasseri выделили и описали новый синтезируемый рибосомами тиопептидный антибиотик — лактоциллин [3].
Семейные разборки
Немецкий исследователь Александр Ципперер со своими сотрудниками в июле 2016 года сообщил о том, что обнаружил в человеческом носу бактерию Staphylococcus lugdunensis IVK28, которая подавляет рост метициллин-резистентного золотистого стафилококка (methicillin-resistant Staphylococcus aureus, MRSA) [1].
Стафилококки относятся к типичным бактериям-комменсалам, колонизирующим кожу и поверхности слизистых оболочек. Staphylococcus aureus — шаровидные грамположительные бактерии, вырабатывающие каротиноидный пигмент, который придает их клеткам золотистый цвет (рис. 1). Эти микроорганизмы чрезвычайно устойчивы к внешним воздействиям и выживают в воздухе, пыли, почве, продуктах питания, на оборудовании пищевых производств и предметах быта [6], [7].
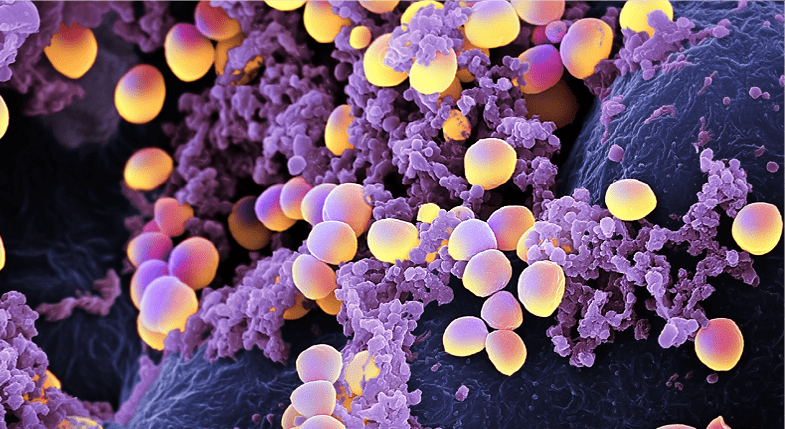
Рисунок 1. Staphylococcus aureus и лейкоциты.
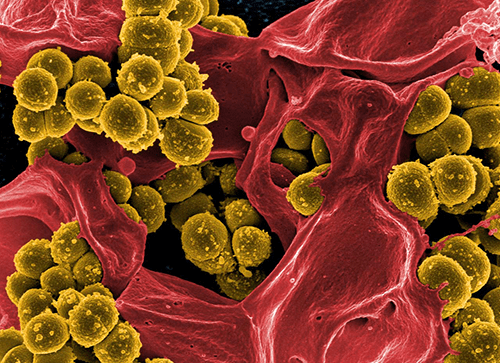
Рисунок 2. Метициллин-резистентные золотистые стафилококки.
Staphylococcus aureus — бактерия условно-патогенная, проявляющая свои патологические свойства только в благоприятных условиях, а создает их, как правило, ослабление иммунитета носителя. Активная жизнедеятельность стафилококка может привести к разнообразным заболеваниям [5], [7], [8]:
- кожи (прыщи, фурункулы, синдром ошпаренной кожи);
- органов дыхания (плеврит, пневмония);
- костной и соединительной тканей (артрит, остеомиелит);
- нервной системы и органов чувств (отит, менингит);
- сердечно-сосудистой системы (эндокардит, флебит, стафилококковая бактериемия).
Факторы патогенности S. aureus — это микрокапсула, компоненты клеточной стенки, ферменты агрессии и токсины. Микрокапсулы защищают клетки бактерий от фагоцитоза, способствуют их адгезии и распространению по организму хозяина. Составляющие клеточной стенки (например пептидогликан, тейхоевые кислоты и белок А) вызывают развитие воспаления, обездвиживают фагоциты и нейтрализуют иммуноглобулины. Коагулаза, главный фермент агрессии, вызывает свертывание плазмы крови [7], [9].
Наиболее опасны метициллин-резистентные стафилококки (methicillin-resistant S. aureus, MRSA) (рис. 2). Метициллин — это модифицированный пенициллин, с помощью которого еще недавно успешно боролись со стафилококковой инфекцией. MRSA устойчивы не только к метициллину, но и к другим антибиотикам пенициллиновой группы (диклоксациллину, оксациллину, нафциллину и др.), а также к цефалоспоринам. В последнее время выявлены штаммы и с более широким спектром устойчивости: ванкомицин-резистентные (VRSA) и гликопептид-резистентные (GISA) [6], [9], [10].
Штамм S. lugdunensis IVK28 эффективно боролся со своим вредоносным родственником лишь в условиях недостатка железа и только на твердых агаризованных средах (рис. 3, слева). Механизм противостояния был неясен, а потому Ципперер провел транспозонный мутагенез клеток выделенного штамма — чтобы выявить ген, ответственный за синтез смертельного для S. aureus вещества.

В итоге удалось получить мутанта IVK28, который не мог подавлять рост MRSA. Анализ места встройки транспозона показал, что тот нарушил структуру гена предполагаемой нерибосомной пептидсинтетазы (НРПС). Оказалось, что этот ген вместе с другими последовательностями, связанными с биосинтезом антибиотиков, входит в состав оперона размером 30 т.п.н. Это указывало на то, что предполагаемая молекула ингибитора может быть комплексом нерибосомных пептидов.
Оперон методом ПЦР обнаружили во всех культурах S. lugdunensis, а значит, он характерен для всего вида, а не только для штамма IVK28. Однако GC-состав оперона (26,9%) отличался от GC-состава остального генома S. lugdunensis (33,8%), что свидетельствовало о возможном заимствовании этого полезного генетического кластера у других видов бактерий — путем горизонтального переноса .
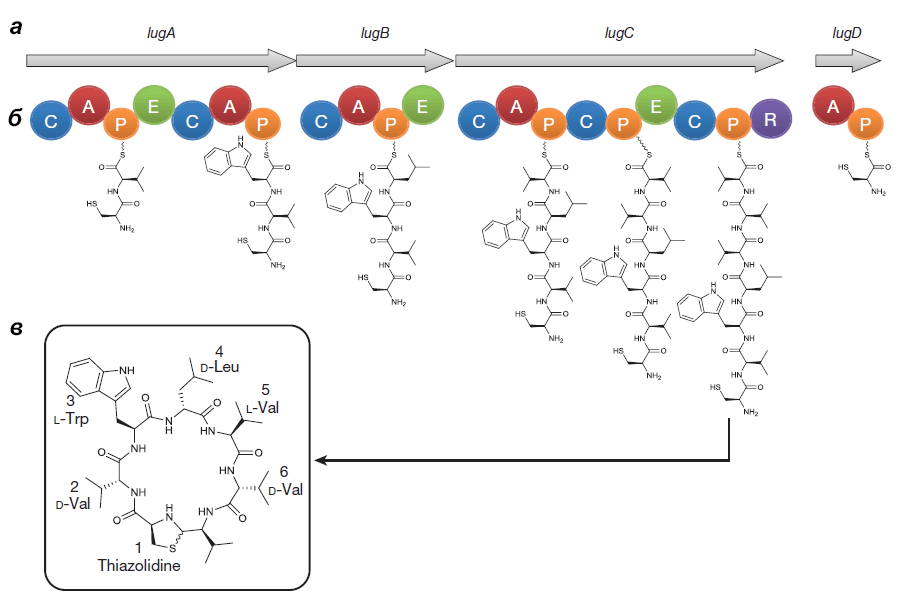
Оперон состоит из генов lugA, B, C и D, кодирующих пептидсинтетазные белки (см. врезку ниже), а также из других генов, чьи продукты необходимы для синтеза и транспорта нерибосомного пептида.
Чтобы окончательно вменить оперону участие в антибактериальной деятельности S. lugdunensis, наименьший ген (lugD) удалили. Мутант ΔlugD, как и ожидалось, не мог подавлять рост золотистого стафилококка, но когда в него ввели плазмиду с работающим геном lugD, агрессивный фенотип восстановился (рис. 3, в центре и справа).
Секретное оружие
Выделенный Ципперером продукт lug-оперона оказался нерибосомным циклическим пептидом, состоящим из пяти аминокислот (двух D-валинов, L-валина, D-лейцина и L-триптофана) и тиазолидинового гетероцикла (рис. 4). Назвали антибиотик лугдунином.
Химическим синтезом удалось получить продукт с идентичными природному лугдунину химическими свойствами и антибактериальным эффектом. Ученые предположили, что этот антибиотик ингибирует синтез бактериальных биополимеров — белков, ДНК и пептидогликанов [5].
Этот класс пептидов синтезируется в клетках низших грибов и бактерий без участия рибосом. Нерибосомные пептиды (НРП) также встречаются и у высших организмов, которые имеют бактерий-комменсалов [12].
НРП подразделяются на несколько функциональных групп [13]:
- антибиотики (ванкомицин);
- предшественники антибиотиков (ACV-трипептид — предшественник пенициллина и цефалоспорина);
- иммуносупрессоры (циклоспорин);
- противоопухолевые пептиды (блеомицин);
- сидерофоры (пиовердин);
- токсины (HC-токсин);
- сурфактанты (сурфактин).
Каждый модуль состоит как минимум из трех доменов:
- конденсирующего (принимающего пептидную цепь из предыдущего модуля);
- аденилирующего (выбирающего нужную аминокислоту);
- пептидильного (образующего пептидную связь).
Нередко модули включают и другие домены, в том числе эпимеризующий, который преобразует L-аминокислоты в D-формы [14].
По аналогии с триплетным рибосомным кодом для синтеза белка существует и нерибосомный, код НРПС, определяемый 10 остатками аминокислот в субстрат-связывающем кармане аденилирующего домена. От комбинации этих остатков зависит то, какая аминокислота будет встроена в пептид конкретным модулем НРПС. Зная этот код, можно предсказывать субстратную специфичность аденилирующих доменов и даже произвольно изменять ее посредством замены аминокислот в домене [14].
В экспериментах немецких ученых лугдунин действовал не только на метициллин-резистентных стафилококков, но и на гликопротеин-резистентных, и даже на других грамположительных бактерий типа листерии и ванкомицин-резистентного энтерококка (табл. 1). Минимальная ингибирующая концентрация (МИК) нового бактериоцина — 1,5–12 мкг × мл −1 , что говорит о высокой активности вещества. При этом такие концентрации никак не влияли на человеческую сыворотку, не вызывали лизис нейтрофилов или эритроцитов и не ингибировали метаболическую активность моноцитов. Бактериальные же клетки под действием лугдунина в концентрации даже ниже МИК прекращали синтезировать ДНК, РНК, белки и компоненты клеточной стенки. В этом отношении лугдунин напоминает даптомицин, дающий такой же эффект, но способ действия которого пока не изучен. Не было отмечено возникновения резистентности клеток S. aureus к лугдунину даже после их месячного выращивания на малых концентрациях.
| Виды и штаммы | Резистентность | МИК лугдунина (мкг × мл −1 ) |
|---|---|---|
| Staphylococcus aureus USA300 (LAC) | MRSA | 1,5 |
| + 50% человеческой сыворотки крови | 1,5 | |
| Staphylococcus aureus USA300 (NRS384) | MRSA | 1,5 |
| Staphylococcus aureus Mu50 | GISA | 3 |
| Staphylococcus aureus SA113 | 3 | |
| Staphylococcus aureus RN4220 | 3 | |
| Enterococcus faecium BK463 | VRE | 3 |
| Enterococcus faecalis VRE366 | VRE | 12 |
| Listeria monocytogenes ATCC19118 | 6 | |
| Streptococcus pneumoniae ATCC49619 | 1,5 | |
| Bacillus subtilis 168 (trpC2) | 4 | |
| Pseudomonas aeruginosa PAO1 | >50 | |
| Escherichia coli DH5α | >50 | |
| Условные обозначения: MRSA — метициллин-резистентные S. aureus; GISA — устойчивые к гликопротеинам S. aureus; VRE — ванкомицин-резистентные Enterococcus. Таблица из [1]. | ||
Испытания в боевых условиях
Как и полагается, способность лугдунина лечить стафилококковые инфекции продемонстрировали in vivo на мышиной модели (рис. 5). У шести мышей сбрили шерсть на спине и, повредив кожу многократным приклеиванием/отклеиванием пластыря, нанесли на это место золотистого стафилококка. Затем кожу обработали мазью, содержащей 1,5 мкг лугдунина, и спустя шесть часов оценили результат. Обработка новым антибиотиком сильно сокращала или даже полностью уничтожала популяцию S. aureus. Причем не только на поверхности кожи, но и в более глубоких ее слоях.
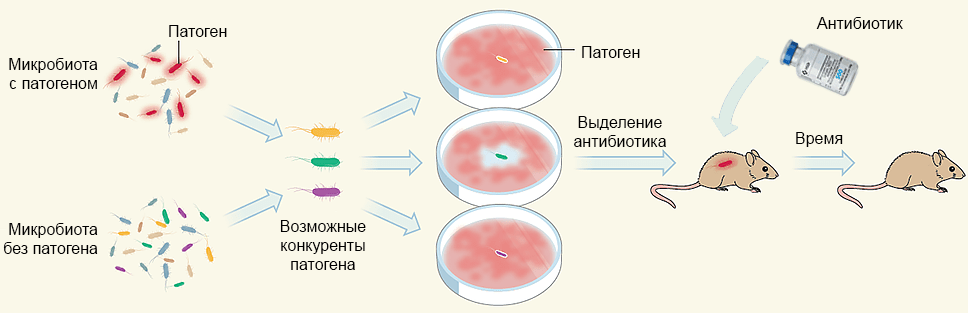
Рисунок 5. Общая схема подхода к идентификации природного антибиотика. Из бактериальных популяций человеческого тела отбирают представителей, которые не могут сосуществовать с интересующими патогенными бактериями. Этих возможных конкурентов тестируют по отдельности на средах с инфекционным агентом. Из культуры, успешно подавляющей рост патогенов, выделяют антибиотик, действие которого проверяют на животных моделях.
[5], рисунок модифицирован и адаптирован
Чтобы понять, может ли S. lugdunensis помешать колонизации носовой полости позвоночных животных золотистым стафилококком в естественных условиях, ученые провели следующий эксперимент. В носы хлопковых хомяков ввели два вида смешанных культур (S. aureus + S. lugdunensis IVK28 и S. aureus + S. lugdunensis IVK28ΔlugD) и каждую по отдельности. В контрольных случаях, когда вводили по одному штамму, все три культуры стабильно колонизировали носовую полость. Однако при введении смеси S. aureus + S. lugdunensis IVK28 количество золотистого стафилококка через 5 дней значительно уменьшилось по сравнению со смесью S. aureus + S. lugdunensis IVK28ΔlugD. Этот эксперимент показал, что продукция лугдунина позволяет штамму IVK28 эффективно конкурировать с золотистым стафилококком in vivo.
Оставалось разобраться, предотвращает ли присутствие S. lugdunensis в носу человека колонизацию бактериями S. aureus. Ципперер и его коллеги исследовали мазки из носовых ходов 187 госпитализированных больных. Из них у 60 человек (32,1%) обнаружили золотистого стафилококка и у 17 человек (9,1%) — S. lugdunensis. И только у одного пациента с S. lugdunensis в носу обитал S. aureus. У всех выделенных штаммов S. lugdunensis ПЦР-анализ продемонстрировал наличие lug-оперона, а все обнаруженные штаммы S. aureus оказались восприимчивы к лугдунину.
Перспективы
Лугдунин оказался первым обнаруженным бактериоцином нового класса — макроциклических тиазолидиновых пептидных антибиотиков. Все проверенные штаммы S. aureus (как природные, так и лабораторные) не смогли выработать резистентности к нему. Это дает надежду на то, что лугдунин в будущем станет коммерческим препаратом для борьбы с золотистым стафилококком.
И наконец, сам факт обнаружения нового антибиотика у представителя человеческой микробиоты должен послужить стимулом для активизации поиска других продуцентов бактериоцинов в составе именно таких сообществ. В дальнейшем это поможет медикам успешнее сдерживать наступление мультирезистентных патогенов.
Читайте также:


