Дозировка гентамицина при стафилококке

Наиболее трудными для лечения являются инфекции, вызванные метициллинорезистентными штаммами S. aureus (MRSA) и S. epidermidis (MRSE), в частности инфекции области хирургического вмешательства после больших ортопедических операций. Распространенность штаммов MRSA в России высока. Несмотря на то, что по данным многоцентрового исследования в структуре бактериальных возбудителей нозокомиальных инфекций за 2011–2012 гг. доля S. aureus составила 16,7 %, что сопоставимо с данными 2006–2008 гг. (19,5 %), существенно увеличилась значимость метициллинорезистентных штаммов данного возбудителя. Доля MRSA составляла 33,4 % в 2001–2002 гг. и 55,4 % в 2006–2008 гг., возросла до 66,9 % к 2011–2012 гг. [5]. Выделение метициллинорезистентных штаммов S. aureus и S. epidermidis из гнойного очага при перипротезной инфекции является неблагоприятным прогностическим признаком для эффективности антибактериальной терапии и лечения в целом. В РФ до настоящего времени препаратом выбора при MRSA- и MRSE-ассоциированных инфекциях остаётся гликопептидный антибиотик ванкомицин. Однако в настоящее время в научной медицинской литературе многие авторы отмечают снижение эффективности ванкомицина при антибактериальной терапии инфекций, вызванных метициллинорезистентными стафилококками, in vitro демонстрирующими чувствительность к ванкомицину [9]. Это определяет необходимость применения эффективных комбинаций уже известных лекарственных средств разных классов, обладающих синергидным действием в отношении лекарственноустойчивых микробных возбудителей. К примеру, сохранившие активность рифампицин и фузидиевую кислоту для достижения хорошего антистафилококкового эффекта необходимо сочетать c β-лактамами или фторхинолонами [8]. Многие зарубежные исследователи предлагают широко использовать комбинированную антибактериальную терапию при лечении инфекции протезированного сустава стафилококковой этиологии для усиления бактерицидного эффекта, воздействия на микробные биопленки и на клетки бактерий, расположенные внутриклеточно [8].
Целью настоящего исследования было оценить in vitro активность комбинации гентамицина и диоксидина, обладающих принципиально различным механизмом антимикробного действия, в отношении штаммов метициллинорезистентных стафилококков.
Материалы и методы исследования
FIX = FIC (одного антибиотика) + + FIC (второго антибиотика),
где FIC (fractional inhibitory concentrations) – фракционная ингибирующая концентрация исследуемого антибиотика, определяемая как отношение величины минимальной подавляющей концентрации (МПК) этого антибиотика в комбинации с МПК второго антибиотика. Характера взаимодействия препаратов определяли по величине коэффициента FIX согласно шкале: 4 антагонизм.
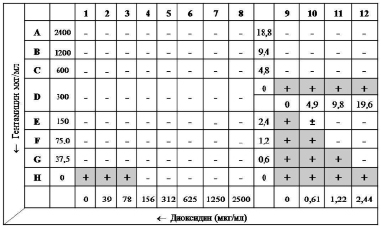
Технически метод осуществляли следующим образом: в каждую лунку 96-луночного планшета вносили по 50 мкл питательного бульона Мюллера-Хинтон (МХБ). Антимикробные препараты титровали серийно двукратно: гентамицин с концентрации 2400 до 0 мкг/мл (ряды A-H), диоксидин – с 2500 до 0 мкг/мл (колонки 1–12) (рис. 1).
Инокулюм каждой тест-культуры (0,5 McFarland) готовили в стерильном изотоническом растворе. В каждую лунку вносили по 100 мкл инокулюма и инкубировали планшет 18 ч при 37 °C. За МПК (в мкг/мл) принимали наименьшую концентрацию антимикробного средства, при которой не наблюдалось видимого роста микроорганизма. Далее для тестируемых штаммов S. aureus рассчитывали коэффициенты FIX. На основе значений фракционных коэффициентов FIC строили изоболограмму и оценивали ее характер.
Количественные результаты представлены в виде медиан, в качестве меры рассеивания использовали межквартильный интервал 25–75 % (МКИ 25–75 %).
Результаты исследования и их обсуждение
Установленные по результатам 3-х экспериментов медианы МПК (табл. 1) показали крайне невысокую активность диоксидина при воздействии как на штаммы устойчивые к метициллину (156 мкг/мл), так и чувствительные (39 мкг/мл). Кроме того, МПК гентамицина в отношении тестируемых изолятов MRSA также в 4 раза превысила МПК для чувствительных к метициллину референс-штаммов. Однако применение антимикробных препаратов в комбинации потребовало существенно меньших их концентраций для эффективного подавления возбудителей.
Медианы коэффициентов FIC и FIX взаимодействия гентамицина и диоксидина свидетельствуют (табл. 2) об эффективном действии изучаемой комбинации в отношении всех тестируемых культур стафилококков. Величина итоговых коэффициентов FIX во всех случаях не превысила 0,5 и составила для всех штаммов 0,09–0,26, что характерно для синергидного действия препаратов. Установлено, что, несмотря на выявленное синергидное действие в отношении метициллинорезистентных изолятов стафилококков устойчивых к гентамицину, коэффициент FIX для них был выше, чем для референс-штаммов, чувствительных к метициллину и гентамицину.
Кафедра госпитальной терапии лечебного факультета Новосибирского медицинского института
Изучали эффективность и безопасность цефтриаксона (Офрамакс, "Ранбакси", Индия), который назначали 2-4 г в сутки внутривенно в течение 4 недель в сочетании с гентамицином по 2-3 мг/кг массы тела в сутки каждые 8 часов внутримышечно в течение 2 недель с последующим наблюдением до 2 лет в условиях стационара и диспансера у 25 больных стафилококковым эндокардитом (СЭ). Возбудителями болезни были эпидермальный стафилококк - у 17, золотистый стафилококк - у 8 больных. Контроль за эффективностью лечения осуществляли в динамике. Критериями эффективности проводимой терапии служили исчезновение клинических симптомов, нормализация анализов крови, мочи, санация организма от возбудителя при контрольных бактериологических исследованиях крови. Излечение без хирургической коррекции наблюдали у 68% больных, излечение с замещением клапана - у 24%, летальный исход от бактериально-токсического шока - у 8%. Рецидивы СЭ зафиксированы у 28% больных спустя 3 месяца и более после лечения цефтриаксоном. 10 (40%) больных с выраженным клинико-лабораторным улучшением были выписаны из стационара через 2 (4 больных) и 3 (6 больных) недели после начала лечения для окончания лечения цефтриаксоном в амбулаторных условиях. Из побочных действий отмечали тошноту у 2 больных. Таким образом, проведенные комплексные клинико-лабораторные исследования показали, что комбинированное применение цефтриаксона с гентамицином было эффективным и безопасным в лечении СЭ. Цефтриаксон может быть представлен в качестве базового препарата в лечении СЭ. У части больных СЭ завершение лечения цефтриаксоном может осуществляться амбулаторно.
Цель работы - определить эффективность и безопасность цефтриаксона при стафилококковом эндокардите (СЭ).
Цефтриаксон (Офрамакс, "Ранбакси", Индия) назначали по 2-4 г в сутки внутривенно в течение 4 недель в сочетании с гентамицином по 2-3 мг/кг массы тела в сутки каждые 8 часов внутримышечно в течение 2 недель с последующим наблюдением до 2 лет в условиях стационара и диспансера.
Контроль за эффективностью лечения осуществляли в динамике (до начала, еженедельно и после окончания химиотерапии). Наряду с клинической оценкой исследовали показатели крови, мочи, NBT-тест, проводили биохимические, бактериологические исследования, эхокардиографию.
Критериями эффективности проводимой терапии служили исчезновение клинических симптомов заболевания, нормализация анализов крови, мочи, санация организма от возбудители при контрольных бактериологических исследованиях крови.
Таким образом, СЭ у большинства больных имел тяжелое течение с выраженной активностью, разным характером поражения сердца и полиорганным вовлечением внутренних органов в патологический процесс.
Результаты лечения СЭ цефтриаксоном были следующие: излечение без хирургической коррекции - у 17 (68%) больных, излечение с замещением клапана - у 6 (24%), летальный исход от бактериально-токсического шока - у 2 (8%). Рецидивы ИЭ наблюдали у 7 (28%) больных спустя 3 месяца и более после лечения цефтриаксоном. 10 (40%) больных с выраженным клинико-лабораторным улучшением были выписаны из стационара через 2 (4 больных) и 3 (6 больных) недели после начала лечения для окончания терапии цефтриаксоном в амбулаторных условиях.
Переносимость цефтриаксона у большинства больных была хорошей. Из побочных действий отмечали тошноту у 2 (8%) больных.
Приводим пример эффективного применения цефтриаксона.
Больной П., 35 лет, поступил в клинику с жалобами на лихорадку, боли в левом лучезапястном суставе, общую слабость, головную боль. За неделю до госпитализации поднялась температура до 40,5њС с потрясающим ознобом и проливным потом. Не лечился. Госпитализирован в экстренном порядке в неврологическое отделение, выявлен легкий левосторонний гемипарез , выраженный энцефалопатический синдром . Проводимое лечение по поводу возможного менингита , энцефалита было неэффективно. Через три дня переведен в кардиологическое отделение клиники. Состояние тяжелое, больной в сознании, эйфоричен. Кожные покровы бледные, с землистым оттенком. На коже туловища и конечностей серозно-геморрагическая некротическая сыпь. Подногтевые линейные геморрагии, пятна Лукина. Левый лучезапястный сустав несколько увеличен в объеме, кожа над ним гиперемирована, движения ограничены, резко болезненны. Легкие: дыхание везикулярное, хрипов нет, частота дыхательных движений 14 в минуту. Отмечается выраженная пульсация сонных артерий. Верхушечный толчок в VI межреберье. Левая граница сердца на 2 см кнаружи от среднеключичной линии. Грубый систолический шум с эпицентром над аортой, систолический шум - над верхушкой. Артериальное давление 110/40 мм рт. ст., пульс 100 в минуту, ритмичный, высокий. Печень выступает на 1 см из-под края реберной дуги, плотноэластичная, безболезненная, размеры по Курлову 9/1x8x7 см. Пальпируется безболезненная селезенка размером 15x8 см.Периферических отеков нет. Отклонений в неврологическом статусе не обнаружено. Кровь: Эр. 2,5x10 12 /л, Нв-70 г/л, Ц.п. 0,9, ретикул. 0,4%, лейк. 10,2x10 9 /л, п - 16, с - 77,л - 7, токсическая зернистость нейтрофилов +++, тр. - 156x10 9 /л, СОЭ - 42 мм/ч, сиаловые кислоты 310 усл. ед., СРБ 3 мм, сулемовая проба 1,6 мл, фибриноген 6,6 г/л, спонтанная агрегация тромбоцитов в ГАТ, умеренная гиперкоагуляция по АКТ, тест склеивания стафилококков, ортофенантролиновый тест отрицательный. Посевы крови на стерильность дали рост Staphylococcus aureus . Моча: уд. вес 1019, белок 0,99 г/л, лейк. 8-10 в п/зр, эр. выщелоч. 2-3 в п/зр., цилиндры: гиал. 1-2 в п/зр., зерн. 3-5 в п/зр., эпител. пл. 1-2 в п/зр., переходный 1-2 в п/зр. При осмотре глазного дна выявлены пятна Рота . При эхокардиографическом исследовании отмечается умеренная дилатация левых отделов сердца, преимущественно левого желудочка, перфорация некоронарной створки аортального клапана, аортальная регургитация III ст. Компьютерная томография головного мозга: справа, начиная с базальных отделов и распространяясь до темени, в височной области определяется зона гомогенного понижения плотности мозгового вещества, с четкими контурами, размером 5x6 см. Слева - такая же зона размером 2x4 см на двух срезах. Смещения средних структур нет. Третий и боковые желудочки умеренно симметрично расширены. Заключение: двусторонние ишемические очаги, симметричная гидроцефалия . Клинический диагноз: первичный инфекционный эндокардит, острое течение, III ст. активности. Аортальная недостаточность III стадии. Н II А стадии. Нефрит . Гепатит. Анемия. Артрит . Тромбогеморрагический синдром с поражением головного мозга, кожи, конъюнктив.
Лечение включало цефтриаксон по 4 г/сут, внутривенно в течение 4 недель, гентамицин по 240 мг/сут, внутримышечно в течение 2 недель, индометацин 150 мг/сут, тиклопедин 500 мг/сут, свежезамороженную плазму по 300-400 мл внутривенно струйно N 4 . Получен положительный клинико-лабораторный эффект: температура стойко нормализовалась, исчезли ознобы, поты, проявления тромбогеморрагического синдрома, признаки лабораторной активности снизились до I степени. Больной направлен в кардиохирургическую клинику для коррекции аортального клапана. Во время операции отмечено, что створки аортального клапана истончены, разрушены, на концах створок - микробные вегетации, из которых при бактериологическом исследовании выделен S.aureus. Выполнена операция протезирования аортального клапана (ЭМИКС-25). Послеоперационный период протекал без осложнений, выписан в удовлетворительном состоянии. При контрольном осмотре через год больной чувствует себя удовлетворительно, признаков активного инфекционного эндокардита по клинико-лабораторным и инструментальным методам обследования нет.
Таким образом, данное наблюдение является примером первичной формы СЭ, который протекал с высокой степенью активности. Тромбогеморрагический синдром с поражением головного мозга был дебютом болезни и явился причиной ошибочной госпитализации в неврологическое отделение. Выявление сердечного шума, вегетаций на аортальном клапане, стафилококка при бактериологическом исследовании крови позволили верифицировать диагноз. Антибактериальная терапия цефтриаксоном, гентамицином и хирургическая коррекция порока способствовали выздоровлению от инфекционного эндокардита.
Беталактамные антибиотики - пенициллины и цефалоспорины - дольше всех применяются в клинической практике, поэтому проблема резистентности к ним наиболее серьезна. Образование бета-лактамаз - наиболее частый путь развития резистентности возбудителей к беталактамным антибиотикам [1]. Бета-лактамазы присутствуют в качестве экзоферментов в стафилококках и в периплазматическом пространстве аэробных и анаэробных штаммов грамотрицательных бактерий. Эти ферменты разрушают амидную связь в бета-лактамном кольце беталактамных антибиотиков, что в клинике проявляется отсутствием результата лечения 4.
Бактериальные бета-лактамазы играют клинически важную роль в ряде инфекций, таких как отит , пневмония , менингит, сепсис. Поэтому клиническое применение многих беталактамных антибиотиков при этих болезнях ограничено. Одним из вариантов решения проблемы бета-лактамазной резистентности является поиск новых беталактамных антибиотиков, которые не подвержены гидролизу под действием бета-лактамаз (новые цефалоспорины, тиенамицины, монобактамы ).
Цефтриаксон - полусинтетический цефалоспориноый антибиотик широкого спектра действия, обладающий высокой устойчивостью к действию бета-лактамаз. Спектр его бактерицидной активности включает многие грамположительные и грамотрицательные микрооргнизмы, в том числе устойчивые к другим цефалоспоринам и аминогликозидам . Связывание цефтриаксона с плазменными белками составляет 58-95%, период полувыведения из плазмы взрослых - около 8 ч, что позволяет применять его 1 раз в сутки. При внутривенном и внутримышечном введении антибиотик быстро проникает в тканевую жидкость, где в течение 24 ч поддерживается в бактерицидной концентрации. Цефтриаксон выводится в неизмененной активной форме почками (60-70%) и печенью (30-40%). При почечной недостаточности увеличивается выведение цефтриаксона с желчью, а у больных с нарушением функции печени - почками [5]. Только при одновременном тяжелом нарушении функции почек и печени происходит кумуляция препарата в организме. Цефтриаксон применяют при инфекционных заболеваниях брюшной полости, дыхательных путей, мочеполовых органов, костей, суставов, мягких тканей, ЛОР-органов, сепсисе , менингите, у больных со сниженной иммунологической защитой организма. Его назначают по 1-2 г один раз в сутки внутривенно или внутримышечно. В тяжелых случаях суточную дозу можно повысить до 4 г. Длительность лечения зависит от тяжести инфекции. Побочные эффекты цефтриаксона те же, что и других цефалоспоринов.
Цефтриаксон получил положительную оценку как препарат выбора при стафилококковом сепсисе, менингите, стрептококковом эндокардите 8. Вопрос о длительности терапии ИЭ цефтриаксоном решается по-разному [8].
Проведенные нами комплексные клинико-лабораторные исследования показали, что комбинированное применение цефтриаксона и гентамицина является эффективным и безопасным при лечении СЭ. Цефтриаксон может быть представлен в качестве базового препарата в лечение СЭ. Фармакокинетические свойства цефтриаксона, позволяющие применять препарат один раз в сутки, обеспечивает значительные организационные и экономические преимущества. Завершение лечения цефтриаксоном может осуществляться амбулаторно.
АНТИБИОТИКИ И ХИМИОТЕРАПИЯ, 1998-N6, стр. 12-15.
2. Greenwood D. Rev Infect Dis 1986; 8: Suppl 5: 478-485.
3. Hamilton-Miller J.M.T. J Antimicrob Chemother 1982; 9: Suppl B: 9-11.
4. Neu H.C. 6th Mediterr Congr Chemother Taormina 1988; Abstr: 17.
5. Cohen D. et al. Antimicrob Agents Chemother 1983; Oct: 529.
6. Хелл К., Мендхем Н.А., Хаддад В.Г. Мат науч-практ конф. Новосибирск 1996; 20-28.
7. Яковлев В.П., Яковлев С.В. Антибиотики и химиотер 1996; 1: 27-44.
8. Francioli P., Etienne J., Hoigne R. et al. JAMA 1992; 264-267.
Рекомендации Американской ассоциации кардиологов
*- Возможно применение стрептомицина.
Пенициллин вводят в дозах 20-40 млн ЕД в день, гентамицин - 2-2,5 мг/кг каждые о часов, ванкомицин - 40 мг/кг/сут в 2-3 приема равными частями через 6-8 часов. В процессе лечения желательно динамическое определение концентраций гентамицина и ванкомицина в плазме крови.
При лечении эндокардита, вызванного стрептококком, также эффективны цефалоспорины, ванкомицин, тейкопланин, имипенем и хлорамфеникол
Если чувствительность к эритромицину, клиндамицину и тетрациклинам варьирует, то к котримоксазолу большинство штаммов резистентны. Другие виды негемолитического стрептококка в половине случаев резистентны к пенициллинам и аминогликозидам, однако комбинированное применение таких препаратов позволяет преодолеть эту рези-стентность.
Когда выделяется стрептококк, МПК которого составляет 5 мкг/мл и ниже, применяют ванкомицин, а при выделении изолятов, где МПК 5 мкг/мл и более, добавляют гентамицин.
Если при септицемии, менингите и других серьезных осложнениях выявлены пенициллинчувствительные штаммы, целесообразно применение пенициллина в комбинации с гентамицином.
При аллергии к пенициллину или высокой степени резистентности к нему бактерий используют ванкомицин и при возможности - тейкопланин. Пенициллин целесообразно применять, если выделяют бычий стрептококк (S. Bovis), чувствительный к этому препарату (МПК 0,1 мкг/мл и ниже). При отсутствии эффекта и персистирующей инфекции, эмболических осложнениях, прогрессировании сердечной недостаточности прибегают к хирургическому лечению.
СТАФИЛОКОККОВЫЙ ЭНДОКАРДИТ редко развивается у детей, но у взрослых часто становится причиной заболевания. Первичным фокусом, где локализуется возбудитель, могут быть фурункулы, фолликулиты, воспалительные очаги в респираторном тракте, послеоперационных тканях, мочевых путях и т. д.
Бактериемия
Мочевые пути и др.
Кости и др.
Предрасполагают к развитию стафилококковой инфекции пожилой возраст, кардиоваскулярные заболевания, предшествующая госпитализация, рак, хирургические вмешательства и гемодиализ, сахарный диабет.
различные дерматиты, инфекции кожи, ожоги, пролежни, бактериемия, в/в инъекции, в том числе наркотических средств, длительная катетеризация крупных сосудов, гемодиализ и перитонеальный диализ.
СТАФИЛОКОККОВАЯ ИНФЕКЦИЯ КОЖИ и ее придатков - одна из наиболее частых причин эндокардита. Колонизация кожи наблюдается при таких заболеваниях, как экзема, варицелла, чесотка. При атопическом дерматите золотистый стафилококк выявляется у 80% пациентов, при неатопической экземе - у 50% и лишь у 3% людей со здоровой кожей.
При вторичной инфицированной экземе в 90% случаев выделяется пенициллин / ампициллинрезистентный стафилококк, в 14% - метициллинрезистентный и в 16% - устойчивый к эритромицину и тетрациклину. Риск возникновения стафилококкового поражения кожи значительно повышен у больных сахарным диабетом, особенно при недостаточном контроле за уровнем сахара в крови. Такие тяжелые осложнения сахарного диабета, как гангрена, абсцесс, некротизирующий фасциит, ассоциирующиеся с полимикробной флорой, всегда сочетаются со стафилококковой инфекцией.
Золотистый стафилококк выявляется также у 25% больных с ОЖОГАМИ КОЖИ, причем в большинстве случаев речь идет о метициллинрезистентном возбудителе. Коагулазонегативные стафилококки обнаруживают у 4% ожоговых больных, энтерококки - в 12%, сине-гнойную палочку-в19%, энтеробактерии+серрации-в 14% случаев, Следует отметить, что частота и вид выделяемых возбудителей эндокардита соответствуют высеваемой флоре рук и носоглотки обслуживающего персонала (золотистый стафилококк, в том числе MRSA), а также присутствующей на ожоговой ткани и в желудочно-кишечном тракте больного.
Источником инфекции могут стать, наконец, ПРОЛЕЖНИ. Причем в этих случаях выделяется полимикробная флора: грамотрицательные бактерии, золотистый стафилококк, штаммы энтерококков и анаэробы (Bacterioidesfragilis).
У больных, находящихся на ПРОГРАММНОМ ГЕМОДИАЛИЗЕ, нередко возникают эпизоды бактериемии, которые могут осложняться развитием эндокардита. У 40% таких больных источник бактериемии –
золотистый стафилококк. Развитию стафилококковой бактериемии способствует бактериальная обсемененность слизистой оболочки носа и кожи рук, причем выявляется идентичность стафилококков, выде-ляемых из крови и находящихся в носовых ходах и на коже рук.
Как показали наблюдения, риск возникновения бактериемии можно снизить с помощью местной назальной аппликации бацитрацина и назначением рифампицина внутрь до 600 мг в день. Однако следует учесть, что при приеме рифампицина довольно быстро появляются резистентные к нему штаммы стафилококка. Местное (в нос) применение мупироцина вызывает эррадикацию стафилококков в 90% случаев, его рекомендуют назначать 3 раза в неделю после сеанса гемодиализа. Добавление к мупироцину рифампицина существенно не повышает эффективность профилактических мероприятий, Перитонит, возникающий при перитонеальном диализе, вызывает;
ассоциация грамотрицательных бактерий с эпидермальным (в 50-70%) или золотистым стафилококком. И в этих случаях местное, в том числе назальное, применение мупироцина в комбинации с рифампицином внутрь оказывает явный клинический и микробиологический эффект.
СТАФИЛОККОКИ - наиболее частая причина бактериемии, ассоциированной с катетерами, причем в 70% случаев это эпидермаль-
ный стафилококк, Золотистый стафилококк выявляется гораздо реже (в 5-15%), в 1/з случаев обнаруживают грамотрицательные бактерии и редко - кандиды. Золотистый стафилококк и коагулазоне-гативные стафилококки, выделяемые у больных эндокардитом, как правило, резистентны к пенициллину, но могут быть чувствительны к оксациллину и другим пенициллиназоустройчивым полусинтетическим пенициллинам.
При выделении эпидермального и золотистого стафилококков, езистентных к полусинтетическим пенициллинам (метициллинили оксациллинрезистентные штаммы - MRSA), показаны ванкомицин в виде монотерапии или в комбинации с аминогликозидами. Комбинация ванкомицина с гентамицином дает более выраженный эффект из-за синергизма действия.
Золотистый стафилококк, в том числе MRSA, чувствительнее к другому гликопептидному антибиотику - тейкопланину, обладающему не только высокой антимикробной активностью, но и лучшими фармакокинетическими характеристиками и меньшим количеством побочных нефротоксических эффектов, чем ванкомицин.
ЭНТЕРОКОККИ выявляют у 15% взрослых больных эндокардитом и гораздо реже у детей. Чаще обнаруживают фекальный энтерококк. К возникновению инфекции предрасполагают бактериемии, связанные с вмешательствами в области желудочно-кишечного тракта или урогенитальными, длительной катетеризацией мочевого пузыря, особенно при осложненной мочевой инфекции, с интраабдоминальным абсцессом вследствие перфорации кишечника.
Особенность энтерококков - устойчивость к цефалоспоринам, умеренная к полусинтетическим пенициллинам, клиндамицину, макролидам, хлорамфениколу, тетрациклинам. Все энтерококки обладают умеренной резистентностью к аминогликозидам, что связано, по-видимому, с низкой проницаемостью бактериальной оболочки для этих антибиотиков. Бата-лактамы и гликопептиды повышают ее проницаемость.
Чувствительность фекального энтерококка (Е. faecalis) к ампицил-лину в 2 раза превышает таковую к пенициллину, достаточно высока к пиперациллину, имипенему. К бета-лактамам эти энтерококки резистентны.
Наибольшей активностью против штаммов Е. faecalis и Е. faecium обладают ванкомицин и тейкопланин.
Большинство штаммов энтерококков сохраняют чувствительность и к гентамицину. Комбинация ампициллина с ингибиторами бета-лактамаз
увеличивает активность ампициллина против энтерококка.
Обычно лечение начинают с в/в введения ампициплина до 20 г в день (ампициллин + сулбактам или амоксициллин + клавулановая кислота) в комбинации с гентамицином - 240 мг в день е течение 4-5 недель. При аллергии к пенициллину следует вводить в/в ванкомицин по 0,5 г 4 раза в день вместе с гентамицином по 80 мг 3 раза в день.
Случаи резистентности к ванкомицину - редкое явление, а при высокой резистентности к гентамицину (МПК свыше 2000 мкг/мл) консервативное лечение становится бесперспективным - требуется хирургическая замена клапана.
ПНЕВМОКОККИ, ГОНОКОККИ И МЕНИНГОКОККИ. В случае переносимости пенициллина и чувствительности к нему микрофлоры этот препарат является лекарством выбора s дозировке 10-20 млн ЕД в день в/м в течение 4 недель.
ГЕМОФИЛЬНАЯ ПАЛОЧКА. Эндокардит, вызванный этим возбудителем, лечат комбинацией аминогликозидов (гентамицин 4,5-5,0 мг/кг в день через каждые 8 часов в/в или в/м) с ампициллином (200-300 мг/кг в день в/в или в/м). Длительность лечения - 6-8 недель.
ЭНТЕРОБАКТЕРИИ. При лечении эндокардита, обусловленного гра-мотрицательными бактериями, обычно используют комбинацию пипе-рациллина с аминогликозидами (гентамицин 4,5-5,0 мг/кг в день) в течение 6 недель или цефалоспорины 2-й или 4-й группы (цефамандол. цефуроксим, цефепим).
ГРИБКОВОЕ ПОРАЖЕНИЕ ЭНДОКАРДА. Чаще всего вызывают грибы видов Candida и Aspergillus. В подавляющем большинстве случаев поражены правые отделы сердца и чаще всего трехстворчатый клапан. Грибковый эндокардит плохо поддается консервативному лечению. В этом случае обычно требуется оперативное удаление клапана во избежание диссеминации грибковых тромбоэмболов. Из лекарственных средств применяют амфотерицин В в комбинации либо с флу-цитозином, либо с флуконазолом.
Основными средствами патогенетической терапии инфекции мочевыводящих путей до сегодняшнего дня остаются уросептики. Важнейшим путем повышения эффективности лечения является не только создание и внедрение новых уроантисептиков, но и совершенствование тактики применения уже имеющихся средств. Препараты, которые относят к уросептикам, сведены в табл. 1.
|
Проблема оптимального выбора уросептика при лечении конкретного больного диктует необходимость ответа на многие вопросы. Прежде всего необходимо выяснить локализацию инфекции мочевыводящих путей, определить вид возбудителя и его чувствительность к выбранному уросептику, остроту воспалительного процесса, функциональное состояние почек. Кроме того, необходимо иметь четкое представление о фармакокинетике и фармакодинамике препарата.
Только после ответа на эти вопросы выбор препарата становится действительно оптимальным.
Говоря о локализации инфекции, нельзя забывать, что даже у одного и того же больного может быть разная микрофлора в паренхиме почек и в мочевыводящих путях.
Как правило, на ранних стадиях заболевания выявляется моноинфекция, при более длительном течении процесса, в случае неадекватной антибактериальной терапии, появляются микробные ассоциации, включающие до двух и трех видов возбудителей, часто как грамотрицательных, так и грамположительных.
Наиболее частыми возбудителями являются кишечная палочка и энтерококки (т. е. облигатная флора кишечника), а также гемолитический вариант кишечной палочки, протей, синегнойная палочка, золотистый стафилококк, клебсиелла. При этом ассоциации различных видов возбудителей при пиелонефрите встречаются в 20—45,5% случаев. Примерно в 15% случаев хронического пиелонефрита не удается выявить возбудителя обычным способом ни в посевах мочи, ни в посевах почечной ткани. Возбудители, трансформировавшиеся в лишенные клеточных стенок формы (L-формы), и микоплазмы требуют для своего выявления сложных диагностических сред и методик.
Идентификация возбудителя позволяет выбрать наиболее эффективный уросептик. В настоящее время существуют четкие рекомендации по выбору уросептика в зависимости от возбудителя, и в литературе информации по этому вопросу достаточно много. В ситуациях, когда нельзя ожидать результатов посева мочи и чувствительности флоры, могут применяться стандартизированные схемы антибактериальной терапии. Например, возможно применение гентамицина, при необходимости в комбинации с цефалоспоринами, или сочетание карбенициллина (пиопена) с налидиксовой кислотой, колимицина с налидиксовой кислотой.
В настоящее время при тяжелых формах урологической инфекции — пиелонефрите, уросепсисе, при устойчивости к другим классам антимикробных веществ, при наличии полирезистентных штаммов бактерий — рекомендуется применять антибиотики группы фторхинолонов.
При необходимости проведения терапии уросептиками длительно, со сменой препаратов каждые 7-10 дней, целесообразно последовательно применять препараты, действующие на бактериальную стенку и на метаболизм бактериальной клетки. Рекомендуется последовательное применение пенициллина и эритромицина, цефалоспоринов и левомицетина, цефалоспоринов и нитрофуранов для предупреждения выживания протопластных и L-форм бактерий.
Все перечисленные группы уросептиков хорошо проникают в ткани мочеполовой системы и мочу, где создаются достаточные для получения терапевтического эффекта концентрации. В то же время проверка выделительной функции почек обязательна в каждом случае. При выраженных склеротических изменениях и поражении клубочкового аппарата почек успех лечения уменьшается, а при снижении клубочковой фильтрации до 30 мл/мин проводить антибактериальную терапию нет смысла, т. к. невозможно получить терапевтическую лечебную концентрацию препаратов в почечной паренхиме. Кроме того, резко возрастает опасность развития токсических эффектов. Снижение функциональной способности почек заставляет обращать особое внимание на нефротоксичность применяемых средств.
Практически не оказывают нефротоксического действия фторхинолоны, оксациллин, метициллин, карбенициллин из группы пенициллинов, макролиды, цефалоспорины, левомицетин.
Незначительной нефротоксичностью обладают ампициллин, линкомицин, нитрофураны, налидиксовая кислота, некоторые сульфаниламиды пролонгированного действия. При наличии почечной недостаточности нефротоксичными становятся тетрациклины. Всегда высоко нефротоксичны аминогликозиды (гентамицин, стрептомицин, торбамицин, канамицин).
Нефротоксические эффекты препаратов усиливаются при выраженной дегидратации и при одновременном приеме диуретических средств.
Одним из важнейших критериев выбора препарата является рН мочи. Максимальную эффективность в щелочной среде при рН = 7,5—9,0 проявляют аминогликозиды и макролиды, по мере снижения рН мочи их активность снижается. Не зависит от рН мочи эффективность цефалоспоринов, фторхинолонов, гликопротеидов, тетрациклинов, левомицетина. В кислой среде при рН ≤ 5,5 наиболее эффективны пенициллины, производные нафтиридина, нитрофурана, хинолона, 8-оксихинолона, метепамин. Все эти препараты значительно снижают свою активность по мере ощелачивания среды.
С целью повышения щелочности мочи возможно назначение молочно-растительной диеты, бикарбоната натрия. Для снижения рН мочи (ее подкисления) увеличивают потребление хлеба и мучных изделий, мяса и яиц. Назначают аммония хлорид, аскорбиновую кислоту, метионин, гиппуровую кислоту (которая содержится, например, в соке клюквы). Любое вещество, снижающее рН мочи ниже 5,5, тормозит развитие бактерий в моче.
При наличии микробных ассоциаций возможно использование сочетания двух уросептиков.
Хорошую совместимость с большинством антимикробных препаратов и отсутствие нежелательных реакций при комбинированной антибактериальной терапии имеют фторхинолоны.
β-лактамы (пенициллины, цефалоспорины), аминогликозиды и полипептиды обладают синергизмом действия, их можно сочетать при тяжелых формах инфекции. При этом все перечисленные группы антибиотиков при взаимодействии с тетрациклинами, макролидами, линкомицином проявляют антагонизм.
Левомицетин, тетрациклины и макролиды при совместном назначении проявляют индифферентность. Нитрофурантоин ослабляет действие налидиксовой кислоты. Считается нецелесообразным назначать следующие сочетания: фурагина с левомицетином, фурагина с сульфаниламидами, левомицетина с сульфаниламидами, метенамина с сульфаниламидами.
Как выбор комбинации препаратов, так и необходимая длительность курсовой терапии и путь введения препаратов зависят от локализации инфекции, остроты процесса, возбудителя.
Дозы препаратов для курсовой терапии приведены в табл. 2. При проведении лечения следует помнить, что к некоторым препаратам развивается резистентность микроорганизмов. Особенно это надо учитывать, если необходима интермиттирующая терапия. Предпочтение следует отдавать препаратам, к которым резистентность развивается относительно медленно: это фторхинолоны, ампициллин, левомицетин, депо-сульфаниламиды. Особенно медленно вырабатывается резистентность к фурагину, поэтому этот препарат является важнейшим при проведении длительного интермиттирующего лечения.
Довольно быстро и часто развивается резистентность микроорганизмов к налидиксовой кислоте, оксолиновой кислоте, тетрациклинам, стрептомицину, цефалоспоринам.
Учитывая сказанное, всегда следует выяснять, какие препараты использовались в проводившейся ранее терапии, и оценивать степень их эффективности.
Необходимо также уточнять побочные действия, имевшие место на фоне ранее проводившейся терапии, и принимать во внимание возможность их возникновения на фоне проводимого лечения.
Все вышеизложенное указывает на то, что даже при наличии массы рекомендательной литературы с большим количеством различных схем терапии — подход к лечению инфекции мочевыводящих путей не может быть механическим и требует индивидуального выбора тактики терапии для каждого конкретного больного.
Читайте также:


