Чувствительность к новобиоцину у стафилококков
Материал для исследования – гной, кровь, мокрота, моча.
Бактериоскопический метод имеет ориентировочное значение. Выявляют грамположительные кокки, расположенные в виде гроздей, что позволяет выбрать необходимые питательные среды.
Бактериологический метод – выделение чистой культуры и ее идентификация. Материал засевают на МЖСА или ЖСА и кровяной агар. Проводят учет лецитиназы, пигмента, гемолиза.
C колониями бактерий, выросших на МЖСА, проводят каталазный тест. Это позволяет отдифференцировать семейство Staphylococcaceae от семейства Streptococcaeae; так у стафилококков каталаза имеется, а у стрептококков отсутствует.
Устанавливают принадлежность бактерий к роду Staphylococcus. Стафилококки образуют пигмент, являются факультативными анаэробами, а микрококки – облигатные аэробы. Поэтому стафилококки способны расти и ферментировать глюкозу в анаэробных условиях (отмечается изменение цвета в столбике среды под слоем вазелинового масла). Также стафилококки способны окислять глицерин.
Установив принадлежность к роду Staphyloccocus, проводят видовую идентификацию стафилококков. Ведущий тест S.aureus – продукция плазмокоагулазы. Проводят посев культуры в цитратную плазму крови кролика. Отмечается коагуляция плазмы через 2-18 часов. При положительной реакции плазмокоагуляции, лецитиназной, гемолитической активности, золотистого пигмента штамм может быть отнесен к виду S.aureus.
При отрицательной реакции плазмокоагуляции ставят дополнительные тесты на наличие ДНКазы, ферментацию манита в анаэробных условиях, чувствительность к новобиоцину, определяют фосфатазу.
Для S. epidermidis характерны следующие тесты: чувствительность к новобиоцину, наличие фосфатазы, отсутствие окисления маннита; для S. saprophyticus – противоположные свойства.
Данные биохимической дифференциации стафилококков приведены в таблицах.
Биохимическая идентификация рода Staphyloccocus
| Микроорганизм | Плазмо-коагулаза | Ферментация маннита | Гемолиз | Летитиназа | Лмзоцимная активность | Определение ДНКазы | |
| аэробно | анаэробно | ||||||
| S. aureus | + | + | + | + | + | + | + |
| S.epidermidis | - | +/- | - | +/- | - | - | - |
| S.saprophyticus | - | +/- | - | - | - | - | - |
Дифференциация стафилококков и микрококков
| Свойства | Стафилококки | Микрококки |
| Размеры клеток | До 1 мкм | 0,5-2 мкм |
| Окраска колоний | От золотистого до белого | От белого до розово-красного, оранжевого |
| Ферментация глюкозы в анаэробных условиях | + | + |
| Гемолиз | + | - |
| Окисление глицерина | + | - |
Дифференциальные признаки S.epidermidis и S.saprophyticus
| Группа | Устойчивость к новобицину | Фосфатаза | Окисление маннита |
| S.epidermidis | - | + | - |
| S.saprophyticus | + | - | + |
Далее проводят определение чувствительности к антибиотикам. Для выявления метициллин-резистентных стафилококков выполняют диско-диффузионный метод с антибиотиками оксациллином или цефокситином.
Более предпочтительным способом является идентификация MRSA методом ПЦР с определением гена mec2a
С целью эпидемиологического типирования изучают плазмидный профиль S.aureus: большие 2•10 7 Да плазмиды кодируют образование бета-лактамаз и резистентность к эритромицину. Мелкие (3•10 6 Да) плазмиды кодируют резистентность к тетрациклинам и хлорамфениколу.
При необходимости по эпидпоказаниям осуществляют фаготипирование.
Заключение об этиологической роли стафилококков делают на основании многократного обильного выделения однотипных по свойствам и фаготипу стафилококков.
Выделенная культура считается возбудителем инфекционного процесса при наличии следующих критериев: если из закрытых очагов, выделен один вид микроорганизма в количестве 10 3 и более; при открытых процессах этиологически значимыми считают культуры, численность которых более 10 5 . Лабораторный анализ непременно включает определение чувствительности выделенных бактерий к антибиотикам.
Серологическая диагностика стафилококковой инфекции в настоящее время не практически используется. Для оценки состояния антитоксического иммунитета у больных определяют уровень антитоксических антител по лизису эритроцитов крови альфа-токсином. Ранее методом ИФА определялись антитела к тейхоевым кислотам различных видов стафилококков.
Дата добавления: 2015-04-16 ; просмотров: 1071 . Нарушение авторских прав
Аннотация научной статьи по биологическим наукам, автор научной работы — Бочев И., Русенова Н.
В эксперименте от коз с субклиническим маститом чаще удавалось выделять коагулазонегативные, чем коагулазопозитивные стафилококки (в 80,2 и 19,8 % случаев соответственно). 15,6 % изолятов первых и 15,8 % изолятов вторых оказались устойчивыми к метициллину. Резистентные к метициллину штаммы коагулазонегатиных стафилококков наиболее часто (почти в 50 % случаев) демонстрировали резистентность к пенициллину, амоксициллину и налидиксовой кислоте, в то время как аналогичные штаммы коагулазонегативных стафилококков только к налидиксовой кислоте. Мультирезистентность коагулазонегативных стафилококков в большинстве случаев (в 83,3 % у резистентных к метициллину штаммов и в 26,2 % у чувствительных к этому антибиотику штаммов) проявлялась одновременной устойчивостью к пенициллину и амоксициллину.
Похожие темы научных работ по биологическим наукам , автор научной работы — Бочев И., Русенова Н.
160 cases of subclinical mastitis were detected in a study on 478 goats from 6 herds in Southeastern Bulgaria. From positive milk samples, 96 Staphylococcus spp. strains were isolated. Nineteen isolates were determined as Staphylococcus aureus (19,8 %), and the other 77 (80,2 %) as coagulase-negative staphylococci. The sensitivity of all strains to 13 chemotherapeutics was tested through the disk diffusion method of Bauer-Kirby. Via the oxacillin agar screening test, 15 strains (15,6 %) were determined as methicillin-resistant: out of them 12 isolates or 80 % were coagulase-negative (MRCNS) and only 3 isolates (20 %) -methicillin-resistant Staphylococcus aureus (MRSA). The cumulative curves of resistance were drawn and their profiles were analysed. The patterns of resistance of MRCNS and methicillin-sensitive coagulase-negative staphylococci (MSCNS) were determined. The results showed that the percentage of resistance of MRCNS to A lactams (75 % to penicillin, 83,3 % to amoxycillin), macrolides (41,7 % to erythromycin), lincomycin (33,3 %) and novobiocin (50 %) was higher compared to the respective percentages in MSCNS. Bulg. J. Vet. Med., 2005, 8, No 2, 109-118.
Резистентность штаммов Staphylococcus spp., изолированных от коз с субклиническим маститом
И. Бочев, Н. Русенова, Тракийский университет, г. Стара Загора (Болгария)
Ключевые слова: антибиотикорезистентность, коза, стафилококки
Сокращения: ЗИМР - зона ингибиции микробного роста; СКн -коагулазонегативные стафилококки; Скп - коагулазозитивные стафилококки; ШРМ - резистентные к метициллину штаммы; Шчм - чувствительные к метициллину штаммы
В Болгарии в последние годы козоводство развивается все более интенсивно, чему способствуют благоприятные географические условия и экономические преимущества выращивания этого вида животных по сравнению с овцами и крупным рогатым скотом. Одновременно возрастает значение патологий молочной железы коз, особенно мастита. Чтобы профилактика и этиотропная терапия этих болезней были эффективными, необходимы точный бактериологический диагноз и определение чувствительности выделенных микроорганизмов к различным антимикробным препаратам [3, 5, 16].
Роль стафилококков как возбудителей болезней людей и животных возрастает из-за повсеместного распространения этих бактерий, роста их резистентности и мультирезистент-ности к антимикробным препаратам, а также высокой летальности при вызываемых ими заболеваниях. Первоначально возникла проблема с ШРМ Скп (Staph, aureus), а затем с Шрм Скн [23].
Недавно проведенные исследования выявили повышение этиологической роли Скн при субклинических маститах 113, 15, 18, 20, 21]. ШРМ Скн изолировали от коров и овец с клиническим и субклиническим маститом [9, 12, 19], а также цыплят [14]. Инфекции, вызванные ШРМ стафилококков (в т.ч. Скн), невозможно эффективно лечить [3-лактамовыми антибиотиками [17].
Сообщали об обнаружении ШРМ в Болгарии в мясе и молочных продуктах [2], а также молоке коров с субклиническим маститом [24]. Несмотря на увеличение поголовья коз в нашей стране, исследований по распространению среди них ШРМ ранее не предпринимали.
Цель работы состояла в проведении бактериологического исследования при субклиническом мастите коз и анализе его результатов с этиологической и этиотронной позиций. Изоляция ШрМ стафилококков — важный этап изучения эпизоотической ситуации и оценки чувствительности этих бактерий к применяемым антимикробным препаратам.
Материалы и методы
Взятие и анализ проб. Провели предварительное обследование в Калифорнийском маститном тесте (Kruuse, Дания) 478 коз 6 стад из юго-восточных районов Болгарии на субклинический мастит. Перед взятием проб молока вымя животных осматривали и пальпировали на наличие патологических изменений. В тех случаях, когда последние отсутствовали, но маститный тест дал положительный результат, у коз асептично брали пробы молока во флаконы объемом 10 мл. Пробы хранили при температуре 4 °С в течение срока, не превышавшего 2 ч. Из них делали посевы на 3 агаровые сре-
ды (содержавшую 5% дефибринпрованной крови овцы, ман-нито-солевую и МакКонки). Посевы инкубировали 24. 48 ч в аэробных условиях при 37°С. Наличие на среде более трех колоний одинаковой морфологии считали положительным результатом бактериологического исследования [10].
Идентификационные тесты. Рутинную идентификацию стафилококков осуществляли следующими тестами: ката-лазным (с 3% перекиси водорода), оксидазным и коагулаз-ным (наличие свободного фермента определяли в лиофили-зированной плазме крови кролика). Дополнительно тестировали изоляты на ДНК-азную, уреазную, щелочно-фосфатаз-ную активности, чувствительность к новобиоцину и бацитрацину, тест О/Т по оценке утилизации углеводов. Учитывали также гемолитические свойства стафилококков и пигментацию их колоний.
Тест проводили с дисками из фильтровальной бумаги, имевшими диаметр 6 мм и пропитанными антибиотиками в следующих количествах (в расчете на 1 диск): пенициллином (бмкг), амоксициллином (25 мкг), оксациллином (1мкг), амоксициллином в сочетании с клавулановой кислотой (30 мкг), гентамицином (10 мкг), амикацином (30 мкг), тетрациклином (30 мкг), эритромицином (15 мкг), линкомицином (15 мкг), налидиксовой кислотой (30 мкг), пефлоксацином (5 мкг), энрофлоксацнпом (5 мкг) и новобиоцином (5 мкг).
Резистентные к метициллину/оксациллину изоляты дополнительно высевали на агар Мюллер-Хинтона с 4% №0 и 6 мкг/мл оксациллина с последующей инкубацией при 35°С в течение 24. 48 ч.
Анализ резистентности к антимикробным препаратам
Изображение результатов в виде кумулятивных графиков. Кумулятивный процент ЗИМР разного диаметра получали сложением относительного количества изолятов, давших соответствующую и большую по диаметру ЗИМР. При построении графиков кумулятивный процент (ось У) сопоставляли с диаметром ЗИМР. Наклон графика рассчитывали по 6-степениому многочленному приближению экспериментальных данных. Уравнения регрессий и коэффициенты корреляций определяли с помощью тех же программ.
Определение амплитуды диаметра ЗИМР. Как и в случае минимальной ингибирующей концентрации антибиотиков, этот параметр определяли по разнице наибольшего и наименьшего диаметров ЗИМР соответствующих изолятов.
Определение ЗИМР50 и ЗИМР901. Из точки, в которой теоретически должна прерываться кривая графика 50% ЗИМР, опускают перпендикулярную линию на ось X. Обыч-
1 ЗИМРэд и ЗИМРдо - ЗИМР, которые дали не менее 50% и 90% изолятов соответственно.
но эта точка располагается между значениям]! двух соседних величин ЗИМР. По определению выбирали наименьший диаметр ЗИМР, поскольку не менее 50% выделенных изолятов имели ЗИМР такого или большего диаметра. Аналогично определяли ЗИМР90.
Оценка характера резистености изолятов к антимикробным препаратам. Определяли процент изолятов, проявивших резистентность к каждому и нескольким из тестированных антимикробных препаратов.
Статистический анализ. Методом альтернативного анализа [22] оценивали относительное количество ШРМ и Шчм СКн- Границы доверительных интервалов рассчитывали посредством тригонометрического преобразования уравнения ф = 2arcsin.vp, где р — относительная величина параметра в %. Максимальную ошибку ф (Д) определяли по формуле Д = t/Vn, где t — коэффициент, зависящий от выбранного доверительного уровня (в нашем случае он составлял 0,95, что соответствовало t = 1,98), а п выражало число ШРМ и Шчм СКц. Обе границы доверительных интервалов определяли по формулам ф1 = ф
Д и Д2 = ф + Д [22].
Результаты и обсуждение
Из 478 обследованных коз у 160 диагностировали субклинический мастит. В 96 (60%) случаев последнего изолировали стафилококки — 19 (19,8%) из них были Скп (Staph, aureus), а остальные 77 (80,2%) Скн.
Скрининг 96 изолятов на оксациллиновом агаре показал, что 15 (15,6%) из них устойчивы к данному антибиотику. 12 резистентных изолятов были Скн (15,6% всех Ски), а 3 изо-лята оказались СКц (15,8% всех Скп)-
Результаты проверки чувствительности коагулазонега-тпвных ШРМ к антимикробным препаратам приведены в таблице 1. Наибольшее число ШРМ проявило устойчивость к (3-лактамам (75% к пенициллину и 83,3% к амоксициллину), в то время как резистентными к линкомицину, эритромицину и новобиоцину оказались 33,3; 41,7 и 50% ШРМ соответственно. Не обнаружили ШРМ, устойчивых к аминогликозидам и тетрациклинам.
Данные об отношении к антибиотикам Шчм СКц представлены в таблице 2. Из них резистентными к пенициллину признали 49,2%, а к амоксициллину 30,8%.
3 Скп оказались устойчивыми к [5-лактамам, а 1 из них проявил, кроме того, резистентность к макролидам, линкоса-мидам и новобиоцину.
Высокий уровень резистентности к (З-лактамам изолятов
1. Чувствительность к 13 антибактериальным препаратам 12 ШРМ Скн, изолированных от коз с субклиническим маститом
2. Чувствительность к 13 антибактериальным препаратам 65 Шчм Скн, изолированных от коз с субклиническим маститом
Антибактери- Чувствительные изоляты Умеренно чувствительные
альные и резистентные изоляты
препараты % доверительный % доверительный
Пенициллин 25,0 17,5-33,3 75,0 66,8-82,4
Амоксициллин 16,7 10,5-24,1 83,3 76,0-89,5
Оксациллин 0 0 100,0 99,7-100,0
клавулановая 83,3 76,0-89,5 16,7 10,5-24,1
Гентамицин 100,0 99,7-100,0 0 0
Амикацин 100,0 99,7-100,0 0 0
Тетрациклин 100,0 99,7-100,0 0 0
Линкомицин 66,7 57,9-75,0 33,3 25,1-42,1
Эритромицин 58,3 49,3-67,1 41,7 32,9-50,8
кислота 8,3 4,0-14,0 91,7 86,0-86,2
Энрофлоксацин 91,6 85,9-86,1 8,4 4,1-14,1
Пефлоксацин 83,3 76,0-89,5 16,7 10,5-24,1
Новобиоцин 50,0 40,0-59,1 50,0 40,0-59,1
Антибактери- Чувствительные изоляты Умеренно чувствительные
альные и резистентные изоляты
препараты % доверительный интервал % доверительный интервал
Пенициллин 50,8 49,3-52,4 49,2 47,7-50,8
Амоксициллин 69,2 67,8-70,6 30,8 29,4-30,9
Оксациллин 100,0 99,9-100,0 0 0
клавулановая 100,0 99,9-100,0 0 0
Гентамицин 100,0 99,9-100,0 0 0
Амикацин 100,0 99,9-100,0 0 0
Тетрациклин 76,9 75,6-78,2 23,1 21,8-24,4
Линкомицин 100,0 99,9-100,0 0 0
Эритромицин 98,5 98,1-98,9 1,5 1,2-1,9
кислота 10,8 9,9-11,8 89,2 88,2-90,2
Энрофлоксацин 100,0 99,9-100,0 0 0
Пефлоксацин 98,5 98,1-98,9 1,5 1,2-1,9
Новобиоцин 96,6 99,4-99,8 3,4 2,9-4,0
стафилококков обеих групп, вероятно, обусловлен частым применением этих антибиотиков для лечения мастита. К числу механизмов резистентности к этим препаратам относятся синтез альтернативных (имеющих пониженный аффинитет к |3-лактамам) пенициллин-связывающих белков, а также более 200 типов р-лактамаз [11]. У стафилококков отмечают перекрестную устойчивость ко всем пенициллинам и цефалоспоринам |8|.
Шчм Скн реже всего проявляли резистентность к эритромицину (1,5%), пефлоксацину (1,5%) и новобиоцину (3,4%); среди них устойчивых к линкомицину и энрофлок-сацпну изолятов не обнаружили. Обе группы стафилококков не проявляли резистентности к аминогликозидам. К тетрациклину чувствительными оказались все Шчм СКн и 76,9% ШРМ. Причины такого отношения к тетрациклину остаются неясными.
Высокую устойчивость к макролидам и линкомицину Шчм Скн можно объяснить их частым применением в ветеринарии и наличием перекрестной резистентности к этим препаратам.
Редкое проявление устойчивости к фторхинолонам (эн-рофлоксацину и пефлоксацину) у Шчм и ШРМ СКн было, по всей видимости, обусловлено тем, что эти антибиотики не применяют для лечения мастита, и отсутствием плазмидного переноса резистентности к ним.
На рисунках 1, 2 и 3 изображены графики, построенные на основе экспериментальных данных и характеризующие чувствительность стафилококков к пенициллину, амоксициллину и линкомицину. Представлены также кумулятивные кривые чувствительности ШРМ и Шчм СКн к пенициллину (рис. 4), линкомицину (рис. 5), амоксициллину (рис. 6), эритромицину (рис. 7) и новобиоцину (рис. 8). Эти графики демонстрируют связь между величиной ЗИМР (ось X) и кумулятивным процентом (ось V).
Кумулятивный график проявления чувствительности к пенициллину 96 изолятами (рис. 1) показывает, что диаметр ЗИМР колебался от 40 мм (максимальный) до 6 мм (минимальный). Величина ЗИМР50 равнялась 8 мм, а ЗИМР90 — 7 мм. Для амоксициллина значения ЗИМР50 и ЗИМРд0 составили 8 и 7 мм соответственно (рис. 2) при колебании диаметра ЗИМР от 6 до 33 мм. Для линкомицина диаметр ЗИМР варьировал в пределах от 6 до 40 мм при уровнях ЗИМР50 и ЗИМР90, равных 25 и 7 мм соответственно.
На рисунке 4 изображен кумулятивный график чувстви-
37 34 31 28 25 22 19 16 13 Диаметр ЗИМР, мм
100 90 80 70 60 50 40 30 20 10 0
Рис. 1. Кумулятивный график резистентности к пенициллину штаммов Staphylococcus spp., изолированных из молока коз (-♦-); теоретическая кривая (-). г2 -коэффициент корреляции обоих графиков
Рис. 2. Кумулятивный график резистентности к амоксициллину штаммов Staphylococcus spp., изолированных из молока коз (-♦-); теоретическая кривая (-). г2 -коэффициент корреляции обоих графиков
43 39 35 31 27 23 19 15 11 Диаметр ЗИМР, мм
Целью данной работы было изучение изменений, происходящих в клетках стафилококка при адаптации их непосредственно к АМД, и сравнение этих изменений с обнаруживаемыми у клеток, адаптированных к грамицидину S и проявляющих устойчивость к АМД. Был получен штамм стафилококка, устойчивый к АМД, и проведено сравнительное изучение двух устойчивых штаммов.
Микроорганизмы выращивали на МПБ в колбах на качалках и на мясо-пептонном агаре (МПА) при 37 њС.
Препараты АМД, грамицидина S и гелиомицина получены путем биосинтеза и очищены в лаборатории антибиотиков кафедры микробиологии биологического факультета МГУ, производные грамицидина S получены на химическом факультете МГУ путем химической модификации грамицидина S. В молекулах производных обе свободные аминогруппы остатков орнитина ацилированы остатками глицина (N,N'-глицилграмицидин), аминокапроновой кислоты (N,N'-аминокапронилграмицидин) или превращены в гуанидиновую группировку (N,N'-гуанилграмицидин).
Неотеломицин, канамицин , даунорубицин (рубомицин), доксорубицин и карминомицин были любезно предоставлены сотрудниками НИИ по изысканию новых антибиотиков РАМН. Использованы также препараты цефалоридина ("Glaxo"), хлорамфеникола , тетрациклина , рифампицина (АООТ"Акрихин"), бензилпенициллина , ампициллина , эритромицина , олеандомицина , новобиоцина , ристомицина ("Sigma"), ванкомицина ("Ely Lilly").
Определение возможной ферментативной инактивации АМД клетками устойчивого штамма R80 проводили как описано ранее [2].
Определение чувствительности штаммов к антибиотикам проводили методом разведений в МПБ, внося рассчитанные количества раствора антибиотика в ряд пробирок с МПБ, засеянным исследуемой культурой. Рост культур оценивали по величине оптической плотности культуральной жидкости после инкубации при 37 њС в течение 18 ч. После предварительного ориентировочного определения активности препаратов титрование повторяли в более узком диапазоне концентраций. Зависимость оптической плотности культуральной жидкости от концентрации препарата выражали графически.
Связывание АМД клетками стафилококка определяли по ранее описанной методике [2] спектрофотометрически по разности между количеством антибиотика в среде в начале опыта и после инкубации в ней клеток.
Для определения функциональной активности коагулазы и фактора слипания поверхностного белка S.aureus, вызывающего агглютинацию собственных клеток при взаимодействии их с фибриногеном, исследуемые штаммы выращивали на МПБ в течение 18 ч. Количество биомассы в культуральной жидкости определяли по величине оптической плотности и рассчитывали по стандартной кривой. Инкубационная смесь для определения коагулазной активности содержала: 40% плазмы крови, культуральную жидкость в количестве, соответствующем 0,16 мг сухой массы клеток на I мл, физиологический раствор до объема 0,5 мл. Смеси для обнаружение активности фактора слипания содержали от 0,03 до 0,5% фибриногена, культуральную жидкость в количестве, соответствующем 0,5 мг сухой массы клеток на I мл, физиологический раствор - до I мл. Инкубационные смеси выдерживали при 37 њС, отмечая момент появления сгустка (определение коагулазы) или начала агглютинации клеток (определение фактора слипания). В этих экспериментах использовали плазму крови человека производства ООИ "Ассоциация больных гемофилией" и фибриноген производства Каунасского предприятия по производству бактерийных препаратов (Литва).
Электронно-микроскопическое изучение срезов клеток проводили как описано ранее [2].
В связи с имеющимися данными [3, 4] о способности некоторых бактерий инактивировать актиномициновые антибиотики путем ферментативного гидролиза лактонной связи в их молекуле нами была исследована возможность такого гидролиза АМД клетками устойчивого штамма с образованием неактивных продуктов. Исследовали ацетоновые экстракты из клеток R80, выращенных в присутствии суббактериостатических концентраций АМД или инкубировавшихся в растворе АМД, а также этилацетатные экстракты центрифугатов культуральной жидкости и суспензий клеток. Экстракты из клеток и центрифугатов подвергали тонкослойной хроматографии и электрофорезу. Во всех случаях обнаруживался только интактный АМД, но не его монолактон или актиномициновая кислота. При биоавтографии электрофореграмм и хроматограмм зоны подавления роста тест-культуры S.aureus 209P совпадали с зонами локализации АМД. Таким образом, ферментативная деградация антибиотика не является фактором устойчивости к АМД штамма R80, как и штамма R9 [2].
Устойчивый к грамицидину штамм R9 обнаружил возникновение устойчивости к АМД и другим антибиотикам актиномициновой группы. Для выявления возможной перекрестной устойчивости штаммов R9 и R80 к грамицидиновым и актиномициновым антибиотикам была исследована чувствительность штамма R80 к грамицидину S и близким к нему соединениям - циклопептидам. Уровень устойчивости штамма R80 к большинству исследованных циклических полипептидов был повышен примерно в 2 раза (табл. 1). Штамм R9 к исследованным полипептидам был устойчив - значения МПК составляли более 25-50 мкг/мл.
| Таблица 1. Чувствительность стафилококков к актиномицину D, грамицидину S, производным грамицидина и тироцидину | |||
| Антибиотики | Kонцентрации антибиотиков, подавляющие рост культур на МПБ (в мкг/мл) | ||
| исходный штамм S.аurеus 209P | штамм R80, устойчивый к актиномицину D | штамм R9, устойчивый к грамицидину S | |
| Актиномицин D | 0,8 | 80-100 | 10-20 |
| Грамицидин S | 2,0 | 5,5 | 20-25 |
| Гуанилграмицидин | 4,5 | 9,0 | 50 |
| Глицилграмицидин | 6,2 | 10,0 | 50 |
| Аминокапронилграмицидин | 8,0 | 30,0 | 50 |
| Тироцидин | 5,5 | 17,0 | 30-40 |
Штамм R80 так же, как и грамицидиноустойчивый штамм R9, сохраняет чувствительность к широкому кругу антибиотиков: беталактамам, аминогликозидам, тетрациклину, гелиомицину, рифампицину, эритромицину, олеандомицину, неотеломицину, новобиоцину, даунорубицину, карминомицину и доксорубицину. В то же время у обоих штаммов отмечено некоторое снижение чувствительности к ванкомицину, антибиотику, действующему на пептидогликансинтезирующую систему бактерий [5, 6]. На рис. 1 отражено влияние антибиотиков на рост культур исследованных штаммов: рис. 1,а - снижение чувствительности к АМД у штамма R9; рис. 1,б - снижение чувствительности к грамицидину S у штамма R80; рис. 1,в - снижение чувствительности к ванкомицину у обоих штаммов; рис. 1,г - сохранение чувствительности к эритромицину.
Таким образом, оба полученные нами штамма стафилококка проявляют перекрестную устойчивость к АМД и грамицидину S, различающуюся по уровню, а также в равной степени обнаруживают снижение чувствительности к ванкомицину, сохраняя чувствительность к ряду других антибиотиков.

Различные штаммы стафилококков присутствуют у большинства людей и являются частью нормальной микробиоты кожных покровов, слизистых оболочек и нижнего отдела кишечника. Важное значение со стороны клинической практики и эпидемиологического надзора имеет бактерионосительство S. aureus, являющегося возбудителем многих инфекционных заболеваний человека. Стафилококками продуцируется большое количество факторов патогенности и токсинов. В настоящее время у стафилококков выделено и изучено более 30 различных экзотоксинов, эндотоксинов и суперэнтеротоксинов. Факторы патогенности микробов различными механизмами действуют на иммунную систему человека, что приводит к снижению сопротивляемости организма и развитию как острых, так и хронических форм заболеваний стафилококкового генеза. По данным литературных источников, приблизительно 40 % людей являются постоянными носителями S. аureus на слизистых оболочках крыльев носа, зева, коже подмышечных впадин и промежности, оставшуюся часть популяции относят к транзиторным и случайным носителям [1].
Важное клиническое значение бактерионосительства определяется типичностью процесса транслокации (переноса) стафилококков с наружных кожных покровов и слизистых оболочек во внутреннюю среду организма хозяина с развитием широкого спектра заболеваний [2, 3, 4]. Неблагоприятные факторы окружающей среды влияют не только на макроорганизм, но и на колонизирующие его микроорганизмы. В частности, усиливают действие механизмов агрессии потенциально патогенных бактерий и способность противостоять действию антибактериальных препаратов. Следовательно, стафилококки представляют опасность как для самого бактерионосителя, так и в эпидемиологическом плане, попадая в окружающую среду [5].
Ещё одна причина неэффективности лечения инфекций с помощью антибиотиков – стратегия, которую применяют многие практикующие врачи. Зачастую не проводится бактериологическое исследование и верификация возбудителя инфекции с последующим исследованием его чувствительности к антибиотикам. Получается нонсенс: лечение без диагностики [7]. Теряется время, пациент страдает не только от инфекции, но и от побочных эффектов антибиотика.
Цель работы – изучить наличие в микробиоме зева гемолитических штаммов стафилококков у здоровых молодых людей в открытом коллективе и определить чувствительность выделенных штаммов к антибактериальным препаратам, применяемым в практическом здравоохранении.
Материалы и методы исследования
Результаты исследования и их обсуждение
В результате исследования от 350 практически здоровых студентов без клинических признаков патологии носоглотки и верхних дыхательных путей было выделено 23 гемолитических штамма, идентифицированных как представители рода Staphylococcus spp.
У 7 % студентов без клинических признаков патологии носоглотки и верхних дыхательных путей выявлены гемолитические штаммы Staphylococcus spp. (рис. 1).
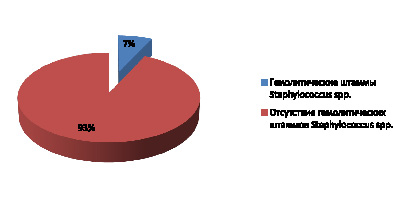
Рис. 1. Частота выявления гемолитических штаммов Staphylococcus spp. в микробиоме зева студентов, %
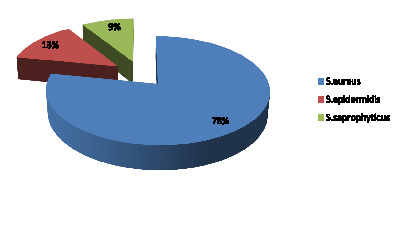
Рис. 2. Частота выявления видов Staphylococcus spp. в микробиоме зева студентов, %
Культуры, выделенные со слизистой оболочки зева, были представлены гемолитическими штаммами S. aureus – 18, S. epidermidis – 3, S. saprophyticus – 2 изолята (рис. 2). MRSA штаммы Staphylococcus spp. не выявлены.
Выделенные штаммы S. aureus в 100 % случаев чувствительны к следующим антибактериальным препаратам: пенициллину, ванкомицину, линезолиду, эритромицину, левофлоксацину, фузидину, клиндамицину, гентамицину, доксоциклину, оксациллину, рифампицину, ципрофлоксацину. В 6 и 50 % были устойчивы к левомицетину и ко-тримаксозолу соответственно (рис. 3).
Штаммы S. epidermidis чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, эритромицину, левофлоксацину, левомицетину и ко-тримаксозолу. К фузидину, левомицетину чувствительны 33 % выделенных штаммов данного микроорганизма, к гентамицину и оксациллину чувствительны 27 %, к рифампицину 77 и 100 % не чувствительны к ципрофлоксацину (рис. 4).
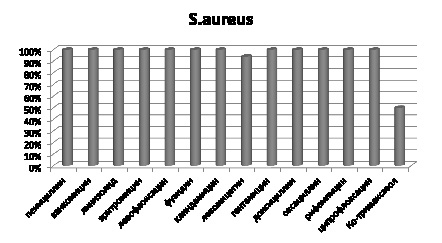
Рис. 3. Чувствительность выделенных штаммов S. aureus к антибиотикам, %
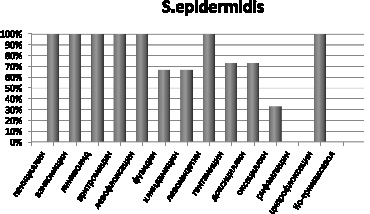
Рис. 4. Чувствительность выделенных штаммов S. epidermidis к антибиотикам, %
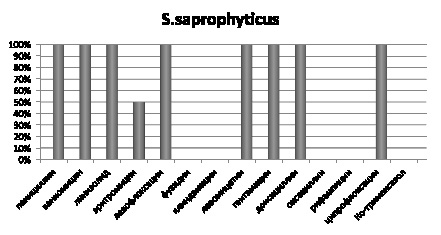
Рис. 5. Чувствительность выделенных штаммов S. saprophyticus к антибиотикам, %
Изоляты S. saprophyticus чувствительны на 100 % к пенициллину, ванкомицину, линизолиду, левофлоксацину, левомицетину, гентамицину, доксоциклину и ципрофлоксацину, на 50 % к эритромицину, и не чувствительны к фузидину, клиндамицину, оксациллину, рифампицину и ко-тримаксозолу (рис. 5).
Выводы
Получены данные о вариантах и частоте носительства условно-патогенных и патогенных стафилококков (7 %) в микробиоте зева молодых людей, при котором не установлено формирование патологических процессов в зеве, что свидетельствует о динамическом равновесии биоценоза и не требует активной эрадикации стафилококков.
Рецензенты:
Читайте также:


