Что означает слово стафилококк

Цель. Изучение таксономической структуры микробиоценоза слизистой оболочки переднего отдела носа является одним из важнейших этапов его микроэкологической характеристики. Исходя из этого положения, представлялось важным изучение характера доминирования отдельных видов стафилококка в биотопе слизистых оболочек переднего отдела носа у детей, проживающих в районах с различной антропогенной нагрузкой.
Известно, что в состав микробиоценоза слизистой оболочки переднего отдела носа входят популяции различных видов микроорганизмов, но у детей доминируют представители кокковой микрофлоры, в основном различные виды рода Staphylococcus. Слизистая оболочка носа является основным биотопом стафилококка, где его персистенция протекает в виде бактерионосительства [1,4]. По мнению Д.Г. Дерябина [1], основными источниками стафилококковой инфекции являются носители, рост числа которых прямо пропорционально зависит от подъема заболеваемости.
Материалы и методы. Для анализа характеристики структуры стафилококка проводился отбор проб со слизистой оболочки переднего отдела носа у 521 ребенка в возрасте 8–12 лет. Обследуемые дети проживали в трех районах г. Красноярска с разной экологической обстановкой: 1 – Октябрьский (экологическая обстановка удовлетворительная), 2 – Кировский (экологическая обстановка неудовлетворительная), 3 – Советский (экологическая обстановка неудовлетворительная).
Обсуждение результатов. Проведенные микробиологические исследования показали, что у 454 (87,1 %) из 521 обследованного ребенка со слизистой оболочки переднего отдела носа высевалась кокковая микрофлора – представители рода Staphylococcus, у 38 (7,3 %) обследованных – палочковидная микрофлора и 29 (5,6 %) ребенка при первичном посеве рост отсутствовал.
У большинства обследованных детей, проживающих в Красноярске, со слизистой оболочки переднего отдела носа высевались коагулазоположительный золотистый стафилококк (58,6 %), коагулазоотрицательный эпидермальный стафилококк (16,5 %) и в 6,1 % случаях был идентифицирован коагулазоположительный S.intermedius. Распределение по районам проживания детей выглядело следующим образом. В первом районе золотистые стафилококки высевались в 37,6 % случаев, эпидермальный стафилококк – в 11,9 % и S.intermedius – в 8,4 %. Во втором и третьем районах превалировал S.aureus – 63,2 и 56,8 % соответственно; S. epidermidis встречался в 17,0 и 16,5 % случаев соответственно, S. intermedius регистрировался у 4,4 % обследованных из второго района и у 6,1 % из третьего.
Другие коагулазоотрицательные представители рода Staphylococcus представлены следующими видами: S. hyicus, S. xylosus, S. saprophyticus, S. capitis, S. caprae, S. warneri, S. hemolyticus, S. cohnii, S. simulans и высевались в 13,4 % случаев. Соотношение штаммов данных видов стафилококка, выделенных со слизистой оболочки переднего отдела носа у детей города Красноярска, представлено в таблице 1. Из данных таблицы следует, что помимо коагулазоотрицательных S.epidermidis на слизистой оболочки переднего отдела носа у детей города Красноярска встречаются S. saprophyticus (7,3 %), S. hyicus (2,3 %), S. capitis (1,1 %) и в менее 1 % случаев S. xylosus, S. caprae, S. warneri, S. hemolyticus. Распространенность коагулазоотрицательных культур стафилококка в зависимости от района выделения выглядит следующим образом. Во всех трех исследуемых районах на слизистой оболочке носа у детей из КОС преобладал S. saprophyticus, в первом районе данный вид стафилококка встречался в 4,9 %, во втором высевался у 8 % обследуемых, и в третьем районе у 9,3 %. Кроме S. saprophyticus, в первом районе микробиоценоз верхних дыхательных путей у детей был представлен S. hyicus (4,9 %), S. capitis (3 %), S. xylosus (2 %), S. hemolyticus (1,5 %), S. caprae, S. simulans (1 %) и в менее 1 % случаев встречались S. warneri и S. cohnii. Микробиоценоз слизистой оболочки верхних дыхательных путей у детей, проживающих во втором исследуемом районе, был представлен S. hyicus (1,5 %) и S.warneri (0,7 %). В третьем исследуемом районе микробиоценоз слизистой оболочки носа у детей был менее разнообразен и помимо S. saprophyticus из КОС другие виды не регистрировались.
Таким образом, микробиоценоз верхних дыхательных путей у детей, проживающих в первом исследуемом районе, более разнообразен и представлен 12 видами стафилококка, во втором и третьем районах количество встречаемых видов стафилококка значительно меньше – 6 и 4 соответственно.
Соотношение штаммов разных видов коагулазоотрицательных стафилококков (КОС) в зависимости от района выделения
Исследования последних лет свидетельствуют о том, что загрязнение окружающей среды приводит не только к широкому распространению экологически обусловленных заболеваний, угнетению иммунобиологической реактивности организма, нарушению репродуктивной функции и другим многочисленным негативным сдвигам в состоянии здоровья макроорганизма [1,2,4], но к качественному и количественному изменению микрофлоры организма человека [3,4]. В частности, по мнению Б.А. Шендорова (1998), различные поллютанты в порядке индукции защитных реакций у микробов могут вызывать существенные изменения в их патогенности. Поэтому изучение свойств патогенности у золотистых стафилококков, колонизирующих слизистые оболочки такого слабо адаптированного контингента, как младшие школьники, имеет важное научно-практическое значение [4].
Для более полной оценки микроэкологической характеристики биоценоза очень важно исследовать биологические свойства отдельных штаммов микроорганизмов, входящих в этот биоценоз. На первом этапе бактериологического исследования при индикации стафилококков обращали внимание на пигментообразование колоний. Большинство исследуемых штаммов S.aureus синтезируют пигмент: белый – 31,6 %, желтый – 41,0 %, кремовый – 14,6 % и только 12,8 % колоний стафилококка пигмента не имели. Распределение пигментообразования у культур золотистого стафилококка в зависимости от района выделения выглядело следующим образом: во всех трех исследуемых районах города Красноярска преобладали культуры стафилококка, продуцирующие желтый пигмент (46,1, 31,4 и 45,3 % соответственно), продукция белого пигмента была характерна для 35,5 % культур стафилококка, встречающихся в микробиоценозе слизистой оболочки носа у детей, проживающих в первом исследуемом районе, и в 29,0 и 30,7 % у культур, выделенных во втором и третьем районах соответственно. Наличие кремового пигмента или отсутствие пигментирования у культур золотистого стафилококка встречалось реже. Во втором исследуемом районе у 21,0 % изученных культур отсутствовало пигментообразование, в третьем районе таких культур было 12,5 %, а в первом только у 3,9 % выделенных культур золотистого стафилококка наличие пигмента не регистрировалось. Возможно, пигментообразование зависит от генотипа S.aureus, детерминирующего синтез различных реакций, а вместе с ним – цвет пигмента.
Таким образом, большинство изученных культур золотистого стафилококка (87,2 %), входящих в состав микробиоценоза слизистой оболочки верхних дыхательных путей у детей города Красноярска, продуцировали тот или иной пигмент (рисунок).
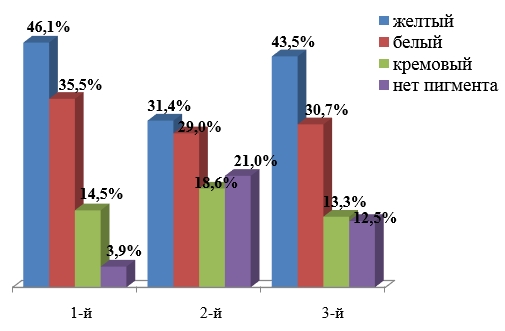
Частота пигментообразования штаммов стафилококка, выделенных со слизистой оболочки носа детей, проживающих в районах с различной антропогенной нагрузкой, %
Среди косвенных индикаторов патогенности большое значение имеют скорость и интенсивность биосинтетических и репродуктивных процессов. Частота появления дочерних клеток, характер их деления и накопления в пространстве отражается на размере и плотности грозди микроорганизмов. Для патогенных штаммов характерно быстрое деление и наличие мелких бактериальных клеток с одновременным формированием весьма массивных гроздей. По мнению авторов [1,4], подобное состояние микробного сообщества типично для микроорганизмов в неблагоприятных условиях, когда идет борьба за сохранения вида. В благоприятной обстановке, напротив, биосинтетические процессы в популяции протекают спокойно, полноценно, ускоренного преждевременного деления клеток нет, поэтому грозди малокомпонентны, микробные особи довольно крупные.
Используя окуляр и объектив микрометра, были проведены замеры особей в гроздях, учитывая компонентность последних.
Анализ полученных данных показал, что размеры клеток стафилококка и объемы гроздей варьируют в достаточно широких пределах в зависимости от района выделения. В первом исследуемом районе преобладали штаммы золотистого стафилококка, имеющие крупные клетки более 1,0 мкм в диаметре – 55,3 %; 36,8 % культур имели средние размеры микробных клеток (0,5–1,0 мкм в диаметре) и только у 7,9 % исследуемых культур S. aureus, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в первом исследуемом районе, имело клетки менее 0,5 мкм в диаметре, т.е. были мелкие.
Во втором исследуемом районе со слизистой оболочки переднего отдела носа у детей выделялись культуры золотистого стафилококка среднего (60,4 %) и мелкого размера (24,5 %), 15,1 % исследуемых культур имели диаметр бактериальных клеток более 1,0 мкм. В третьем исследуемом районе более 50 % изученных культур золотистого стафилококка имели мелкие размеры (51 %), средними размерами обладали 40,3 % культур, и только 8,7 % бактериальных клеток имели крупные размеры (более 1,0 мкм).
Изучив такой показатель, как объем формирующейся грозди стафилококковых культур, выделенных со слизистой оболочки переднего отдела носа у детей, проживающих в трех исследуемых районах города Красноярска, получили следующие результаты.
В первых двух исследуемых районах преобладали грозди культур стафилококка средние (67,1 и 68,6 % соответственно), а в третьем районе – крупные (51, %). В первом исследуемом районе крупные бактериальные грозди регистрировались у 11,8 % изученных культур, а во втором районе у 18,6 %. В третьем районе в 40,3 % встречались клетки стафилококка, имеющие средние объемы, и в 8,7 % – мелкий.
Заключение. Таким образом, со слизистой оболочки носа у детей, проживающих в первом исследуемом районе, выделялись культуры S. aureus, имеющие крупные размеры бактериальных клеток и средние объемы грозди. Во втором исследуемом районе преобладали культуры более мелкие в диаметре и имеющие средние объемы. В третьем же районе выделенные культуры стафилококка были мелкие и имели крупные объемы грозди, что характерно для патогенных штаммов.
Анализ данных количественной характеристики стафилококкового сообщества слизистой оболочки переднего отдела носа у детей, проживающих в исследуемых районах, показал, что к числу свойств, влияющих на формирование микробного биоценоза, а также определяющих потенциальную эпидемиологическую опасность штаммов, относится показатель микробной обсемененности.
Полученные данные свидетельствуют о высокой микробной обсемененности стафилококком слизистой оболочки переднего отдела носа у детей (103-104 КОЕ/мл), при которой происходит массивное выделение возбудителя во внешнюю среду, а носители являются основными источниками распространения стафилококков среди восприимчивых лиц в человеческой популяции.
Высокая микробная обсемененность (более 50 %) наблюдалась в посевах со слизистой оболочки носа у детей, проживающих во втором и третьем исследуемых районах (63,2 и 56,8 % соответственно), тогда как в посевах со слизистой оболочки носа у детей, проживающих в первом районе, высокая микробная обсемененность составила лишь 37,6 %. В посевах со слизистой носа наблюдался у 29,2 % детей из первого района незначительный рост (101-102 КОЕ/мл), у 33,2 % обследуемых детей рост культуры стафилококка отсутствовал. Во втором исследуемом районе при первичном посеве со слизистой оболочки переднего отдела носа у детей незначительный рост наблюдался у 31,6 % и у 5,14 % обследованных рост отсутствовал. Исследования, проводимые в третьем районе, показали, что у 7,6 % обследованных рост при первичном посеве со слизистой носа отсутствовал, а у 35,5 % при посеве исследуемого материала обсемененность была незначительной. Результаты исследования представлены в таблице 2.
Микробная обсемененность стафилококком слизистой оболочки
переднего отдела носа у детей, проживающих в экологически неравнозначных районах, %

Атопический дерматит (АД) представляет собой мультифакторное хроническое воспалительное заболевание кожи, которое начинается в раннем детском возрасте и может сохраняться во взрослой жизни со значительным ущербом для качества жизни [15, 57]. Распространенность АД за последние три десятилетия в промышленно развитых странах увеличилась [37, 53]. В патогенезе заболевания играют значительную роль как генетические, так и экологические факторы, определяющие тяжесть дерматоза [5]. Патогенез АД включает в себя сложное взаимодействие между генетическим фоном, функциональными нарушениями кожного барьера, дисфункцией врожденного и адаптивного, гуморального и клеточного иммунитета [43, 52].
Основным осложняющим фактором течения АД является наличие патогенных микроорганизмов на поверхности кожи пациентов. Дефекты иммунной системы и нарушение функции кожного барьера приводят к увеличению проникновения аллергенов через кожу и повышают восприимчивость к инфекционным агентам [3, 39].
Роговой слой эпидермиса является барьером, препятствующим проникновению микроорганизмов, сохраняющим влагу и питательные вещества в дерме. Здоровая, сухая кожа с кислым pH является неоптимальной средой для роста микроорганизмов. Свободные жирные кислоты, образующиеся в процессе ороговения клеток эпидермиса, способствуют поддержанию кислой среды (рН 5) кожи. Кожа ‒ непрерывно самообновляющийся орган – в результате терминальной дифференцировки постоянно отторгаются чешуйки с ее поверхности, что препятствует бактериальной колонизации. Несмотря на это, на 1 см2 кожи и её придатках обитает до 1 миллиарда бактерий, относящихся как к резидентной микрофлоре, так и транзиторной [28, 31]. Резидентные и транзиторные микроорганизмы не являются патогенными при нормальных условиях и составляют естественную биопленку кожи. Микрофлора кожи оказывает как прямое, так и косвенное воздействие на патогенные бактерии, попадающие на ее поверхность. Микроорганизмы-комменсалы производят антимикробные вещества, такие как бактериоцин и токсичные метаболиты, которые непосредственно подавляют патогенные микроорганизмы. Кроме того, микроорганизмы-комменсалы конкурируют с патогенными микроорганизмами за питательные вещества, нишу и рецепторы – этот процесс известен как бактериальный конфликт. Например, Staphylococcus epidermidis ‒ один из основных микроорганизмов на здоровой человеческой коже, который связывается с рецепторами кератиноцитов, блокируя присоединение к ним S. aureus. Микрофлора кожных покровов также косвенно влияет на патогенные микроорганизмы, стимулируя иммунную систему, усиливая выработку антител, повышая производство цитокинов и стимулируя процесс фагоцитоза [21, 31]. Грамположительные аэробные бактерии: коагулазонегативные стафилококки (Staphylococcus epidermidis, Staphylococcus hominis, Staphylococcus haemolyticus), стрептококки и микрококки обычно заселяют открытые участки кожи, в то время как грамположительные анаэробные бактерии, как правило, присутствуют в области кожных складок. Грамотрицательные бактерии на здоровой коже встречаются редко [31, 50]. Недавние исследования показывают, что проницаемость кожного барьера и нарушение антимикробной функции имеют общие структурные и биохимические механизмы, и они взаимозависимы [7, 32, 46].
S. aureus играет важную роль в патогенезе АД [2, 30], является грамположительным кокком, факультативным анаэробом, имеющим широкий спектр клеточных структур и факторов вирулентности; не относится к нормальной микрофлоре кожи, но может временно колонизировать кожу больных АД, полость носа, область промежности [31, 37]. При этом полость носа представляет собой основной резервуар для обсеменения S. aureus кожи и слизистых оболочек. При острых экссудативных изменениях кожи очаги поражения могут содержать более 10 миллионов патогенных микроорганизмов на квадратный сантиметр [24, 35].
Можно выделить следующие факторы, значимые для колонизации S. aureus на коже больных АД:
1. Нарушение эпидермального барьера. Установлена связь между развитием АД и наличием мутаций в гене, кодирующем филаггрин (ключевой белок в конечной дифференциации клеток кожи, участвующих в формировании барьера кожи) [17, 38, 52].
2. Смещение рН в щелочную сторону за счет нарушений в структуре гидролипидной мантии кожи [38, 50].
3. Снижение количества церамидов, свободных жирных кислот и липидов на поверхности атопической кожи [13, 35]. Изменение состава липидов рогового слоя является основным дефектом при АД, который обусловливает ксероз кожи и приводит к повышению ее проницаемости для аллергенов и раздражителей. Церамиды удерживают молекулы воды в межклеточном пространстве рогового слоя, а барьерная функция этих сложных структур обеспечивается матрицей структурных белков, которые связаны с церамидами. В результате чего, даже непораженная кожа больных АД характеризуется сухостью и нарушением барьерной функции рогового слоя, о чем свидетельствует повышение показателей трансэпидермальной потери воды [7, 17].
4. Врожденные и приобретенные иммунодефициты [38, 52].
5. Активация факторов адгезии, присутствующих на поверхности бактериальной клетки S. aureus, к кератиноцитам и их связь с рецепторами клеток [20, 38].
6. Низкий уровень иммуноглобулина А в потовых железах секреции [38].
7. Барьерная функция кожи реализуется не только через физические, но и через химические аспекты. Дефицит природных антимикробных пептидов (АМП) (кателицидина, β-дефенсина-2 и дермицидина) может провоцировать восприимчивость пациентов с АД к инфекциям, вызванными S. aureus. В коже человека основными источниками продукции АМП являются кератиноциты, тучные клетки, нейтрофилы и себоциты. Многие из них усиливают свою активность в кератиноцитах при контакте с микроорганизмами или продуктами их жизнедеятельности [21, 23, 46]. Однако доказано, что в коже больных АД снижено количество эндогенных АМП, что тем самым и способствует усиленной колонизации S. аureus [20, 23, 52].
Таким образом, нарушение барьерной функции кожи само по себе предрасполагает к присоединению вторичной инфекции, и, наоборот, патогенное микробное обсеменение/инфекция еще более усиливает нарушение кожного барьера [17]. Нарушения эпидермиса у больных АД повышают вероятность абсорбции антигенов в кожу, создавая порочный круг, который приводит к дальнейшей активации иммунной системы и поддержанию хронического воспаления [3, 17].
При проведении бактериологического обследования S. aureus выделяется с кожи у 80–100 % больных АД, в том числе и не имеющих клинических проявлений заболевания [2, 7 13]. Являясь условно-патогенным микроорганизмом, он может культивироваться с неповрежденной кожи у значительного числа пациентов с АД [27, 37]. Скорость бактериальной колонизации выше во время обострений, чем в период ремиссии и коррелирует с тяжестью поражения кожи [18, 22], а степень колонизации S. aureus на поврежденной коже больше, чем на неповрежденной коже [22, 38]. Степень колонизации (на коже и др. локализациях) S. aureusу пациентов с АД также коррелирует с уровнем общего и специфических IgE, уровнем эозинофилов периферической крови [38, 42]. Взаимосвязь между тяжестью заболевания, численностью колоний S. aureus, выделенных с кожи больных, а также наличие специфических IgE к энтеротоксинам свидетельствуют о влиянии этого микроорганизма на течение АД [1]. В исследовании K. Reginald (2011) у трети пациентов выявлено наличие специфических IgE к белкам S. aureus, но не найдено взаимосвязи между уровнем общего IgE и специфического IgE к данному микроорганизму [44]. Чаще специфические антитела присутствуют у пациентов с умеренной и тяжелой степенью АД [14, 38].
Увеличение колонизации S. aureus может быть связано с наличием рецепторов на клеточной стенке бактерии (адгезинов) для фибронектина и фибриногена, которые обнаруживаются на поврежденной коже у больных АД [20]. S. aureus присоединяется к клеткам эпидермиса хозяина через поверхностные рецепторы, которые чувствительны к тейхоевой кислоте [31]. Бактериальные клетки, которые прочно прикрепляются к верхней поверхности корнеоцитов, могут проникать через межклеточные пространства рогового слоя эпидермиса, образуя биопленку из волокон фибрина и гликокаликса. Биопленки имеют важное значение для адгезии S. aureus на кожу и устойчивости к антимикробным агентам [26, 27].
Способность S. aureus вызывать заболевания человека зависит не только от производства на поверхности клеточной стенки возбудителя адгезинов, но и выработки антифагоцитарных факторов и экзотоксинов. Существуют более 20 различных стафилококковых энтеротоксинов, и лишь немногие из них были подробно изучены. Наибольшее количество работ посвящено изучению стафилококковых энтеротоксинов серотипов А-Е (SEA-SEE) и SEG-SEQ [41, 48].
К классическим стафилококковым энтеротоксинам относят энтеротоксины (SE), SEB, SEC, SED и TSST-1, вызывающие синдром токсического шока. Наиболее значимую роль отводят стафилококковому энтеротоксину А (SEA), стафилококковому энтеротоксину В (SEB) и токсину синдрома токсического шока-1 (TSST-1) [35, 36]. Эти токсины, продуцируемые стафилококковыми бактериями, выступают в качестве суперантигенов (SsAgs), выделяемых 80,0 % штаммов S. aureus, полученных от больных АД [37, 41]. Ss Ags являются белками, характеризующимися большой молекулярной массой. Они вызывают воспалительные реакции в коже, в том числе за счет активации моноцитов и лимфоцитов, которые в ответ на это производят ряд воспалительных цитокинов. Это связано с тем, что Ss Ags реагируют только с короткой переменной части Т-клеточных рецепторов (T-cell receptor – TCR) в β-цепи. Стоит также отметить, что Ss Ags вносят вклад в создание устойчивости к терапии глюкокортикостероидами через воздействие на Т-клетки, обусловливая низкую эффективность этих препаратов [30, 38, 56]. Штаммы S. aureus, полученные от больных со стероид-устойчивыми формами АД, показали способность производить большое количество SsAgs в организме. SsAgs активирует Т-лимфоциты, что, в свою очередь, ведет к последующему запуску синтеза провосполительных цитокинов, которые усиливают и продлевают длительность воспаления в коже и не отвечают на иммунодепрессивные эффекты кортикостероидов [30, 41, 48].
Более 50,0 % S. aureus обладают способностью вырабатывать энтеротоксины, причем один штамм может продуцировать сразу несколько типов энтеротоксинов [5]. Не выявлено четкой связи между колонизацией конкретного штамма S. aureus на коже и производством конкретных энтеротоксинов. Однако наличие экзотоксин-продуцирующих штаммов S. aureus определяет более тяжелое течение АД, высокие показатели IgE, более выраженные клинические проявления (увеличение суммы баллов по шкале SCORAD) [4,5, 38].
SsAgs также могут воздействовать на другие типы клеток, такие как эозинофилы, клетки Лангерганса, макрофаги и кератиноциты. Кроме того, у пациентов с АД Ss Ags могут функционировать как аллергены, на которые базофилами вырабатываются специфические антитела IgE. Базофилы, в свою очередь, под действием этих токсинов вырабатывают гистамин, т.е. SsAgs индуцируют дегрануляцию тучных клеток после проникновения через эпидермальный барьер и способствуют возникновению зуда и острых воспалительных явлений, а также участвуют в хроническом воспалении кожи при АД [14, 38].
Еще одним белком, вырабатываемым S. аureus, является альфа-токсин (α–токсин), который тоже обладает воспалительным эффектом. При низких концентрациях α–токсин – мощный стимулятор продукции цитокинов. При высоких концентрациях α–токсин может привести к некрозу в клетках, образуя мелкие поры (от 1 до 2 нм в диаметре) в клеточных мембранах. Доказано, что α-токсин вырабатывается 30,0 % штаммов S. аureus, изолированных от больных АД. Кроме индукции пролиферации Т-лимфоцитов, α-токсин может способствовать нарушению эпидермального барьера путем повреждения кератиноцитов [51, 55].
Иммунный ответ при АД можно разделить на две фазы – острую и хроническую. Острое воспаление характеризуется повышенной активностью Th2 ответа: экспрессией интерлейкинов (IL)-4, IL-5 и IL-13, снижением выработки интерферона (IFN) γ и повышением уровня общего и специфического IgE. В противоположность этому хроническое воспаление характеризуется повышенной активностью Th1-ответа, который включает увеличение производства IL-12 макрофагами и эозинофилами, а также повышение уровня маркеров хронического воспаления кожи, таких как IL-5, IL-8 и IFN-гамма (гамма-интерферон). Противовоспалительные цитокины IL-4 и IL-13 совместно с IL-5 стимулируют производство IgE и миграцию эозинофилов в очаг воспаления [19]. В последнее время была описана роль новых цитокинов, включая IL-16, IL-17, IL-21, IL-22, IL-23, IL-27, IL-31, IL-33, IL-35 и тимуса стромального лимфопоэтина (TSLP) в иммунопатогенезе АД [19, 25, 29, 33, 34, 49].
SsAgs и α-токсин в естественных условиях способны индуцировать синтез IL-31 у пациентов с АД и увеличивать число рецепторов для этого цитокина на моноцитах, макрофагах и дендритных клетках [38]. Cтимуляция рецепторов гистамина 4-го типа, расположенных на CD4+– лимфоцитах (преимущественно Th2 субпопуляции), также может привести к увеличению секреции IL-31 у пациентов с АД. IL-31 является цитокином, который продуцируется Т-лимфоцитами и относится к семейству IL-6. Этот цитокин, вероятно, может играть важную роль в развитии воспаления (через повышенный синтез IL-1β, IL-6, IL-18 моноцитами и макрофагами), а также в патогенезе зуда путем связывания IL-31 с рецепторами клеток чувствительных нервов. Кроме того, IL-31 стимулирует экспрессию некоторых хемокинов (CCL17, CCL22, CCL1) [38, 49]. В дополнение к этому отмечено, что α-токсин также может подавлять индукцию IL-17 [33].
При АД IL-22-продуцирующие клетки накапливаются в коже и их количество коррелирует с тяжестью заболевания. IL-22 (семейство IL-10) также известен как IL-10-подобный T-клеточный индуцибельный фактор (Interleikin T-cellular indutsibelny factor – IL-TIF). Продуцируется IL-22 синовиальными фибробластами и макрофагами и стимулирует продукцию провоспалительных цитокинов и дефензинов в кератиноцитах человека [34]. Повышение продукции IL-22 в коже стафилококковыми экзотоксинами частично объясняет, как колонизация S. aureus может способствовать хроническому воспалению в коже при АД [53].
Потенциальным медиатором, который может ухудшить течение АД, является липотейхоевая кислота (LipoteichoicAcid – LTA), которая может действовать как агонист для Толл-подобных рецепторов 2-го типа (Toll-likereceptor 2 – TLR 2), а также на рецепторы фактора активации тромбоцитов (Platelet-ActivatingFactorReceptor – PAF-R). Toll-подобные рецепторы являются одним из наиболее важных представителей семейства сигнальных (pattern recognition receptors – PRRs), имеют важное значение для нашей иммунной защиты против микробных инфекций, активируют клеточный иммунитет [51, 54]. Известно 13 толл-подобных рецепторов млекопитающих, обозначаемых аббревиатурами от TLR1 до TLR13, которые связывают различные лиганды и продуцируются в организме различными типами клеток. У человека существуют 10 толл-подобных рецепторов. TLR экспрессируются на мембранах врожденных иммунных клеток (дендритных клетках, макрофагах, естественных киллерах), адаптивных клеток иммунитета (Т- и В-лимфоцитах) и не иммунных клетках (эпителиальных и эндотелиальных клеток). Толл-подобные рецепторы, распознающие структуры клеточной стенки бактерий (TLR1, TLR2, TLR4, TLR5 и TLR 6), экспрессируются преимущественно на поверхности клетки, в то время как TLR 3, 7, 8 и 9, способные связываться с нуклеиновыми кислотами, располагаются внутриклеточно на поверхности эндосом. Распознавание пептидогликана TLR 2 на тучных клетках вызывает их дегрануляцию, что усиливает воспалительные изменения в тканях и может запускать аллергический процесс без участия IgE и аллергена [40].
Комплекс TLR 1 и TLR 2 распознает различные микробные компоненты, такие как пептидогликан грамположительных и грамотрицательных бактерий. TLR 2 имеет решающее значение для защиты от нескольких бактериальных инфекций, в том числе вызванных золотистым стафилококком. Было показано, что TLR 2 очень чувствительны к стафилококковой инфекции [10, 13, 40]
Липотейхоевая кислота является компонентом клеточной стенки грамм (+) бактерий, в том числе S. aureus, что может способствовать связыванию их с TLR 2 [38]. Последние исследования, проведенные J.B. Travers (2010), продемонстрировали, что LTA может способствовать воспалительному процессу в коже больных АД. Это было подтверждено результатами экспериментов, проведенных на мышах: аппликации LTA на поверхность кожи животных привели к развитию типичных поражений, характерных для АД. Было также отмечено, что внутрикожные инъекции LTA вызывали увеличение экспрессии м-РНК для некоторых цитокинов, таких как TLF-α, IL-6 и IL-8 [45, 51]. При этом количество LTA и провоспалительных цитокинов взаимосвязано с количеством бактерий S. аureus, найденных на поражениях участках кожи при АД, и выраженностью воспаления, определяемого клинически [14, 51].
Резистентность к противомикробным препаратам растет почти так же быстро, как разработка новых средств для борьбы с инфекцией. Местное применение антибактериальных и дезинфицирующих средств и системные антибактериальные препараты могут устранить бактериальные инфекции, но длительное их применение повышает риск формирования резистентных штаммов возбудителей [20, 27].
Определение чувствительности S. aureus к противомикробным препаратам должно регулярно выполняться до начала терапии, если это необходимо, чтобы найти различия в резистентности штаммов, полученных из разных участков кожи (пораженных и не пораженных) у больных АД [11, 50].
Метициллин-резистентные штаммы S. aureus (Methicillin-Resistant Staphylococcusaureus-MRSA) становятся все более распространенными у пациентов с АД, и было высказано предположение, что эти пациенты являются резервуаром для устойчивых видов стафилококков [4, 14]. Штаммы MRSA несут в себе mec A-ген, который отличает их от метициллин-чувствительных штаммов S. aureus (Methicillin-Sensitive Staphylococcusaureus – MSSA) тем самым обусловливая свою мультиустойчивость [16, 47]. MRSA устойчивы ко всем доступным пенициллинам и другим β-лактамным антибактериальным препаратам (пенициллины, цефалоспорины, карбопенемы). Кроме того, инфекции, вызванные MRSA, труднее поддаются лечению, чем вызванные MSSA [8]. Было установлено, что антибактериальные препараты, тормозящее синтез белка, могут подавить производство Ss Ags. С другой стороны, продукция Ss Ags не может подавляться антибактериальными препаратами, которые угнетают синтез клеточной оболочки или синтез нуклеиновой кислоты [9]. Существует относительно небольшое число антибактериальных препаратов для лечения инфекций MRSA [8], при этом в последнее время отмечается появление MRSA, устойчивых и к ним [8, 9, 11, 16, 47].
Таким образом, данные литературы свидетельствуют о высокой частоте возникновения вторичных бактериальных осложнений АД как у детей, так и у взрослых, нарастающей резистентности возбудителей. Огромное значение в клинической практике приобретает разработка средств элиминации патогенных возбудителей с кожи больных АД. Указанные положения требуют дальнейших исследований вопросов этиологии, диагностики и антибактериальной чувствительности возбудителей вторичных пиогенных осложнений АД, что необходимо для совершенствования технологий лечения и поиска новых системных и топических средств терапии дерматоза.
Рецензенты:
Читайте также:


