Цефазолин при стафилококке отзывы
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
полусинтетический цефалоспориновый антибиотик I поколения для парентерального применения. Действует бактерицидно, нарушая биосинтез клеточных мембран бактерий. К цефазолину чувствительны: золотистый стафилококк (включая штаммы, продуцирующие пенициллиназу), Staphylococcus epidermidis (стафилококки, резистентные к метициллину, также устойчивы и к цефазолину), β-гемолитические стрептококки группы А и прочие штаммы стрептококков (многие штаммы энтерококков резистентны к цефазолину), Streptococcus ( Diplococcus ) pneumoniae , E. coli, Proteus mirabilis, Klebsiella spp., Enterobacter aerogenes, Haemophilus influenzae. Большинство индолположительных штаммов Proteus ( Proteus vulgaris ), а также Enterobacter cloacae, Morganella morganii, Providencia rettgeri, Serratia, Pseudomonas spp. и Acinetobacter spp. резистентны к цефазолину.
При в/м введении цефазолин быстро всасывается, достигает Cmax в плазме крови через 1 ч; эффективная концентрация в плазме крови сохраняется в течение 8–12 ч после в/м и в/в введения. Около 90% цефазолина связывается с белками плазмы крови. Выделяется почками посредством клубочковой фильтрации и канальцевой секреции. Продолжительность T½ — около 2 ч. Цефазолин практически не метаболизируется в организме; большая часть введенной дозы выводится из организма с мочой. Легко проникает через плацентарный барьер в амниотическую жидкость и кровь пуповины. В очень низкой концентрации выявляется в грудном молоке. Хорошо проникает через воспаленную синовиальную оболочку.
ПОКАЗАНИЯ
инфекции, вызванные чувствительными к препарату микроорганизмами, в том числе инфекции верхних дыхательных путей, средний отит, бронхит, пневмония, инфекции моче- и желчевыводящих путей, органов малого таза, кожи и мягких тканей, костей и суставов, остеомиелит, мастит, эндокардит, сепсис, перитонит, раневые, ожоговые и послеоперационные инфекции, сифилис, гонорея, профилактика послеоперационных инфекционных осложнений в случаях повышенного риска их развития (вагинальная гистерэктомия, холецистэктомия у пациентов в возрасте старше 70 лет с острым холециститом, механической желтухой или конкрементами в желчных протоках и др).
ПРИМЕНЕНИЕ
вводят в/м и в/в (струйно или капельно). Разовая доза для взрослых при инфекциях, вызванных грамположительными микроорганизмами, составляет 0,25–0,5 г каждые 8 ч (0,75–1,5 г/сут). При инфекциях дыхательных путей средней степени тяжести, вызванных пневмококками, и инфекциях мочеполового тракта назначают по 0,5–1 г каждые 12 ч. При заболеваниях, вызванных чувствительными грамотрицательными микроорганизмами, цефазолин назначают по 0,5–1 г каждые 6–8 ч.
При тяжелых инфекциях (сепсис, эндокардит, перитонит, деструктивная пневмония, острый гематогенный остеомиелит, осложненные урологические инфекции) суточную дозу препарата можно повысить до максимальной (6 г) с интервалом между введениями 6–8 ч.
При нарушении функции почек вначале вводят в дозе 0,5 г, после чего корригируют схему лечения, снижая дозу и увеличивая интервалы между введениями цефазолина с учетом показателей уровня креатинина и азота мочевины в плазме крови. При легких (средней степени тяжести) и тяжелых инфекциях рекомендуемые дозы цефазолина составляют соответственно: при клиренсе креатинина 40–70 мг/мин и уровне азота мочевины крови 20–34 мг% — 0,25–0,5 г и 0,5–1,25 г каждые 12 ч; при клиренсе креатинина 20–40 мг/мин и уровне азота мочевины крови 35–49 мг% — 0,125–0,25 г и 0,25–0,6 г каждые 12 ч; при клиренсе креатинина 5–20 мг/мин и уровне азота мочевины в крови 50–75 мг% — 75–100 мг и 150–400 мг каждые 24 ч; при клиренсе креатинина 5 мг/мин, уровне азота мочевины в крови 75 мг% — 37,5–75 мг и 75–200 мг каждые 24 ч.
Детям с умеренным нарушением функции почек (клиренс креатинина 40–70 мл/мин) после введения цефазолина в обычной дозе назначают 60% обычной суточной дозы в 2 введения; при клиренсе креатинина 20–40 мл/мин — 25% суточной дозы цефазолина в 2 введения; при значительном нарушении функции почек (клиренс креатинина 5–20 мл/мин) суточная доза составляет 10% обычной и вводится с интервалом 24 ч.
Длительность лечения — 7–10 дней и более.
ПРОТИВОПОКАЗАНИЯ
повышенная чувствительность к цефалоспоринам.
ПОБОЧНЫЕ ЭФФЕКТЫ
возможны кожная сыпь, эозинофилия, транзиторное повышение активности трансаминаз и ЩФ в плазме крови, проявления нефротоксичности (у пациентов с нарушенной функцией почек), тошнота, рвота, симптомы колита, дисбактериоз, суперинфекция, вызванная устойчивыми возбудителями, перифлебиты при в/в введении.
ОСОБЫЕ УКАЗАНИЯ
при развитии аллергических реакций следует отменить цефалексин и назначить десенсибилизирующую терапию.
С осторожностью назначают пациентам с повышенной чувствительностью к антибиотикам пенициллинового ряда, заболеваниями пищеварительного тракта (особенно с колитом).
При применении цефазолина возможно появление положительных прямой и непрямой проб Кумбса, ложноположительной реакции на глюкозу в моче при использовании р-ра Бенедикта, р-ра Фелинга, но не при ферментативном определении.
В период беременности назначают только по жизненным показаниям. В период кормления грудью применяют с осторожностью. Безопасность применения у недоношенных и детей 1-го месяца жизни не установлена.
В случае проявления нефротоксического эффекта у пациентов с нарушенной функцией почек (повышение уровня мочевины и креатинина) дозу препарата снижают и дальнейшее лечение проводят под контролем значений указанных параметров.
ВЗАИМОДЕЙСТВИЯ
р-р цефазолина нельзя смешивать в одном объеме с другими антибиотиками.
Не применяют в сочетании с антикоагулянтами и сильнодействующими диуретиками (фуросемидом, этакриновой кислотой).
При одновременном приеме пробенецид может вызвать снижение почечной экскреции цефазолина, что приводит к продолжительному повышению концентрации его в плазме крови.
ПЕРЕДОЗИРОВКА
в случае тяжелой передозировки, особенно у больных с почечной недостаточностью, применяют гемодиализ и гемоперфузию.
Активизация патогенных бактерий приводит к распространению серьезных инфекций. По этой причине важно знать, какими антибиотиками лечение стафилококка будет эффективней всего.
Стафилококковая инфекция
Стафилококки характеризуются как шаровидные бактерии правильной формы, которые окружают человека повсюду с первых дней его жизни. 27 видов микроорганизмов по большей части являются условно-патогенными для человека, но при определенных обстоятельствах происходит их активизация и начинает распространяться инфекция.
Тяжесть заболевания определяется степень концентрации бактерий и штаммом микроорганизмов. Стафилококковая инфекция бывает нескольких типов, к самым часто диагностируемым из них относят следующие:
- Стафилококк в горле (зеве) и носу, который может появиться в любом возрасте. Антибиотики при стафилококке носа подбираются отдельно для каждого заболевшего, согласно данным по лабораторным исследованиям биологического материала пациента.
- Стафилококк в мазке, который чаще всего атакует взрослых людей в период понижения иммунитета. Лечение производится комплексной терапией, схема отдельна для мужчин и женщин.
Наибольшая опасность инфекции вызванной болезнетворными бактериями заключается в том, что микроорганизмы обладают резистентностью к антисептическим препаратам и устойчивы к некоторым антибиотикам.
Для того чтобы определить эффективные антибиотики от стрептококка и стафилококка, врач назначает антибиотикограмму и только после изучения ее результатов определяется схема лечения.
Зависимость лечения от типа инфекции
Лечение инфекции подразумевает поэтапную терапию, специалист всегда подбирает эффективный антибиотик против стафилококка индивидуально для каждого пациента, при этом учитываются отдельные особенности организма и результаты анализов.
При заболеваниях печени и почек терапия должна проходить под пристальным наблюдением врача.

Эпидеральный тип инфекции поражает кожные покровы, поэтому специалист прописывает мази, способствующие регенерации тканей, но они применяются совместно с антибиотиками. Самым опасным штаммом бактерий является золотистый стафилококк, микроорганизмы быстро размножаются в теле человека, далее начинается воспалительный процесс, способствующий повышению температуры тела.
Антибиотики при стафилококке любой формы настоятельно рекомендуется не подбирать самостоятельно, так как неподобающее лечение может привести к серьезным осложнениям. Эффективные лекарственные средства в отношении инфекции выявляются в лаборатории при антибиотикограмме.
Антибиотики от стафилококковой инфекции
Однозначно нельзя сказать, какой антибиотик убивает стафилококк, потому что каждый штамм бактерии чувствителен к определенному препарату. К самым часто используемым препаратам относятся следующие группы антибиотиков:
- пенициллиновые;
- целофаспориновые;
- макролиды;
- линкозамиды.
Лечение антибиотиками от стафилококка считается наиболее эффективным, это подтверждается результатами исследований специалистов и статистическими данными.
К препаратам пенициллиновой группы, которые снижают концентрацию патогенных бактерий в организме, относятся следующие:
Пить лекарство можно за полчаса перед или после употребления пищи, на действие активных веществ препарата это не влияет. С противопоказаниями же, необходимо ознакомиться еще до начала лечения.

Для детей и взрослых предусмотрена отдельная форма выпуска. Присутствуют и противопоказания к применению, поэтому перед употреблением советуется прочитать инструкцию вкладыш.
В случае если стафилококк был обнаружен в мочеполовых путях женщин, пациенткам вместе с антибиотиком прописывают вагинальные свечи и таблетки.
Действенные лекарства при стафилококке
В случае если результаты антибиотикограммы выявили устойчивость к пенициллинам, пациенту прописывают целофаспориновые, макролиды или линкозамиды. К самым распространенным антибиотикам целофаспориновой группы относятся следующие:


Отмечаются случаи, когда наивысшая концентрация болезнетворных бактерий была зафиксирована в желудочно-кишечном тракте. При этих условиях, дозировка приведенных препаратов может отличаться от обычной.
От бактерий невозможно оградить себя полностью, так как они участвуют в формировании естественного иммунитета. Человеку остается избегать стрессовых ситуаций и следить за рационом ежедневного питания.
При первых же подозрениях на распространение инфекции советуется обратиться к врачу за помощью.
Карпогорская центральная районная больница, с. Карпогоры, Пинежский район, Архангельская область
Гнойная хирургическая инфекция повсеместно распространена и в настоящее время не имеет тенденции к снижению. На долю гнойно-воспалительных заболеваний приходится 30-35% всех хирургических болезней [1]. Основным патогеном гнойно-воспалительных заболеваний является кокковая флора, среди которой преобладает золотистый стафилококк [2]. Изоляция штаммов золотистого стафилококка из клинического материала практически всегда свидетельствует о его этиологической значимости, с его инвазией связывают более 100 нозологических форм инфекционной патологии [3]. Данные о чувствительности золотистого стафилококка к антибактериальным препаратам противоречивы. Согласно различным исследованиям его чувствительность к фторхинолонам, цефалоспоринам и линкозимидам варьирует от 4 до 96% [4, 5].
B литературе последних лет приводятся сведения о чувствительности и резистентности стафилококка, изолированного в крупных специализированных структурных подразделениях (отделениях реанимации, ожоговых центрах и т.д.) [4, 6. 7]. Научных работ, посвященных мониторингу чувствительности золотистого стафилококка в общехирургических стационарах районных больниц, в доступной нам литературе не найдено.
Целью настоящего исследования является анализ чувствительности и резистентности золотистого стафилококка, изолированного у пациентов общехирургического отделения районной больницы за период с 2005 по 2012 г.
Чувствительными считали штаммы микроорганизмов, при которых успешной является терапия обычными дозами антибактериальных препаратов, умеренно устойчивыми – штаммы, при которых успех антибактериальной терапии возможен при использовании максимальных доз или при локализации инфекции в местах, где антибактериальный препарат накапливается в высоких концентрациях, устойчивыми – штаммы, обладающие резистентностью к антибиотику [10, 11].
Статистическая обработка полученных данных выполнена на персональном компьютере посредством электронных таблиц Microsoft Excel (Windows XP), пакетов прикладных программ StatPlus 2009 и БИОСТАТ. Для описания качественных признаков в качестве меры централизации использовали относительную частоту, выраженную в процентах, в качестве меры рассеивания – доверительные интервалы для 95% вероятности нахождения средней величины. Последние вычислялись по методу E.B. Wilson с поправкой на непрерывность. Анализ различия частот в двух независимых группах проводился путем проверки нулевой статистической гипотезы об отсутствии различий этих величин, при этом для сравнения использовались критерии χ 2 и точный критерий Фишера для малых групп признаков. Статистически значимыми признавались различия с уровнем доверительной вероятности не менее 95% (p 2 =1,8; df=6; p=0,9
Представленные данные свидетельствуют о ведущей роли золотистого стафилококка в этиологии гнойных заболеваний мягких тканей, остеомиелитов различных локализаций и инфицированных открытых и термических повреждений. Среди пациентов с гнойной инфекцией мягких тканей в 2005-2006гг (n=45) количество выделенный штаммов стафилококка составило 30 (66,7% CI 51,0; 79,6), в 2007г (n=62) – 49 (79,0% CI 66,5; 87,9), в 2008г (n=56) – 44 (78,6% CI 65,2; 88,0), в 2009г (n=59) - 36 (61,0% CI 48,3; 72,4), в 2010г (n=69) - 39 (56,5% CI 44,8; 68,2), в 2011г (n=54) - 32 (59,3% CI 45,1; 72,1), в 2012г (n=24) - 14 (58,3% CI 36,9; 77,2; χ 2 =2,7; df=6; p=0,8).
При исследовании чувствительности изолированных штаммов стафилококка к основным препаратам, использовавшимся в хирургическом отделении за отчетный период, получены следующие результаты (табл. 2).
Сравнительный анализ не выявил статистически значимых различий удельного веса чувствительных и устойчивых штаммов стафилококка к представленным природным пенициллинам, соответственно χ 2 =0,04; р=0,8 и χ 2 2 =0,9; df=3; р=0,8). Умеренная устойчивость к цефалоспоринам различалась (χ 2 =12,9; df=3; р=0,005), при этом удельный вес штаммов с умеренной устойчивостью к цефазолину был меньше, чем к цефтриаксону (χ 2 =8,2; р=0,004) и цефатаксиму (χ 2 =8,8; р=0,003). При сравнении удельного веса устойчивых и нечувствительных штаммов к представленным цефалоспоринам статистически значимых различий не выявлено ( соответственно χ 2 =1,9; df=3; р=0,6 и χ 2 =5,4; df=3; р=0,1).
Таблица 2. Характеристика чувствительности и резистентности изолированных штаммов золотистого стафилококка
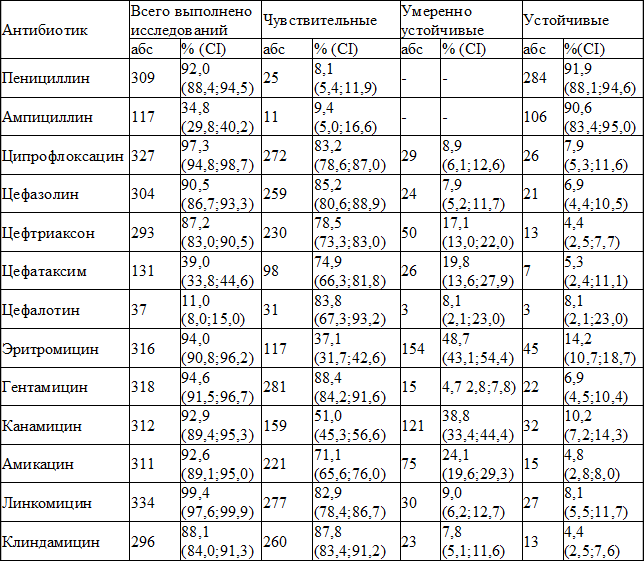
При сравнении удельного веса изолятов, чувствительных к представленным аминогликозидам, выявлены статистически значимые различия (χ 2 =18,8; df=2; p 2 =18,3; p 2 =6,1; р=0,01). Различия выявлены также при сравнении удельного веса умеренно устойчивых к аминогликозидам штаммов (χ 2 =69,6; df=2; p 2 =69,2; p 2 =35,0; p 2 =7,7; р=0,006). При сравнении удельного веса устойчивых к представленным аминогликозидам штаммов различий не выявлено (χ 2 =5,9; df=2; р=0,05). Удельный вес нечувствительных к аминогликозидам штаммов различался (χ 2 =57,6; df=2; p 2 =55,9; p 2 =18,6; p 2 =11,2; p 2 =0,2; р=0,7; χ 2 =0,1; р=0,7 и χ 2 =2,6; р=0,1).
Исследование на метициллинрезистентность выполнено у 29 (8,6%) пациентов, количество метициллинрезистентных штаммов составило 7 (24,1%). Штаммы, одновременно нечувствительные ко всему спектру представленных антибактериальных препаратов, выделены у 2 (0,6%) пациентов.
Изучена динамика изменения удельного веса чувствительных штаммов стафилококка в течение 2005-2012 г. Результаты представлены на рис. 1.
Рис. 1. Динамика изменений удельного веса чувствительных штаммов золотистого стафилококка
При анализе полученных данных статистически значимых различий удельного веса чувствительных штаммов не выявлено. Статистические показатели сравнительных хронологических изменений для гентамицина составили (χ 2 =1,8; df=6; p=0,9), линкомицина (χ 2 =2,0; df=6; p=0,9), ципрофлоксацина (χ 2 =2,3; df=6; p=0,9), цефазолина (χ 2 =0,4; df=6; p=1,0), цефотаксима (χ 2 =1,8; df=2; p=0,4), цефтриаксона (χ 2 =2,2; df=6; p=0,9), клиндамицина (χ 2 =1,4; df=5; p=0,9).
Динамика соотношений чувствительных штаммов к нечувствительным за исследованный период представлена в табл. 3.
При анализе данных табл. 3 выявлены статистически значимые различия соотношения нечувствительных штаммов стафилококка, изолированного в 2005-2012 г. к ципрофлоксацину, гентамицину, линкомицину, цефатаксиму и клиндамицину. При внутригрупповых сравнениях удельный вес нечувствительных к ципрофлоксацину штаммов, изолированных в 2007 был выше, чем в 2008 (χ 2 =10,9; df=6; p 2 =9,5;df=6; p=0,002). Удельный вес нечувствительных к линкомицину штаммов, изолированных в 2007 был больше, чем в 2005-2006 (df=6; р=0,001). Удельный вес нечувствительных к цефатаксиму штаммов, изолированных в 2010 был больше, чем в 2011г (df=2; p 2 =8,1; df=5; p=0,004), 2010 (χ 2 =8,4; df=5; р=0,004) и 2011гг (df=5; p=0,002). Прочие внутригрупповые различия не достигают уровня статистической значимости.
Показатели коэффициента нечувствительности к группе перечисленных выше антибиотиков за исследуемый период представлены в табл. 4.
Таблица 3. Динамика соотношений чувствительных штаммов стафилококка к нечувствительным за 2005-2012 г.
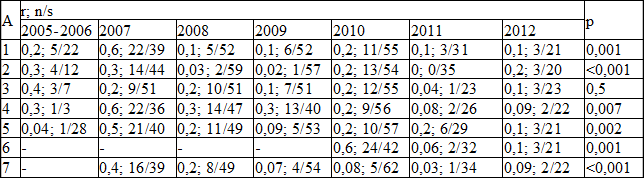
Примечание: А – антибиотик; 1 ципрофлоксацин, 2 гентамицин, 3 цефазолин, 4 цефтриаксон, 5 линкомицин, 6 цефатаксим , 7 клиндамицин
Таблица 4. Показатели коэффициента нечувствительности
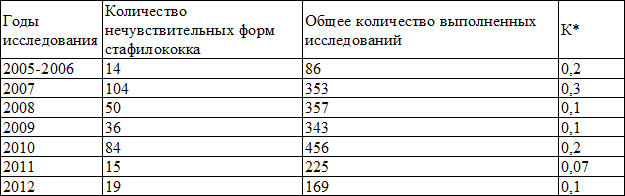
Примечание: *χ 2 =51,9;df=6; p 2 =15,4; p 2 =25,2; p 2 =29,1; p 2 =13,0; p 2 =11,7; p
Список использованных источников:
1. Медицинская микробиология, вирусология и иммунология: учебник/ под ред. Воробьева А.А. – М.: Медицинское информационное агентство, 2004. – 691 с.
2. Белобородов В.Б., Митрохин С.Д. Стафилококковые инфекции// Инфекции и антимикробная терапия, 2003, т.5, №1. С.12-18.
4. Дехнич А.В., Никулина А.А., Рябкова Е.Л. и др. Эпидемиология резистентности штаммов S.aureus, выделенных от пациентов в ОРИТ российских стационаров: результаты многоцентрового исследования// Клиническая микробиология и антимикробная химиотерапия, 2008. Т.10. №4. С.333-344.
5. Ли Э.Ч., Князев В.Н., Князев А.Н. Микробиологическая характеристика гнойной раны// Мате. VI Всеарм. Междунар. конф. "Инфекция в хирургии". - М., 2006. С.55.
6. Страчунский Л.С., Дехнич А.В., Белькова Ю.А. Сравнительная активность антибактериальных препаратов, входящих в лекарственные формы для местного применения, в отношении Staphilococcus aureus: результаты российского многоцентрового исследования// Клиническая микробиология и антимикробная терапия, 2002. Т.4. №2. С.157-163.
7. Бандурова Е.А., Шуматов В.Б., Елисеева Е.В. Локальный микробиологический мониторинг и антибиотикорезистентность основных патогенов у пациентов с хирургической патологией в отделении интенсивной терапии// Тихоокеанский медицинский журнал, 2012. №3. С. 25-29.
8. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания. МУК 4.2.1890-04// Клиническая микробиология и антимикробная химиотерапия, 2004. Т.6. №4. С.306-359.
10. Пшеничная О.А. О рациональной антибиотикотерапии больных гнойными ранами и посттравматическими остеомиелитами// Питання експериментальної та клiнiчної медицини, 2010. Т.1. №14. С.378-383.
11. Решедько Г.К., Стецюк О.У. Особенности определения чувствительности микроорганизмов диско-диффузионным методом// Клиническая микробиология и антимикробная химиотерапия, 2001. Т.3. №4. С.348-354.
12. Гостев В.В., Науменко З.С., Мартель Н.И. Антибиотикорезистентность микрофлоры ран открытых переломов// Травматология и ортопедия России, 2010. Т.55. №1. С.33-37.
Русское название
Латинское название вещества Цефазолин
Химическое название
(6R-транс)-3-[[5-Метил-1,3,4-тиадиазол-2-ил)-тио]метил]-8-оксо-7-[(1Н-тетразол-1-илацетил)амино]-5-тиа-1-азабицикло[4.2.0]окт-2-ен-2-карбоновая кислота (в виде натриевой соли)
Брутто-формула
Фармакологическая группа вещества Цефазолин
Нозологическая классификация (МКБ-10)
Код CAS
Характеристика вещества Цефазолин
Полусинтетический антибиотик группы цефалоспоринов I поколения для парентерального применения.
Используется в виде натриевой соли, представляющей собой кристаллический порошок белого или желтовато-белого цвета, с горьким соленым вкусом; легко растворим в воде, слабо растворим в метаноле и этаноле, практически нерастворим в бензоле, ацетоне, хлороформе. Молекулярная масса 476,5.
Фармакология
Взаимодействует со специфическими пенициллинсвязывающими белками на поверхности цитоплазматической мембраны, тормозит синтез пептидогликанового слоя клеточной стенки (ингибирует транспептидазу, угнетает образование поперечных сшивок цепочек пептидогликана), высвобождает аутолитические ферменты клеточной стенки, вызывая ее повреждение и гибель бактерий.
Установлена in vitro и подтверждена клинически активность в отношении грамположительных микроорганизмов — Staphylococcus aureus (включая пенициллиназопродуцирующие штаммы), Staphylococcus epidermidis, Streptococcus pyogenes (бета-гемолитические стрептококки группы А), Streptococcus pneumoniae, Corynebacterium diphtheriae, Bacillus anthracis, ряда грамотрицательных бактерий — Neisseria meningitidis, Neisseria gonorrhoeae, Shigella spp., Salmonella spp., Escherichia coli, Klebsiella spp., Proteus mirabilis, Enterobacter aerogenes, Haemophilus influenzae. Активен также в отношении Spirochaetaceae и Leptospiraceae.
Устойчивы к цефазолину большинство индолположительных штаммов Proteus spp. (Proteus vulgaris), Enterobacter cloacae, Morganella morganii, Providencia rettgeri, Serratia spp., Pseudomonas aeruginosa, Mycobacterium tuberculosis, анаэробные микроорганизмы, метициллинрезистентные штаммы Staphylococcus spp., многие штаммы Enterococcus spp.
В ЖКТ разрушается. После в/м введения добровольцам 0,5 или 1 г Cmax достигалась через 1 ч и составляла 37 и 64 мкг/мл, через 8 ч сывороточные концентрации были 3 и 7 мкг/мл соответственно. При в/в введении в дозе 1 г Cmax — 185 мкг/мл, концентрация в сыворотке через 8 ч — 4 мкг/мл. T1/2 из крови — примерно 1,8 ч при в/в и 2 ч после в/м введения. Исследования у госпитализированных пациентов с инфекционными заболеваниями показали, что значения Cmax примерно эквивалентны наблюдаемым у здоровых добровольцев. Проникает в суставы, ткани сердечно-сосудистой системы, в брюшную полость, почки и мочевыводящие пути, плаценту, среднее ухо, дыхательные пути, кожу и мягкие ткани. Концентрация в ткани желчного пузыря и желчи значительно выше, чем в сыворотке крови. В синовиальной жидкости уровень цефазолина становится сравнимым с уровнем в сыворотке примерно через 4 ч после введения. Плохо проходит через ГЭБ . Проходит через плацентарный барьер, обнаруживается в амниотической жидкости. Секретируется (в незначительных количествах) в грудное молоко. Объем распределения — 0,12 л/кг. Связывание с белками плазмы — 85%.
Не биотрансформируется. Выводится преимущественно почками в неизмененном виде: в течение первых 6 ч — примерно 60%, через 24 ч — 70–80%. После в/м введения в дозах 500 и 1000 мг максимальная концентрация в моче составляет 2400 и 4000 мкг/мл соответственно.
Канцерогенность, мутагенность, влияние на фертильность, тератогенность
Исследований мутагенного действия и длительных исследований на животных для оценки потенциальной канцерогенности не проведено.
В исследованиях репродукции у крыс, мышей и кроликов при введении в дозах, до 25 раз превышающих МРДЧ , не выявлено доказательств влияния на фертильность и эмбриотоксичного действия.
Применение вещества Цефазолин
Инфекционно-воспалительные заболевания, вызванные чувствительными микроорганизмами: инфекции верхних и нижних дыхательных путей, лор-органов ( в т.ч. средний отит), инфекции мочевыводящих и желчевыводящих путей, органов малого таза ( в т.ч. гонорея), кожи и мягких тканей, костей и суставов ( в т.ч. остеомиелит), эндокардит, сепсис, перитонит, мастит, раневые, ожоговые и послеоперационные инфекции, сифилис. Профилактика хирургических инфекций в пред- и послеоперационном периоде.
Противопоказания
Гиперчувствительность к цефалоспоринам и другим бета-лактамным антибиотикам, детский возраст до 1 мес (эффективность и безопасность применения не установлены).
Ограничения к применению
Почечная недостаточность, заболевания кишечника ( в т.ч. колит в анамнезе).
Применение при беременности и кормлении грудью
При беременности назначают только по жизненным показаниям (адекватных и строго контролируемых исследований не проведено).
Категория действия на плод по FDA — B.
При необходимости применения в период кормления грудью прекращают грудное вскармливание (цефазолин проникает в грудное молоко).
Побочные действия вещества Цефазолин
Аллергические реакции: гипертермия, кожная сыпь, крапивница, кожный зуд, бронхоспазм, эозинофилия, отек Квинке, артралгия, анафилактический шок, многоформная эритема, злокачественная экссудативная эритема (синдром Стивенса-Джонсона).
Со стороны нервной системы: судороги.
Со стороны мочеполовой системы: у больных с заболеваниями почек при лечении большими дозами (6 г/сут) — нарушение функции почек (в этих случаях дозу снижают).
Со стороны органов ЖКТ : анорексия, тошнота, рвота, диарея, боль в животе, псевдомембранозный энтероколит, транзиторное повышение активности печеночных трансаминаз (АСТ, АЛТ), ЩФ , ЛДГ; редко — холестатическая желтуха, гепатит.
Со стороны органов кроветворения: лейкопения, нейтропения, тромбоцитопения/тромбоцитоз, гемолитическая анемия.
При длительном лечении: дисбактериоз, суперинфекция, вызываемая устойчивыми к антибиотику штаммами, кандидамикоз ( в т.ч. кандидозный стоматит).
Прочие: гиперкреатининемия, увеличение ПВ; реакции в месте введения: при в/м введении — болезненность в месте введения; при в/в введении — флебит.
Взаимодействие
Не рекомендуется применять одновременно с антикоагулянтами и диуретиками, в т.ч. фуросемид, этакриновая кислота (при одновременном применении с петлевыми диуретиками происходит блокада канальцевой секреции цефазолина).
Отмечается синергизм антибактериального действия при комбинации с аминогликозидными антибиотиками. Аминогликозиды увеличивают риск развития поражения почек. Фармацевтически несовместим с аминогликозидами (взаимная инактивация).
ЛС, блокирующие канальцевую секрецию, замедляют выведение, увеличивают концентрацию в крови и повышают риск развития токсических реакций.
Пути введения
Меры предосторожности вещества Цефазолин
Пациенты, имеющие в анамнезе аллергические реакции на пенициллины, карбапенемы, могут иметь повышенную чувствительность к цефалоспориновым антибиотикам.
Во время лечения цефазолином возможно получение положительных (прямой и непрямой) проб Кумбса и ложноположительной реакции мочи на глюкозу.
Хотя диагностика и лечение респираторной патологии у детей занимают ведущее место в работе педиатра, антибактериальная терапия требуется практически всего 6–8% больным этой категории — в основном с отитом, синуситом, стрептококковой ангиной, л
Хотя диагностика и лечение респираторной патологии у детей занимают ведущее место в работе педиатра, антибактериальная терапия требуется практически всего 6–8% больным этой категории — в основном с отитом, синуситом, стрептококковой ангиной, лимфаденитом, пневмонией, а также при бронхитах, вызванных только микоплазмой и хламидиями. К сожалению, и у нас, и за рубежом далеко не изжито избыточное применение этих препаратов — их применяют подчас у 30–80% детей с острыми респираторными вирусными инфекциями (ОРВИ). Не принося пользы, такая практика повышает риск развития устойчивости флоры и побочных явлений, дезориентируя к тому же врача: не получив эффекта от антибиотика при вирусной инфекции, врач переходит на резервные препараты, которые также не дают эффекта. Поэтому основной вопрос — показаны ли антибиотики данному больному? — решать положительно следует при только доказанной (или вероятной тяжелой) бактериальной инфекции. И хотя доказать бактериальную природу острых респираторных заболеваний (ОРЗ) удается редко, накопленные данные позволяют врачу с высокой вероятностью не только выявить таких детей, но и очертить круг вероятных возбудителей и их чувствительность к антибиотикам. В табл. 1 представлены формы респираторной патологии, при которых показано и не показано назначение антибиотика, а также симптомокомплекс, позволяющий заподозрить пневмонию в отсутствие четких физикальных данных, и значения маркеров воспаления, при которых введение антибиотика оправдано.
В табл. 2 представлены основные возбудители бактериальных ОРЗ; очевидно, что спектр возбудителей ОРЗ у детей невелик, что облегчает выбор препарата, который действует на вероятных возбудителей конкретного заболевания. Эти данные для антибиотиков, которые следует применять в амбулаторных условиях, приведены в табл. 3.
К счастью, резистентность к пенициллину циркулирующих среди населения России пневмококков (менее 10% штаммов) во много раз ниже, чем, например, в странах Юго-Запада Европы (40–50%). Но следует учитывать, что среди детей в детских дошкольных учреждениях (ДДУ) и особенно в интернатах 50–60% выделенных штаммов пневмококков устойчивы к пенициллину. Пневмококки сохраняют 100-процентную чувствительность к амоксициллину (а также к цефтриаксону), но устойчивы к ко-тримоксазолу, тетрациклину, гентамицину и другим аминогликозидам. Устойчивость пневмококков к пенициллинам не связана с выработкой лактамазы (она обусловлена потерей пенициллин-связывающих белков), поэтому применение ингибитор-защищенных пенициллинов не повышает эффективности лечения. Устойчивость пневмококков к макролидам растет быстрее (до 15–20% штаммов в некоторых регионах), в меньшей степени она растет к 16-членным макролидам: джозамицину, мидекамицину, спирамицину.
Haеmophilus influenzae (как бескапсульные, так и типа b) в России чувствительны к амоксициллину, доксициклину, цефалоспоринам 2 и 3 поколений, всем аминогликозидам. Но эти возбудители не чувствительны к пенициллину, цефалексину, цефазолину, большинству макролидов — кроме азитромицина (его применение при отитах и синуситах ограничено низкой его концентрацией в соответствующих полостях).
Под влиянием лечения H. influenzae вырабатывает лактамазы, инактивирующие лактамные препараты (в т. ч. пенициллин и амоксициллин), поэтому у детей, леченных ранее (а также у детей из ДДУ), применяются с начала лечения амоксициллин/клавуланат или цефуроксим аксетил.
Бета-гемолитический стрептококк группы А (БГСА) чувствителен ко всем антибиотикам, кроме аминогликозидов, однако в ряде регионов частота устойчивых к макролидам штаммов может достигать 15%. Moraxella catarrhalis, способная продуцировать лактамазу, выделяемая обычно у леченых ранее детей, чувствительна к макролидам, цефалоспоринам, аминогликозидам, но резистентна к амоксициллину.
В амбулаторной практике назначают препараты первого выбора, если нет оснований предполагать наличие лекарственной устойчивости (табл. 4). При подавляющем большинстве форм эффективны оральные формы пенициллинов, цефалоспоринов первого-второго поколений и макролидов, их надежнее всего вводить в детской лекарственной форме — гранулах, диспергируемых таблетках Солютаб или сиропе, позволяющей точное дозирование.
С препаратов второго выбора начинают лечение только в случае предшествующей (за последние 2–3 месяца) терапии антибиотиками, а также при внутрибольничной инфекции (у ребенка, заболевшего через 1–3 суток после выписки из стационара). Наиболее используемый препарат — амоксициллин/клавуланат — Амоксиклав, Аугментин, Флемоклав Солютаб), эффективный как против пневмо- и стрептококков, так и гемофильной палочки и моракселл. Цефалоспорины второго поколения (цефуроксим аксетил — Зиннат, который намного активнее цефаклора в отношении пневмо- и стрептококков) также эффективны как препараты второго выбора. Используются возрастные дозировки, однако для амоксициллина/клавуланата и Зинната в ряде инструкций указаны заниженные (20–30 мг/кг/сут) дозы, которые могут оказаться недостаточными (см. наблюдение) — они не должны быть ниже 45–50 мг/кг/сут.
Средства третьего выбора (резервные, обычно парентеральные) применяют только в случаях полирезистентности, обычно в условиях стационара.
Не используют при респираторной патологии ко-тримоксазол и тетрациклин ввиду роста устойчивости к ним пневмотропной флоры, а также оральные цефалоспорины третьего поколения — цефтибутен (Цедекс) и цефиксим (Супракс), которые могут быть недостаточно активными в отношении кокковой флоры, в частности, пневмококков.
Оральные антибиотики не используют при тяжелых острых процессах. К ним относится гнойный синусит (протекает с отеком щеки или окологлазной клетчатки), он часто требует оперативного вмешательства, лимфаденит с признаками гнойного воспаления (спаянность с гиперемированной кожей, флюктуация). У детей с крупом важно исключить эпиглоттит — бактериальное воспаление надгортанника, также вызывающее инспираторный стридор как при вирусном крупе, но с фебрильной температурой, интоксикацией, болями при глотании при отсутствии лающего кашля, дисфонии. Для эпиглоттита характерно усиление диспноэ в положении на спине, нейтрофильный лейкоцитоз, он требует ранней интубации для профилактики асфиксии. Эти заболевания, как и осложненная плевритом и деструкцией пневмония, требуют госпитализации, перед которой следует ввести парентерально препарат широкого спектра — цефтриаксон (80 мг/кг), который должен быть в укладке скорой и неотложной помощи и у каждого участкового врача.
В остальных случаях используются оральные препараты (табл. 4). При подозрении на острый средний отит (или его диагностике при отоскопии) адекватно назначение амоксициллина в дозе 50 мг/кг/сут, или амоксициллина/клавуланата в той же дозе (преодоление устойчивости некапсульного гемофилюса и моракселл), или, у леченного недавно ребенка, в дозе 80–100 мг/кг/сут амоксициллина для преодоления возможной сниженной чувствительности пневмококков в полости среднего уха. В последнем случае желательно использовать Аугментина или Флемоклава Солютаб с соотношением амоксициллина и клавулановой кислоты 7:1. Срок лечения — 10 дней у детей до двух лет и 7 дней — у старших.
Та же лечебная тактика эффективна при негнойном бактериальном синусите, который диагностируют на второй-третьей неделе ОРЗ при сохранении заложенности носа, часто также лихорадки, болей в проекциях пазух.
Большие сложности возникают при лечении острого тонзиллита, который лишь в 30% случаев вызывается БГСА, а в остальных — аденовирусом или вирусом Эпштейна–Барр (инфекционный мононуклеоз). Для них одинаково характерны острое начало, лихорадка с ознобом или без, боль в горле при глотании, гиперемия, отечность миндалин, часто также язычка и мягкого неба, гнойный детрит в лакунах, налеты, увеличение лимфоузлов (без нагноения). Стрептококковый тонзиллит отличается от вирусного отсутствием кашля и катара, конъюнктивита, болезненностью лимфоузлов и падением температуры через 24–48 ч после назначения антибиотика. Аденовирусный тонзиллит отличают конъюнктивит и назофарингит, мононуклеоз — назофарингит, увеличение печени и селезенки, появление в крови широкоплазменных лимфоцитов. Положительный высев делает диагноз БГСА-инфекции бесспорным, как и повышение антистрептолизина-О (АСЛ-О), поэтому во всех случаях острого тонзиллита показаны такие исследования.
При доказанном стрептококковом тонзиллите, как и при неясности этиологического диагноза (особенно у детей старше 6 лет и в весеннее время), назначают один из пенициллинов, цефалексин или макролид, которые приводят к падению температуры через 14–36 часов, подтверждая диагноз стрептококкового тонзиллита; в этих случаях лечение следует продолжить до 10 дней (для азитромицина — в дозе 12 мг/кг/сут — 5 дней). При отсутствии эффекта антибиотик можно отменить, оставив лишь симптоматическое лечение.
При поражении нижних дыхательных путей (его признаки — тахипноэ или диспноэ, наличие хрипов, укорочение перкуторного звука) важно дифференцировать вирусный бронхит от пневмонии, в подавляющем большинстве случаев — бактериальной.
Инфекцию микоплазмой, обусловливающей у детей старше 5 лет около половины всех пневмоний (между пневмонией и бронхитом при неплотном легочном инфильтрате трудно провести грань), следует заподозрить при стойкой (5–10 дней) высокой температуре, обычно с нерезким токсикозом (не вызывающим сильной тревоги родителей), с необильными катаральными симптомами и конъюнктивитом, с обильными, мелкопузырчатыми (как у грудных детей с бронхиолитом) хрипами, но выслушиваемыми асимметрично. Характерный признак — отсутствие эффекта от назначения амоксициллина и других лактамных препаратов; назначение любого макролида в возрастной дозе приводит в течение 1–3 дней к апирексии и уменьшению явлений бронхита.
Для подтверждения или исключения бактериальной инфекции обычно используются так называемые маркеры бактериального воспаления — уровни лейкоцитоза, С-реактивного белка, в последнее время — также прокальцитонина. Нередко приходится видеть ребенка с ОРВИ без видимых бактериальных очагов, который получает антибиотики только потому, что у него выявлен лейкоцитоз порядка 10–15×10 9 /л. У большинства таких больных ОРВИ течет гладко без применения антибиотиков. Доказано, что только лейкоцитоз > 15×10 9 /л, абсолютное число нейтрофилов > 10×10 9 /л и/или палочкоядерных > 1,5×10 9 /л (а также С-реактивный белок (СРБ) > 30 мг/л и прокальцитонин > 2 нг/мл) более или менее надежно указывают на возможность бактериальной инфекции, тогда как более низкие цифры встречаются при вирусных инфекциях достаточно часто. Так, у детей с ОРВИ, бронхитом, крупом лейкоцитоз 10–15×10 9 /л встречается у 1/3, СРБ 15–30 мг/л — у 1/4 больных. При тонзиллитах, вызванных аденовирусами и вирусом Эпштейна–Барр, у 1/3 детей лейкоцитоз лежит в пределах 10–15×10 9 /л, а 1/3 — выше 15×10 9 /л, уровни СРБ 30–60 мг/л выявляются у 1/4 детей, а у 1/3 — выше 60 мг/л.
Следует учитывать и то, что при бактериальных инфекциях лейкоцитоз наблюдается далеко не всегда: так, при гнойном отите и типичной пневмонии у 40% больных лейкоцитоз не превышает 15´109/л, а при катаральном отите и атипичной пневмонии — у 90%.
Литература
В. К. Таточенко, доктор медицинских наук, профессор
НЦЗД РАМН, Москва
Наблюдение
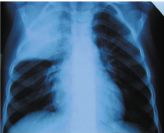

Настя К. 4,5 лет поступила на 4-й день болезни, сопровождавшейся температурой 39 °C, кашлем. Две дозы Флемоклава Солютаба по 15 мг/кг эффекта не дали.
При поступлении: навязчивый кашель, покраснение правой щеки, укорочение над правым легким сверху, хрипов нет. Кровь: Л — 31,6 ´ 109/л, п/я — 29%, с/я 57%, СОЭ 36 мм/час, СРБ 60 мг/л, ПКТ 10 нг/мл.
Доза Флемоклава Солютаба 45 мг/кг привела к падению Т° к концу дня, быстрому улучшению состояния и нормализации картины в легких через 2 недели. Курс лечения — 5 дней.
Диагноз: крупозная пневмония
Читайте также:


