Цефазолин или цефтриаксон от золотистого стафилококка

Аптечные препараты Цефазолин и Цефтриаксон относятся к группе бета-лактамных цефалоспориновых антибиотиков.
Характеристика Цефазолина
Это лекарство изготавливается в виде порошкообразной субстанции, из которой делается раствор для внутривенного и внутримышечного введения. Оно относится к первому поколению цефалоспориновых антибиотиков. Вещество было получено в 1971-ом г.
Медикамент имеет выраженное бактерицидное действие, механизм которого состоит в подавлении выработки белков клеточными стенками патогенов.
Предельный уровень вещества в плазме крови набирается за 2-3 часа после укола. Из организма лекарство выводится при мочеиспускании. Его период полувыведения не превышает 6 часов.
Цефазолин активен относительно сальмонеллы, шигеллы, кишечной палочки, гонококков, стафилококков и стрептококков. Устойчивостью к действию препарата обладают листерии, синегнойная палочка, энтеробактери и золотистые стафилококки.
Лекарство рекомендовано к применению при инфекциях:
- суставных элементов и костей;
- кожных покровов;
- желчных путей;
- дыхательной системы;
- мочевыводящей системы;
- половой системы.
Медикамент назначается пациентам, возраст которых превышает 1 месяц. Он противопоказан при индивидуальной непереносимости компонентов состава. При вынашивании плода пользоваться Цефазолином допускается лишь по исключительным показаниям и под тщательным врачебным контролем. От лактации в период терапии антибиотическим средством придется отказаться.
На фоне лечения Цефазолином могут регистрироваться следующие отрицательные проявления:
- судороги;
- аллергические реакции;
- нарушение работы пищеварительной системы;
- изменение реологических показателей крови.
Продолжительная терапия медикаментом может стать причиной развития суперфинфекции, грибкового поражения и дисбактериоза. У пациентов с почечной недостаточностью необходимо провести тщательную коррекцию дозировочного режима.

Цефазолин активен относительно сальмонеллы, шигеллы, кишечной палочки, гонококков, стафилококков и стрептококков.
В зоне введения препарата могут отмечаться локальные реакции. В более редких случаях возникает флебит.
Характеристика Цефтриаксона
Цефалоспориновый антибиотик Цефтриаксон был синтезирован в 1982-ом г. Этот медикамент производится в виде порошка для приготовления инъекционной суспензии. Он обладает выраженной бактерицидной активностью.
Предельный уровень активного компонента в плазме крови отмечается через 3-4 часа после инъекции. Из организма фармпродукт выводится вместе с желчью и мочой. Длительность применения медикаментозного средства колеблется в пределах от 4 до 14 суток.
Лекарство эффективно при инфекциях:
- кожных покровов;
- мочеполовой системы;
- брюшнины;
- респираторной системы;
- кишечника;
- костей.
Антибиотик разрешен к применению для лечения новорожденных. Режим дозирования подбирается в зависимости от массы тела ребенка. Препарат вводится внутривенно не более 1 раза в день.
При беременности лечение Цефтриаксоном разрешается в ситуациях, когда ожидаемая польза преобладает над возможными рисками осложнений. Медикамент противопоказан при гиперчувствительности к пенициллиновым и цефалоспориновым антибиотикам. С осторожностью лекарство выписывается пациентам с патологиями органов ЖКТ и почечной недостаточностью.

Цефтриаксон разрешен к применению для лечения новорожденных.
Медикамент может провоцировать возникновение нежелательных проявлений. Самые частые из них:
- кровь из носа, учащение сердцебиения;
- уменьшение концентрации лейкоцитов и лимфоцитов в сыворотке крови;
- примеси крови в урине;
- аллергические реакции в виде бронхиальных спазмов, кожного зуда и высыпаний.
Сравнение препаратов
Оба медикамента обладают одинаковой лекарственной формой – порошкообразная субстанция, из которой делается инъекционная суспензия. Антибиотики угнетают кишечную микрофлору и подавляют синтез витамина K, который принимает непосредственное участие в свертываемости крови. При одновременном применении этих лекарств с антикоагулянтами возрастает вероятность развития кровотечений.
Антибиотики обладают похожим спектром противомикробного действия. Они применяются в терапии урологических и гинекологических инфекций, ожогов, при раневых поражениях и т.д.
Препараты назначаются детям. В ряде случаев пользоваться медикаментами можно беременным и кормящим женщинам.
Препарат Цефтриаксон более эффективен при кишечных инфекционных заболеваниях, чем Цефазолин. Подбирая терапевическое средство при энтерококковых инфекциях, брюшном тифе и сальмонеллезе, предпочтение отдается Цефтриаксону.
Для лечения отитов чаще применяется Цефазолин, т.к. он более эффективно борется со стрептококками и стафилококками, являющимися возбудителями гнойной формы отита. Однако если отит был спровоцирован моракселлой, то для его лечения лучше выбирать Цефтриаксон.
Препараты обладают примерно одинаковой ценой. Так, 1 флакон средства Цефазолин стоит около 20-35 руб., а стоимость аналогичной емкости с Цефтриаксоном – около 24-29 руб.
При внутримышечных инъекциях Цефтриаксона в суспензию добавляется обезболивающее средство Лидокаин, которое увеличивает цену 1 укола. При внутривенном введении обезболивающее не требуется.
Что лучше – Цефазолин или Цефтриаксон
Подбирая фармацевтический продукт, доктор учитывает большое количество факторов. Использование Цефтриаксона сопровождается массой негативных реакций со стороны почек, крови, сердечной мышцы и ЦНС. Однако применение Цефазолина чаще провоцирует развитие аллергии. Поэтому при наличии склонности к проявлениям аллергенного характера лучше отдать предпочтение Цефтриаксону.
Можно ли заменить Цефазолин на Цефтриаксон
Эти антибиотики являются взаимозаменяемыми. Однако решение о замене должен принимать исключительно лечащий врач.
Отзывы врачей и пациентов
Юрий Колпаков (гинеколог), 54 года, Самара
Эти антибиотики цефалоспоринового ряда эффективны при многих гинекологических инфекциях. Их преимуществом является возможность назначения в период беременности. Однако принимать их нужно исключительно после беседы с медицинским экспертом. Это позволит добиться максимальной эффективности.
Инга Хлебникова, 35 лет, Псков
С помощью Цефазолина я лечила острый бронхит у своей 6-летней дочери. Медикамент помог быстро, однако в зоне инъекций на ягодичках у ребенка появились небольшие уплотнения. Пришлось заменить лекарство Цефтриаксоном. Инъекции делали внутривенно. Болезнь удалось вылечить за 6 суток. За это время даже кашель полностью пропал.
Варвара Кутагина, 33 года, Ряжск
Инъекции препарата Цефазолин в комбинации с обезболивающим медикаментом Лидокаин внутримышечно я делала при цистите. Сначала пользовалась Цефтриаксоном, но на него у меня возникла острая аллергическая реакция. Негативная симптоматика заболевания прошла спустя 2 суток.
Карпогорская центральная районная больница, с. Карпогоры, Пинежский район, Архангельская область
Гнойная хирургическая инфекция повсеместно распространена и в настоящее время не имеет тенденции к снижению. На долю гнойно-воспалительных заболеваний приходится 30-35% всех хирургических болезней [1]. Основным патогеном гнойно-воспалительных заболеваний является кокковая флора, среди которой преобладает золотистый стафилококк [2]. Изоляция штаммов золотистого стафилококка из клинического материала практически всегда свидетельствует о его этиологической значимости, с его инвазией связывают более 100 нозологических форм инфекционной патологии [3]. Данные о чувствительности золотистого стафилококка к антибактериальным препаратам противоречивы. Согласно различным исследованиям его чувствительность к фторхинолонам, цефалоспоринам и линкозимидам варьирует от 4 до 96% [4, 5].
B литературе последних лет приводятся сведения о чувствительности и резистентности стафилококка, изолированного в крупных специализированных структурных подразделениях (отделениях реанимации, ожоговых центрах и т.д.) [4, 6. 7]. Научных работ, посвященных мониторингу чувствительности золотистого стафилококка в общехирургических стационарах районных больниц, в доступной нам литературе не найдено.
Целью настоящего исследования является анализ чувствительности и резистентности золотистого стафилококка, изолированного у пациентов общехирургического отделения районной больницы за период с 2005 по 2012 г.
Чувствительными считали штаммы микроорганизмов, при которых успешной является терапия обычными дозами антибактериальных препаратов, умеренно устойчивыми – штаммы, при которых успех антибактериальной терапии возможен при использовании максимальных доз или при локализации инфекции в местах, где антибактериальный препарат накапливается в высоких концентрациях, устойчивыми – штаммы, обладающие резистентностью к антибиотику [10, 11].
Статистическая обработка полученных данных выполнена на персональном компьютере посредством электронных таблиц Microsoft Excel (Windows XP), пакетов прикладных программ StatPlus 2009 и БИОСТАТ. Для описания качественных признаков в качестве меры централизации использовали относительную частоту, выраженную в процентах, в качестве меры рассеивания – доверительные интервалы для 95% вероятности нахождения средней величины. Последние вычислялись по методу E.B. Wilson с поправкой на непрерывность. Анализ различия частот в двух независимых группах проводился путем проверки нулевой статистической гипотезы об отсутствии различий этих величин, при этом для сравнения использовались критерии χ 2 и точный критерий Фишера для малых групп признаков. Статистически значимыми признавались различия с уровнем доверительной вероятности не менее 95% (p 2 =1,8; df=6; p=0,9
Представленные данные свидетельствуют о ведущей роли золотистого стафилококка в этиологии гнойных заболеваний мягких тканей, остеомиелитов различных локализаций и инфицированных открытых и термических повреждений. Среди пациентов с гнойной инфекцией мягких тканей в 2005-2006гг (n=45) количество выделенный штаммов стафилококка составило 30 (66,7% CI 51,0; 79,6), в 2007г (n=62) – 49 (79,0% CI 66,5; 87,9), в 2008г (n=56) – 44 (78,6% CI 65,2; 88,0), в 2009г (n=59) - 36 (61,0% CI 48,3; 72,4), в 2010г (n=69) - 39 (56,5% CI 44,8; 68,2), в 2011г (n=54) - 32 (59,3% CI 45,1; 72,1), в 2012г (n=24) - 14 (58,3% CI 36,9; 77,2; χ 2 =2,7; df=6; p=0,8).
При исследовании чувствительности изолированных штаммов стафилококка к основным препаратам, использовавшимся в хирургическом отделении за отчетный период, получены следующие результаты (табл. 2).
Сравнительный анализ не выявил статистически значимых различий удельного веса чувствительных и устойчивых штаммов стафилококка к представленным природным пенициллинам, соответственно χ 2 =0,04; р=0,8 и χ 2 2 =0,9; df=3; р=0,8). Умеренная устойчивость к цефалоспоринам различалась (χ 2 =12,9; df=3; р=0,005), при этом удельный вес штаммов с умеренной устойчивостью к цефазолину был меньше, чем к цефтриаксону (χ 2 =8,2; р=0,004) и цефатаксиму (χ 2 =8,8; р=0,003). При сравнении удельного веса устойчивых и нечувствительных штаммов к представленным цефалоспоринам статистически значимых различий не выявлено ( соответственно χ 2 =1,9; df=3; р=0,6 и χ 2 =5,4; df=3; р=0,1).
Таблица 2. Характеристика чувствительности и резистентности изолированных штаммов золотистого стафилококка
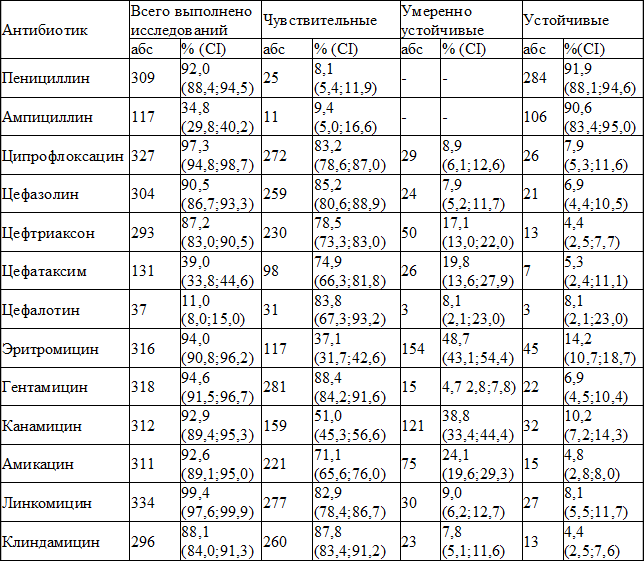
При сравнении удельного веса изолятов, чувствительных к представленным аминогликозидам, выявлены статистически значимые различия (χ 2 =18,8; df=2; p 2 =18,3; p 2 =6,1; р=0,01). Различия выявлены также при сравнении удельного веса умеренно устойчивых к аминогликозидам штаммов (χ 2 =69,6; df=2; p 2 =69,2; p 2 =35,0; p 2 =7,7; р=0,006). При сравнении удельного веса устойчивых к представленным аминогликозидам штаммов различий не выявлено (χ 2 =5,9; df=2; р=0,05). Удельный вес нечувствительных к аминогликозидам штаммов различался (χ 2 =57,6; df=2; p 2 =55,9; p 2 =18,6; p 2 =11,2; p 2 =0,2; р=0,7; χ 2 =0,1; р=0,7 и χ 2 =2,6; р=0,1).
Исследование на метициллинрезистентность выполнено у 29 (8,6%) пациентов, количество метициллинрезистентных штаммов составило 7 (24,1%). Штаммы, одновременно нечувствительные ко всему спектру представленных антибактериальных препаратов, выделены у 2 (0,6%) пациентов.
Изучена динамика изменения удельного веса чувствительных штаммов стафилококка в течение 2005-2012 г. Результаты представлены на рис. 1.
Рис. 1. Динамика изменений удельного веса чувствительных штаммов золотистого стафилококка
При анализе полученных данных статистически значимых различий удельного веса чувствительных штаммов не выявлено. Статистические показатели сравнительных хронологических изменений для гентамицина составили (χ 2 =1,8; df=6; p=0,9), линкомицина (χ 2 =2,0; df=6; p=0,9), ципрофлоксацина (χ 2 =2,3; df=6; p=0,9), цефазолина (χ 2 =0,4; df=6; p=1,0), цефотаксима (χ 2 =1,8; df=2; p=0,4), цефтриаксона (χ 2 =2,2; df=6; p=0,9), клиндамицина (χ 2 =1,4; df=5; p=0,9).
Динамика соотношений чувствительных штаммов к нечувствительным за исследованный период представлена в табл. 3.
При анализе данных табл. 3 выявлены статистически значимые различия соотношения нечувствительных штаммов стафилококка, изолированного в 2005-2012 г. к ципрофлоксацину, гентамицину, линкомицину, цефатаксиму и клиндамицину. При внутригрупповых сравнениях удельный вес нечувствительных к ципрофлоксацину штаммов, изолированных в 2007 был выше, чем в 2008 (χ 2 =10,9; df=6; p 2 =9,5;df=6; p=0,002). Удельный вес нечувствительных к линкомицину штаммов, изолированных в 2007 был больше, чем в 2005-2006 (df=6; р=0,001). Удельный вес нечувствительных к цефатаксиму штаммов, изолированных в 2010 был больше, чем в 2011г (df=2; p 2 =8,1; df=5; p=0,004), 2010 (χ 2 =8,4; df=5; р=0,004) и 2011гг (df=5; p=0,002). Прочие внутригрупповые различия не достигают уровня статистической значимости.
Показатели коэффициента нечувствительности к группе перечисленных выше антибиотиков за исследуемый период представлены в табл. 4.
Таблица 3. Динамика соотношений чувствительных штаммов стафилококка к нечувствительным за 2005-2012 г.
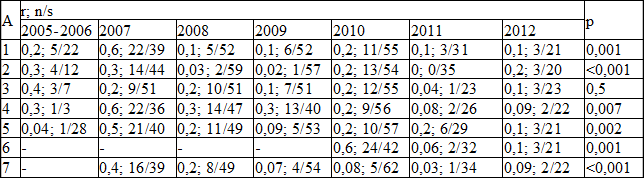
Примечание: А – антибиотик; 1 ципрофлоксацин, 2 гентамицин, 3 цефазолин, 4 цефтриаксон, 5 линкомицин, 6 цефатаксим , 7 клиндамицин
Таблица 4. Показатели коэффициента нечувствительности
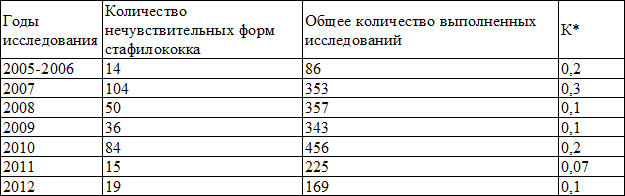
Примечание: *χ 2 =51,9;df=6; p 2 =15,4; p 2 =25,2; p 2 =29,1; p 2 =13,0; p 2 =11,7; p
Список использованных источников:
1. Медицинская микробиология, вирусология и иммунология: учебник/ под ред. Воробьева А.А. – М.: Медицинское информационное агентство, 2004. – 691 с.
2. Белобородов В.Б., Митрохин С.Д. Стафилококковые инфекции// Инфекции и антимикробная терапия, 2003, т.5, №1. С.12-18.
4. Дехнич А.В., Никулина А.А., Рябкова Е.Л. и др. Эпидемиология резистентности штаммов S.aureus, выделенных от пациентов в ОРИТ российских стационаров: результаты многоцентрового исследования// Клиническая микробиология и антимикробная химиотерапия, 2008. Т.10. №4. С.333-344.
5. Ли Э.Ч., Князев В.Н., Князев А.Н. Микробиологическая характеристика гнойной раны// Мате. VI Всеарм. Междунар. конф. "Инфекция в хирургии". - М., 2006. С.55.
6. Страчунский Л.С., Дехнич А.В., Белькова Ю.А. Сравнительная активность антибактериальных препаратов, входящих в лекарственные формы для местного применения, в отношении Staphilococcus aureus: результаты российского многоцентрового исследования// Клиническая микробиология и антимикробная терапия, 2002. Т.4. №2. С.157-163.
7. Бандурова Е.А., Шуматов В.Б., Елисеева Е.В. Локальный микробиологический мониторинг и антибиотикорезистентность основных патогенов у пациентов с хирургической патологией в отделении интенсивной терапии// Тихоокеанский медицинский журнал, 2012. №3. С. 25-29.
8. Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания. МУК 4.2.1890-04// Клиническая микробиология и антимикробная химиотерапия, 2004. Т.6. №4. С.306-359.
10. Пшеничная О.А. О рациональной антибиотикотерапии больных гнойными ранами и посттравматическими остеомиелитами// Питання експериментальної та клiнiчної медицини, 2010. Т.1. №14. С.378-383.
11. Решедько Г.К., Стецюк О.У. Особенности определения чувствительности микроорганизмов диско-диффузионным методом// Клиническая микробиология и антимикробная химиотерапия, 2001. Т.3. №4. С.348-354.
12. Гостев В.В., Науменко З.С., Мартель Н.И. Антибиотикорезистентность микрофлоры ран открытых переломов// Травматология и ортопедия России, 2010. Т.55. №1. С.33-37.

Антибиотики Цефтриаксон и Цефазолин используются для борьбы с инфекциями в мочеполовой, дыхательной и пищеварительной системах.
Характеристика Цефазолина
Цефазолин относят к антибиотикам 1 поколения. Блокирует рост бактериальных клеточных стенок. Производится в виде порошка для внутривенных и внутримышечных инъекций. В 1 флаконе содержится порошок Цефазолина 1 гр (или 0,5 г) в виде натриевой соли.
Уже через 2 часа после укола наблюдается максимальная концентрация компонентов в крови. Выводится из организма спустя 24 часа более чем 80% средства.
Назначают в таких случаях:
- при кожных инфекциях;
- при перитоните;
- при эндокардите;
- при сепсисе;
- при нарушениях в мочевыводящей системе;
- при лор-заболеваниях и в послеоперационные периоды.
Цефазолин нельзя принимать во время гриппа любой формы, при ангине, ОРЗ и ОРВИ.
В период вынашивания ребенка и грудного вскармливания назначают при острой необходимости, при этом вскармливание придется приостановить на время лечения. Детям разрешен с 1 месяца.
Препарат эффективно борется с размножением стрептококков, гонококков, кишечной палочки, стафилококков и сальмонеллы, но не всегда справляется с:
- золотистым стафилококком;
- гемофильной палочкой;
- осложненным воспалением легких;
- менингитом;
- энтеробактериями.
Продолжительное лечение данным антибиотиком может привести к дисбактериозу или грибковой инфекции.

Цефазолин нельзя принимать во время гриппа любой формы, при ангине, ОРЗ и ОРВИ.
Характеристика Цефтриаксона
Цефтриаксон относится к категории цефалоспориновых средств 3 поколения. Он эффективно борется с осложненными инфекциями, с которыми не справляются препараты 1 поколения. В 1 ампуле – 1,0 г Цефтриаксона в виде натриевой соли.
Цефтриаксон назначают против тяжелых инфекций:
- мочевыводящей системы;
- ЛОР-органов;
- мягких тканей, костей и суставов, кожи;
- половых органов;
- в кишечнике.
При бактериальном менингите, холангите или перитоните, эпиглоттите и других сложных инфекциях антибиотик разрешено назначать даже новорожденным, рассчитывая дозировку согласно весу. Препарат вводится в/в и в/м.
Для беременных лекарство не является запрещенным, если опасность от заболевания выше предполагаемых побочных эффектов от лекарства.
Действие препарата наступает спустя 3 часа после инъекции. Антибиотик выводится из организма спустя 48 часов на 30-65% с мочой, остальное – через желчный пузырь.
Если у пациента прогрессирует почечная недостаточность или есть заболевания кишечника, препарат назначают с особой осторожностью. Нередко в процессе лечения можно наблюдать усиление потливости и внезапное покраснение лица. Результатом затянувшегося приема антибиотика может стать появление грибковой инфекции.

При бактериальном менингите, холангите или перитоните, эпиглоттите и других сложных инфекциях Цефтриаксон разрешено назначать даже новорожденным.
Сравнение препаратов
Между препаратами имеются как сходства, так и отличия.
У обоих лекарств есть много сходных характеристик:
- используются только в виде уколов или капельниц;
- содержат бета-лактамное кольцо, которое растворяется в желудке благодаря бактериальным ферментам бета-лактамаз, поэтому лекарства назначают только инъекционно;
- считаются сильными антибактериальными средствами;
- распределяются в тканях и органах равномерно и сохраняют высокую концентрацию;
- производятся только в виде порошка, который разбавляется физраствором для получения жидкой консистенции;
- болезненны при в/м введении, поэтому к ним добавляют Лидокаин;
- разрешены детям с младенческого возраста и беременным женщинам;
- вводятся через одинаковый промежуток времени.
Кроме того, Цефазолин и Цефтриаксон имеют практически одинаковые противопоказания, т. е. препараты запрещены при:
- аллергических реакциях на бета-лактамные антибиотики, к которым относится не только группа цефалоспориновых, но и пенициллиновые, карбапенемовые;
- почечной недостаточности;
- патологиях печени;
- детской недоношенности;
- лактации, осложненной беременности;
- возрасте пациента более 60 лет.
При нарушенном графике дозирования, установленном врачом, или самолечении лекарства не оказывают лечебного эффекта, а становятся причиной:
- сильных приступов тошноты и рвоты;
- острых болей в области кишечника;
- развития гепатита и холестатита;
- появления грибковой инфекции.
Кроме того, от некорректного использования антибиотиков страдает система кроветворения.
Данные лекарства отличаются:
- Дозировкой. Суточная доза Цефазолина составляет: для взрослых – 1-4 г в 2-3 приема (максимум – 6 г). В качестве профилактики: за час до операции – 1-2 г или после операции та же дозировка в течение 3-5 дней. Детям с 1 месяца допускается 25-50 мг/кг в 2-3 приема (максимум 100 мг/кг). У Цефтриаксона кратность применения – 1 раз в сутки, суточная доза составляет: для взрослых – 1-2 г за 1 раз, новорожденным, которым меньше 14 дней, допускается 20-50 мг/кг за 1 раз, детям с 1 месяца до 12 лет назначают 20-80 мг/кг за 1 раз.
- Эффективностью против тяжелых инфекций (брюшной тиф, отит, сальмонеллез, золотистый стафилококк). Такие болезни лечат Цефтриаксоном, т.к. он эффективнее справляется со всеми гнойными заражениями. Однако, у него и вероятность проявления побочных эффектов выше.
- Временем создания: Цефазолин относится к 1 поколению, а Цефтриаксон – к 3.
- Болезненностью. Цефтриаксон намного болезненнее Цефазолина, но проблема решается Лидокаином, – им разбавляют антибиотик (если нет на него аллергии), а также медленным и глубоким введением лекарства в ягодичную мышцу. При внутривенных инъекциях Лидокаин нельзя добавлять в лекарство.
Цена за 1 флакон обоих препаратов порошкового вида практически одинаковая: Цефазолин стоит 23-45 руб., а Цефтриаксон 26-42 руб.
Что лучше: Цефазолин или Цефтриаксон?
Какой из этих двух антибиотиков будет использован в лечении, решает лечащий врач, опираясь на степень тяжести имеющегося заболевания, учитывая чувствительность к составляющим препаратов.
Цефазолин опасен для аллергиков, но Цефтриаксон, в свою очередь, негативно воздействует на сердце, почки и нервную систему. Переносятся препараты почти одинаково.
Цефтриаксон как более современный препарат выписывают чаще, особенно если требуется помощь при лечении тяжелых инфекций у новорожденных или недоношенных (с малым весом) детей. Но Цефазолин эффективнее при заболеваниях системы мочевыведения, инфекциях почек, эндокардите и перитоните.
Самостоятельный прием Цефтриаксона или Цефазолина запрещен. Уколы с ними разрешено делать только после консультации с врачом и составления плана лечения.
Можно ли заменить Цефазолин на Цефтриаксон
Замена Цефазолина на Цефтриаксон разрешается только врачом. Хотя оба препарата в одной категории цефалоспоринов, у них разный спектр воздействия.
Отзывы врачей и пациентов
Анна, хирург, Сочи
За многолетнюю практику назначения Цефтриаксона побочных эффектов и отрицательного воздействия антибиотика не наблюдала. Прописываю его не только стационарным больным, но и амбулаторным, т.е. дома можно колоть уколы. Цефазолин назначаю при мочевыводящих инфекциях. Препараты эффективны, быстро справляются с инфекциями. При соблюдении рекомендованных дозировок и режима введения переносятся хорошо, не вызывая побочных реакций.
Олег, терапевт, Москва
И Цефазолин, и Цефтриаксон зарекомендовали себя как хорошие антибиотики. Они помогают всем пациентам без исключения. Когда требуется вылечить не слишком тяжелую инфекцию, назначаю препарат 1 поколения, когда нужно срочно лечить осложненное инфекционное заболевание, выписываю Цефтриаксон. Обязательно предупреждаю любителей самолечения: при неверной дозе препараты могут привести к опасным последствиям.
Ольга, 35 лет, Санкт-Петербург
Впервые познакомилась с Цефтриаксоном, когда стала сильно кашлять, было тяжело дышать, оказалось – бронхит. Купила сразу лекарство, колола сама дома. Перед первым уколом сильно боялась боли, т. к. предупредили, что уколы болезненные. Но я разбавляла Лидокаином и ничего не чувствовала. Радовало и то, что уколы нужно было делать 1 раз в день. При ОРВИ дочке тоже хотела поставить укол с этим лекарством, но врач запретил и назначил Цефазолин – тоже эффективный антибиотик. Помог достаточно быстро.
Сергей, 47 лет, Тверь
Мой младший сын часто болеет, в основном ЛОР-заболеваниями. Первый раз назначали Цефазолин, который не помог: перед бактериями, поселившимися в бронхах сына, антибиотик оказался бессилен. Врач заменил его и назначил курс лечения с Цефтриаксоном. Благодаря внутривенным инъекциям улучшение наступило сразу. После пройденного курса сын почти год не болел. Хороший антибиотик.
Светлана, 23 года, Вологда
Когда новорожденной дочке назначили антибиотик Цефтриаксон, я забеспокоилась, т. к. она совсем маленькая. Тем более, сыну у подруги назначали при воспалении легких Цефазолин, не такой болезненный препарат, как Цефтриаксон. Но дочке было слишком плохо, родилась уже с инфекциями, постоянно плакала и не брала грудь. Врач посоветовала капельницу, чтобы не колоть в ягодицу. После первого дня курса все пришло в норму, – дочь взяла грудь и спокойно заснула.

Трофические язвы являются частым осложнением различных заболеваний. В основе патогенеза язвенного дефекта лежит глубокое нарушение трофики тканей кожных покровов, приводящее к образованию зоны некроза с перифокальным воспалением, отеком, нарушением микроциркуляции и иннервации [1].
Кожа является средой обитания различных микроорганизмов. Она представлена коагулазонегативными стафилококками (эпидермальным, сапрофитическим), липофильными и нелипофильными коринобактериями, анаэробными пропионобактериями. Реже встречаются коагулазопозитивные стафилококки (золотистый стафилококк), грамотрицательные бактерии (энтеробактерии). При сохраненной структуре и функции кожи нормальная микрофлора не проявляет патологического воздействия. С нарушением трофики кожи снижается ее барьерная функция и меняется микропейзаж, что ведет к гнойно-некротическим осложнениям [6,10].
У больных с нарушением венозного или артериального кровотока, на фоне отека и выраженных метаболических нарушений, образованию язвы может предшествовать механическое повреждение кожного покрова: укус насекомых, расчесы, трещины, царапины, бытовые и производственные травмы. Механические травмы при этом являются лишь пусковым моментом, с последующим развитием воспалительной реакции мягких тканей. В условиях венозного и лимфатического стаза незначительное инфицирование приводит к быстрому распространению инфекции с развитием острого индуративного целлюлита. На этом фоне площадь и глубина язвы увеличиваются, раневое отделяемое приобретает гнойный характер. Нередко отмечаются симптомы гнойно-резорбтивной лихорадки (гипертермия, лейкоцитоз, рост СОЭ и др.), свидетельствующие о наличии системной воспалительной реакции. В результате бактериальной агрессии расширяется площадь некробиотического процесса, развивается фиброз кожи и подкожной клетчатки, еще более ухудшаются лимфатический отток и микроциркуляция [1,6,10].
Антибактериальная терапия в комплексном лечении трофических язв показана при системной и/или выраженной местной воспалительной реакции. Практически у всех пациентов с длительно существующими трофическими язвами вследствие раздражения кожи обильным раневым отделяемым и различными мазевыми повязками имеет место перифокальный дерматит, пиодермия, экзема, иногда развивается рожистое воспаление. При проникновении стафилококковой инфекции глубоко в кожу развивается диффузная пиодермия, сопровождающаяся появлением гнойных фолликулов, импетиго и эрозий. Вторичное микробное поражение окружающей кожи приводит к увеличению размеров язвы и является показанием к применению антибиотиков. Обычно назначаются пенициллины, фторхинолоны, цефалоспорины и дополнительно – препараты имидазолового ряда (метронидазол). Местно используют антибактериальные мази [1,10,12]. Стандартная длительность антибактериальной терапии при венозных трофических язвах составляет 7-10 дней.
В амбулаторных условиях, как правило, не производятся микробиологические исследования раневого отделяемого трофических язв, тогда как от вида микроорганизма-возбудителя зависит характер раневого процесса и выбор антибактериальной терапии.
Возбудителями большего числа гнойно-септических заболеваний по-прежнему являются стафилококки. Обычно они чувствительны к бета-лактамным антибиотикам, макролидам, рифампицину, ко-тримоксазолу, фузидину, фосфомицину, клиндамицину. Некоторые штаммы стафилококков несут ген резистентности к бета-лактамам [16]. Маркером данного типа резистентности является резистентность к оксациллину. По данным многоцентрового исследования CERBERUS, в котором исследовались метициллинрезистентные стафилококки в 36 крупных городах России, удельный вес золотистого стафилококка резистентного к оксациллину (метициллину) варьировал от 13 до 75%. Уровень метициллинорезистентности эпидермального стафилококка (S. Epidermidis) – от 11 до 91%. Чаще всего эпидермальный стафилококк не является возбудителем инфекции, а лишь контаминирует биоматериал, но его выделение у иммунокомпрометированных больных может иметь клиническое значение и требовать назначения соответствующей антибактериальной терапии [9,11,19].
Раневая инфекция трофических язв оказывает непосредственное токсическое действие на окружающие ткани, снижает местный и общий иммунитет, вызывая специфическую микробную сенсибилизацию организма, усугубляя трофические расстройства. Учитывая все перечисленное, в первой фазе раневого процесса трофических язв результаты бактериологического исследования играют основное значение, определяющее тактику лечения и, в первую очередь, выбор антибактериального препарата [2,6].
Обычно применяемые методы определения вида микроорганизма и его антибиотикорезистентности (культуральный и диско-диффузионный соответственно) позволяют получить результат лишь на 3 сутки, поэтому для обоснованного эмпирического выбора антибактериального препарата необходимы данные локального микробиологического мониторинга видового состава и антибиотикорезистентности возбудителей.
Важно также стратифицировать пациентов по тяжести состояния и степени риска резистентных возбудителей и применять деэскалационную тактику антибактериальной терапии. При отсутствии факторов риска резистентной флоры для эмпирической антибактериальной терапии можно выбрать: внутрь – цефуроксим, амоксициллин/клавуланат; парентерально – цефазолин+/-цефтазидим; амоксициллин/клавуланат +/- цефтазидим. При тяжелом состоянии, наличии факторов риска резистентных возбудителей (предшествующие приемы антибиотиков, контакты с медицинскими учреждениями, иммуносупрессивная терапия и др.) препараты выбора должны перекрывать всех потенциальных возбудителей с учетом их вероятной резистентности: парентерально – карбапенемы (эртапенем, меропенем, имипенем, дорипенем) или ингибитор-защищенные антисинегнойные бета лактамы (пиперациллин/тазобактам, цефоперазон/сульбактам) + антибиотик с анти-MRSA активностью (цефтаролин, даптомицин, линезолид или ванкомицин). В монотерапии возможно применение тигециклина у больных средней степени тяжести, если нет риска псевдомонадной (в том числе синегнойной) инфекции. При легкой и средней степени тяжести состояния возможно проведение антибактериальной терапии пероральными препаратами, в тяжелых случаях показано внутривенное введение антибиотиков [7,8,11,18].
После идентификации возбудителя и получения антибиотикограммы необходимо провести оценку проводимой антибактериальной терапии. При выделении из раневого отделяемого оксациллин-чувствительных стафилококков препаратами выбора могут быть беталактамные антибиотики. В арсенале врача имеется достаточно препаратов как перорального, так и парентерального пути введения: цефалексин, цефуроксим, оксациллин, цефазолин, амоксициллин/клавуланат, ампициллин/сульбактам. Цефалоспорины III поколения (цефотаксим, цефтриаксон, цефоперазон, цефтазидим, цефокситин) обладают недостаточной противостафилококковой активностью [7,8,9].
При резистентности стафилококков к оксациллину все бета-лактамные антибиотики (пенициллины, цефалоспорины, карбапенемы, монобактамы) неэффективны [3]. Часто отмечается сочетанная резистентность метициллинрезистентных стафилококков к макролидам, тетрациклинам, фторхинолонам, линкозамидам, рифампицину. Препаратами выбора в таких случаях являются: ванкомицин, линезолид, цефтаролин, даптомици, тигециклин, телаванцин. [3,7,11]. Антибиотики других групп – фторхинолоны, фосфомицин, фузидин, рифампицин, макролиды, сульфаниламиды – могут назначаться лишь при подтвержденной чувствительности возбудителя. Таким образом, выбор адекватной антибактериальной терапии в случаях оксациллин/метициллин-резистентности существенно затруднен. Задача осложняется и тем, что линезолид и тигециклин обладают лишь бактериостатическим действием. В условиях нарушенной микроциркуляции страдает доставка лекарственных препаратов к очагу поражения и бактериостатические антибиотики могут оказаться неэффективными. Препаратов с бактерицидным действием, одобренных для применения при инфекции кожи и мягких тканей, немного: ванкомицин, даптомицин, цефтаролин и телаванцин. Однако, в последние годы в РФ и за рубежом большинство штаммов MRSA имеют сниженную чувствительность к ванкомицину, что ведет к его клинической неэффективности при использовании стандартного режима дозирования препарата. Детекция данного вида резистентности проводится с помощью Е-теста, позволяющего определять минимальную подавляющую концентрацию (МПК) ванкомицина. В случаях выделения штаммов со сниженной чувствительностью к ванкомицину возможно его назначение в дозе 3-4 г/сут. Исследований эффективности и безопасности при трофических язвах различной этиологии не проводилось. Возможны токсические, прежде всего нефротоксические, осложнения при данном режиме дозирования ванкомицина у больных с факторами риска. Кроме того, необходимо учитывать, что ванкомицин не активен в отношении обычных, чувствительных к оксациллину, штаммов стафилококков, что не позволяет включать его в схемы эмпирической антибактериальной терапии как универсальный антистафилококковый препарат. В отличие от ванкомицина, новые препараты с анти–MRSA активностью (даптомицин, цефтаролин, телаванцин) одинаково хорошо работают как в отношении MRSA, так и в отношении чувствительных к оксациллину штаммов стафилококков (MSSA) [3,7,15].
Резистентность к цефтазидиму – маркер выработки бета-лактамаз расширенного спектра. При выявлении у энтеробактерий резистентности к цефтазидиму не следует использовать цефалоспорины (I-IV поколения), даже в случаях их лабораторно подтвержденной чувствительности [15]. Препаратами выбора могут быть пиперациллин/тазобактам, цефоперазон/сульбактам. При детекции резистентности к карбапенемам целесообразно использовать высокие дозы антисинегнойных карбапенемов (имипенема, меропенема, дорипенема) путем продленных инфузий с дополнительным назначением ингибиторов бета-лактамаз (или препаратов их содержащих). При выделении из трофических язв псевдомонад так же необходимо учитывать данные антибиотикограммы [3,5,7,11,18]. Препаратами альтернативного выбора при выделении полирезистентных грамм-отрицательных возбудителей (энтеробактерий, псевдомогад) могут быть препараты полимиксина-Б для парентерального и местного применения [5, 7,11].
В связи с нарушением микроциркуляции, предпочтительно назначение максимальных доз антибиотиков и использование внутривенного пути введения, поэтому пациенты с трофическими язвами нижних конечностей для купирования инфекционного процесса должны проходить курс стационарного лечения [20].
В качестве местной терапии в дополнение к системной антибактериальной терапии, могут использоваться препараты бактериофагов, антисептики. Целесообразно определять чувствительность возбудителей и к бактериофагам, так как часть возбудителей к ним могут быть нечувствительны. Местное использование большинства антибиотиков в виде обкалывания, присыпания поверхности раны нецелесообразно: под действием кислой среды раневого отделяемого трофических язв они быстро расщепляются и инактивируются [3,7].
Таким образом, в 1 фазе раневого процесса результаты бактериологического исследования трофических язв играют основное значение при определении тактики лечения и, в первую очередь, выбора антибактериального препарата.
Возросший уровень резистентности микроорганизмов требует стратификации групп пациентов и дифференцированного выбора схемы антибактериальной терапии.
Антибактериальную терапию гнойных осложнений трофических язв предпочтительно осуществлять в условиях стационара в комплексе с интенсивной терапией основного заболевания, с парентеральным введением препаратов.
Читайте также:


