Влияние иммунодепрессантов на антитела к вич
14 октября 2013
- 19669
- 15,7
- 2
- 3
Распространенность СПИДа в мире на 2009 год.

Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Иммунная система
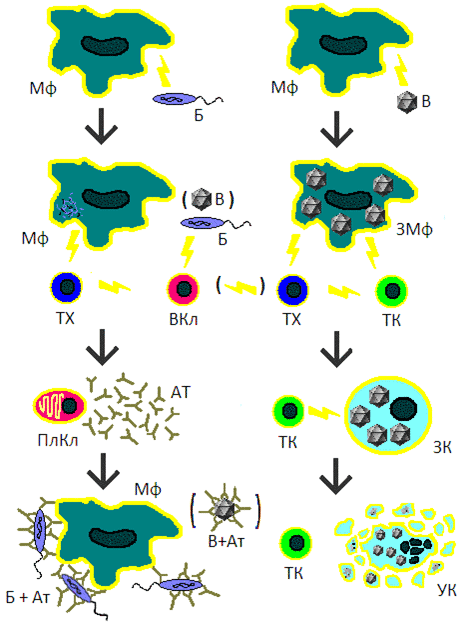
Рисунок 1. Упрощенная схема иммунного ответа. Молниями указано, как один тип клеток активирует другие. Мф — макрофаг, Б — бактерия, ТХ — Т-хелпер, ВКл — B-клетка, ПлКл — плазматическая клетка, Ат — антитела, Б+Ат — бактерия, покрытая антителами, привлекающими макрофагов, В — вирус, ЗМф — зараженный макрофаг, ТК — Т-киллер, ЗК — клетка, зараженная вирусом, УК — умирающая (апоптотирующая) клетка, В+Ат — вирус, покрытый антителами.
рисунок автора статьи
Жизненный цикл ВИЧ
Видео. Жизненный цикл ВИЧ.
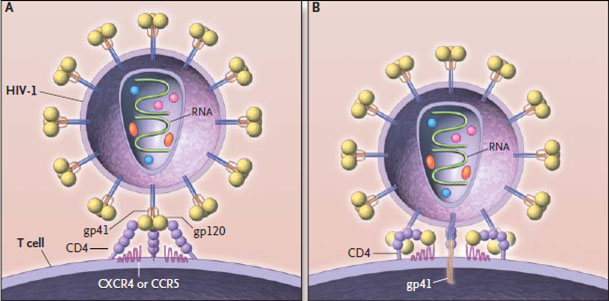
Обратная транскрипция осуществляется вирусным белком обратной транскриптазой [31]. Обратная она потому, что обычно в клетке все наоборот — информация переносится с ДНК на РНК (а с РНК — в последовательность аминокислот белков). РНК по сравнению с ДНК очень нестабильна, и поэтому для ВИЧ характерна огромная скорость мутации — в десятки тысяч раз быстрее, чем для человека. Если скорость нейтральных мутаций для ДНК составляет у различных видов и для различных генов в среднем меньше 10 −9 замен на сайт в год, то скорость мутирования генетического материала РНК-вирусов — около 10 −3 замен на сайт в год (у гена env ВИЧ: 10 −2 –10 −3 замен на сайт в год [21]). Это одна из причин, почему иммунная система не может справиться с ВИЧ — он слишком быстро изменяется.
Таким образом, после того как копия вируса в геноме клетки начинает действовать, на её поверхности появляются знакомые нам белки gp41 и gp120, в цитоплазме — остальные вирусные белки и вирусная РНК. И через некоторое время от зараженной клетки начинают отпочковываться всё новые и новые копии ВИЧ.
Способы уничтожения иммунной системы
При отпочковывании вирус использует клеточную мембрану клетки, и со временем это должно вызвать ее разрушение. К тому же, вирусный белок Vpu вызывает увеличение проницаемости мембраны клетки [6]. При активации вируса в клетке появляется неинтегрированная в геном двуцепочечная ДНК [19], наличие которой может рассматриваться клеткой как повреждение ее генетического материала и индуцировать ее смерть через апоптоз (С точки зрения организма такая клетка потенциально может стать раковой). Помимо этого, вирусные белки напрямую нарушают баланс про- и противоапоптотических белков в клетке. К примеру, вирусная протеаза p10 может разрезать противоапоптотический фактор Bcl-2. Белки Nef [26], Env [22] и Tat [24] вовлечены в возрастание количества клеточных белков CD95 и FasL, служащих индукторами апоптоза по т.н. Fas-опосредованному пути. Белок Tat положительно регулирует каспазу 8 [2] — ключевой фактор индукции апоптоза.
Если же клетки не погибли сами, они активно уничтожаются Т-киллерами. (Это стандартный ответ иммунитета на заражение любыми вирусами.)
Помимо этого, при производстве gp120 и Tat часть их выбрасывается зараженной клеткой в кровоток, а это оказывает токсическое действие на организм [4], [28]. gp120 оседает на все СD4 + -клетки (в том числе и здоровые), что имеет три последствия:
- Белок СD4 важен для взаимодействия Т-хелпера с фагоцитом, при слипании же СD4 с gp120 T-хелпер перестает выполнять эту функцию.
- На gp120 как на чужеродный белок образуются антитела; после оседания gp120 на здоровые клетки, последние маркируются антителами, и иммунная система их уничтожает [9].
- После обильного связывания Т-хелпером gp120 клетка умирает сама. Дело в том, что CD4 — это корецептор. Он усиливает сигнал от TCR (T-cell receptor) — главного белка, позволяющего выполнять Т-клеткам функцию иммунитета. В норме эти рецепторы активируются вместе. Если же активируется один тип рецепторов, но не активируется другой, это является сигналом, что что-то пошло не так, и клетка умирает посредством апоптоза.
Антитела, призванные препятствовать инфекции, в случае с ВИЧ часто, наоборот, ее усиливают [28]. Почему так происходит — не совсем понятно. Одну причину мы рассмотрели выше. Возможно, дело в том, что антитела сшивают несколько вирусных частиц вместе, и в клетку попадает не один, а сразу много вирусов. Помимо этого, антитела активируют клетки иммунитета, а в активированной клетке вирусные белки синтезируются быстрее.
Вдобавок, gp120 и gp41 имеют участки, похожие на участки некоторых белков, участвующих в иммунитете (например, MHC-II [25], IgG [23], компонент системы комплемента Clq-A [14]). В результате на эти участки образуются антитела, способные помимо вируса маркировать совершенно здоровые клетки (если на них будут эти белки), с соответствующими для них последствиями.
Так как на поверхности зараженной клетки появляется gp120, то она, как и вирусная частица, будет сливаться с другими СD4-содержащими клетками, образуя огромную многоядерную клетку (синцитий), неспособную выполнять какие-либо функции и обреченную на смерть.
На самом деле, помимо Т-хелперов, СD4 содержатся во множестве других клеток — предшественниках Т-киллеров/Т-хелперов, дендритных клетках, макрофагах/моноцитах, эозинофилах, микроглии (последние четыре — разновидности фагоцитов), нейронах (!), мегакариоцитах, астроцитах, олигодендроцитах (последние две — клетки, питающие нейроны), клетках поперечно-полосатых мышц и хорионаллантоиса (присутствует в плаценте) [29]. Все эти клетки способны заражаться ВИЧ, но сильно токсичен он лишь для Т-хелперов. Это и определяет основное клиническое проявление СПИДа — сильное снижение количества Т-хелперов в крови. Однако для других клеток заражение тоже не проходит бесследно — у больных СПИДом часто снижена свертываемость крови, имеются неврологические и психиатрические отклонения [16], наблюдается общая слабость.
Пути заражения ВИЧ
Внимание! Ввиду того, что СПИД является венерическим заболеванием, информация, приведенная в этом разделе, может вас оскорбить либо вызвать неприятные эмоции при прочтении. Будьте осторожны.
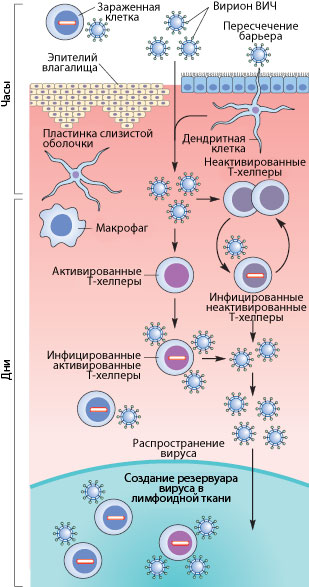
Рисунок 3. Пути проникновения ВИЧ в организм при половом контакте. Слева указано примерные временные рамки каждого этапа.
Как же происходит первичное заражение человека ВИЧ? Думаю, что с переливанием крови или с использованием общего шприца при употреблении наркотиков читателю все понятно — вирус доставляется напрямую из зараженной крови в здоровую. При вертикальном способе передачи инфекции (от матери к ребенку) заражение может произойти во время внутриутробного развития, в момент родов или в период кормления ребенка грудью (т.к. вирус и зараженные вирусом клетки содержатся в молоке матери) [17], [20]. Тем не менее, даже у ребенка, рожденного от ВИЧ-инфицированной матери, есть шанс остаться здоровым, особенно если мать использует ВААРТ (высокоактивную антиретровирусную терапию) [5]. А почему же люди заражаются при половом контакте?
Механизмы передачи вируса при половом акте не до конца ясны. Тем не менее, они понятны в общих чертах. Итак, рассмотрим барьеры, которые необходимо преодолеть вирусу, чтобы добраться до макрофагов и Т-хелперов. К сожалению, рассматривать особо нечего: барьер только один — это слой эпителиальных клеток и вырабатываемая ими слизь, находящиеся во влагалище (а также пенисе, прямой кишке, глотке). Барьер этот тонок — он может быть всего одну клетку в толщину, — но для вируса труднопреодолим, доказательством чего может служить сравнительно небольшой процент заражений — примерно 1–2 случая на 100 половых контактов. Итак, и какими же путями преодолевает вирус это препятствие?
Наиболее очевидный механизм — это микротравмы. При обычном половом контакте, а особенно при анальном сексе, почти неизбежно появляются микротрещины; при наличии же венерических заболеваний часто возникают изъязвления слизистой. Через эти микротравмы вирус, содержащийся в сперме и влагалищном секрете, может проникнуть к иммунокомпетентным клеткам [17], [20].
Помимо дендритных клеток, в кишечнике существует другой тип клеток, предназначенный для ознакомления организма с антигенами внешней среды. Это так называемые М-клетки, пропускающие через себя довольно крупные объекты неповрежденными из просвета кишечника. В т.ч. через них может проходить и вирион ВИЧ.
Свой вклад в заражение вносит и провоспалительный процесс, в норме присутствующий в женских половых путях из-за наличия в них спермы. Благодаря ему Т-клетки подвержены активации, что способствует их восприимчивости к инфекции.
Итак, риск заразиться ВИЧ возрастает в ряду (Классический секс → Анальный секс → переливание крови / использование общих шприцов при принятии наркотиков). Что же касается орального секса, то весьма небольшой шанс заразиться есть только у принимающей стороны — слюна и тем более желудочный сок инактивирует ВИЧ. Теоретически, этим способом может заразиться и мужчина, но для этого необходимы ранки на пенисе.
При поцелуях и обычных бытовых контактах вирус не передается — он очень неустойчив в окружающей среде .
Заключение
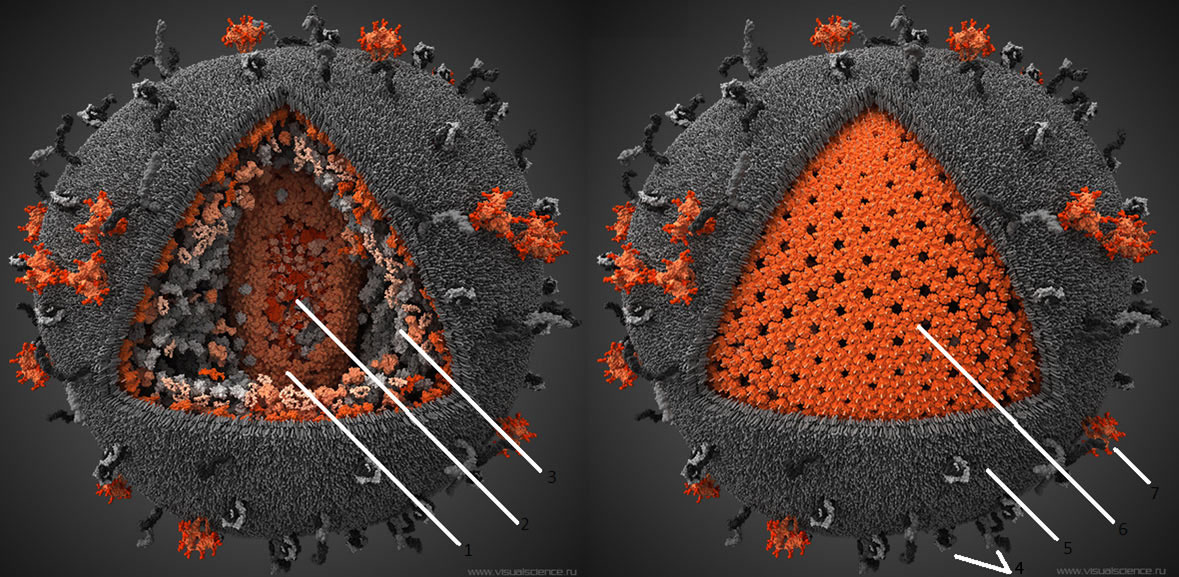
10000 нуклеотидов в каждой. Всего геном включает девять генов, которые в результате альтернативного сплайсинга кодируют 15 различных белков. 3 — Различные белки, захваченные вирусом из хозяйской клетки. 4 — Человеческие белки, обычно находящиеся на поверхности мембраны клеток. Захваченые в результате отпочковывания, они увеличивают вирулентность вируса. 5 — Внешняя оболочка ВИЧ, ведущая свое происхождение от цитоплазматической мембраны клетки, от которой когда-то отпочковался вирион. 6 — Матрикс, образованный тримерами белка р17. 7 — Тримерные комплексы белков gp120 и gp41, при помощи которых вирус проникает в клетку. На поверхности среднего вириона насчитывается около 20 таких тримеров. Чтобы увидеть рисунок в полном размере, нажмите на него.
. Все эти факты позволяют надеяться, что вскоре ВИЧ, как и оспа, останется в прошлом.
Для скрининга (т.е. быстрого и массового тестирования) применяется метод ИФА или ИХЛА. Для подтверждения диагноза применяется иммуноблот.
У лиц с диагностированной ВИЧ-инфекцией применяется количественный метод ПЦР на РНК ВИЧ, он позволяет ответить на вопрос сколько вируса в крови. Его так же не следует применять для диагностики.
Оптимально сделать два теста: через 6 недель и через 12 недель (3 месяца, если округлить до целых месяцев) после риска — достоверность отрицательного результата будет предельно близка к 99,9 %. Тест через любой более длительный срок тоже будет достоверен.
На любых сроках от потенциально опасной ситуации после 6-12 недель ИФА не увеличивает и не теряет своей надежности, оставаясь точным методом диагностики и через год, и через два и далее. В очень редких случаях диагностические проблемы могут возникать у очень тяжелых, фактически терминальных пациентов, с развернутой картиной СПИДа. Подробнее можно почитать об этом здесь, также там даны ответы на вопросы о т.н. поздней сероконверсии.
Существует много мест, где вы можете пройти тест на ВИЧ: в поликлинике, в кабинете частного врача, больницах, клиниках планирования семьи и в местах, специально отведенных для тестирования на ВИЧ.
Всегда старайтесь пройти тестирование там, где проводится консультирование. В некоторых местах имеются услуги по консультированию и тестированию на дому, которые могут включать консультирование пар и оказание им поддержки для безопасного раскрытия результатов после тестирования.
ИФА или ИХЛА тест на ВИЧ. Это название технологии теста. Конкретное название оборудование будет написано на упаковке теста, например, Abbot ARCHITECT HIV Ag/Ab Combo.
Да, можно. Первый тест даст уже очень высокую предварительную достоверность, что важно для диагностики, и, кроме того, при отрицательном результате позволяет легче переждать срок до финального теста через 3 месяца.
Это период между заражением ВИЧ и появлением обнаруживаемых антител к вирусу.
ВИЧ может передаваться другим людям во время периода окна, даже если тест на ВИЧ не показал, что у вас ВИЧ-инфекция.
Для тестов, определяющих и антитела и антигены — практически полная, для тестов только на антитела — примерно на уровне 95%.
Нет, требуется подтверждение другим методом. Подтверждающим методом для диагностики ВИЧ-инфекции сегодня является непрямая иммунофлюоресценция (РНИФ, иммуноблот, вестерн-блот). Иммуноблот демонстрирует высокую чувствительность (99,3 — 99,7 %) и специфичность (99,7 %), но так как метод определяет иммуноглобулины класса G, то с момента инфицирования результат может быть ложноотрицательным до трех недель.
Это значит, что ВИЧ у Вас нет.
Вам необходимо повторить иммуноблот через 2-3 месяца после первого. Если он будет отрицательным или останется неопределенным, то ВИЧ можно исключить. Иммуноблот может быть отрицательным или сомнительным сразу после инфицирования в пределах 4-8 недель, именно для этого его нужно повторить.
Да, у вас, к сожалению, ВИЧ. Не может.
ВИЧ у Вас нет. Ваши симптомы к ВИЧ отношения не имеют. С любой непонятной симптоматикой нужно обращаться к врачам очно.
Да, возможно. Первый ИФА (ИХЛА) Ат+Аг тест можно сделать уже через 3 недели после риска, его достоверность будет высокой. Если есть лишние деньги, то можно сделать тест ПЦР ДНК качественный на ВИЧ через 2 недели после риска, его результат тоже даст высокую предварительную достоверность.
ВИЧ у Вас нет. Со СПИДофобией нужно обратится к психиатру очно.
Иммуноферментный анализ (ИФА) и иммунохемилюминесцентный анализ (ИХЛА) это два способа забить гвоздь, большим красным, или средним зеленым молотком. Результат один и тот же — взаимодействие антигена с антителом или отсутствие такового. Т.е. информация — забитый гвоздь — в итоге одна и та же.
Обычно указания на ИХЛА в отношении диагностики ВИЧ носит характер артефакта, и на самом деле речь идет об ИФА. Т.е. с одной стороны — разницы нет, с другой — правильнее оперировать не названием метода, а названием тест-системы.
Антиген определяется, если известно, что это тест 4-го поколения, если в названии теста фигурируют слова или буквы: антиген, antigen, аг, ag.
Все современные тесты — это тесты 3-го (без антигена) или 4-го (с антигеном). Более старые тест-системы не производятся и не используются уже как минимум лет пять. Все современные тесты дают полную достоверность через 12 недель после риска, независимо от их обозначений и поколений.
Да, все современные специализированные ИФА-системы выявляют ВИЧ-1 и ВИЧ-2.
Тест-системы 4 поколения способны обнаружить не только антитела к ВИЧ, которые организм вырабатывает в ответ на инфекцию, но и непосредственно ВИЧ, посредством выявления вирусного белка p24. Белок p24 может быть определен очень рано, но его уровень в крови в период после инфицирования постепенно снижается, но одновременно с этим снижением нарастает уровень антител. Все люди разные, потому назвать точный 100% минимальный срок, когда сомневаться в тесте уже нет поводов — невозможно. Однако, на сегодня есть достаточное количество исследований, которые дают нам весьма определенные ориентиры, приведем лишь несколько из них:
Тест 4 поколения может в отдельных случаях выявлять ВИЧ-инфекцию уже через неделю после инфицирования, но ориентироваться на это все же нельзя, потому как это скорее исключение. Как Вы видели выше — месяц вполне надежный срок для современных лабораторных тест-систем.
Ничего, в данном случае вы имеете дело с неким иным заболеванием, и скорее всего с тревожным или тревожно-депрессивным расстройством. Получите консультацию квалифицированного инфекциониста, а затем, если инфекционная или иная природа будет исключена, то обратитесь за помощью к психотерапевту или психиатру.
Специфичность диагностического теста – это доля верно определенных тестом заведомо отрицательных образцов.
Иначе говоря, для определения специфичности теста необходимо взять несколько тысяч заведомо здоровых людей и проверить их при помощи теста. Если на каждые 1000 образцов будет получено 10 ложных положительных результатов – то специфичность теста составит: (1000-10)/1000*100%=99%. Если количество ложных срабатываний больше, то специфичность становится меньше (т.е. хуже). Так, специфичность теста 99% означает примерно 10 ложных позитивных результатов на 1000 проверенных здоровых людей.
Внимательно изучите инструкцию и материалы предлагаемых на рынке тестов, найдите информацию о том, каким образом была проверена специфичность. Как правило, это данные по испытаниям нескольких тысяч образцов, полученных из разных географических регионов.
Чувствительность диагностического теста – это доля верно определенных тестом заведомо положительных образцов.
Иными словами, если мы возьмем 100 достоверно ВИЧ-инфицированных людей, проверим их тестом и получим 100 положительных результатов, то чувствительность теста будет равна 100%. Практически у всех тестов на рынке чувствительность 100%.
Нельзя путать понятия точности выявления положительных и отрицательных образцов. Точность выявления положительных образцов — это чувствительность теста, а точность выявления отрицательных образцов — это специфичность.
Чувствительный тест часто дает положительный результат при наличии заболевания (обнаруживает его). Однако, особенно информативен он, когда дает отрицательный результат, т.к. редко пропускает пациентов с заболеванием. Пример — ИФА.
Специфичный тест редко дает положительный результат при отсутствии заболевания. Особенно информативен при положительном результате, подтверждая (предположенный) диагноз. Пример — иммуноблот.
Логично использовать для скрининга (быстрого и дешевого тестирования большого числа пациентов) максимально чувствительный вид тестов, а вот для установления диагноза — максимально специфичные методы. Именно поэтому ИФА исторически является скрининговым, а иммуноблотом подтверждается ВИЧ-инфекция.
Важно понимать, что ложные положительные результаты существуют у всех тестов, никакой тест не может давать 100% специфичности! Результаты экспресс-тестов подлежат особой проверке и перепроверке в лабораторных условиях при помощи других методов. Результаты лабораторных ИФА тестов подлежат перепроверке методом иммуноблотинга.
Да, может. В этом случае в обязательном порядке необходимо сделать проверочный тест иммуноблот, который точно покажет есть у человека ВИЧ или нет.
Причин много и все они не известны. Самая частая причина — беременность, также такую вероятность несколько увеличивает недавние вакцинирование некоторыми иммунопрепаратами.
Может, если он сделан в период окна, который длится до 3-х месяцев после риска инфицирования.
Но, нужно понимать, что тесты 4-го поколения определяют не только антитела, но и антиген p24, который является белком вирусной оболочки, т.е. эти тесты определят ВИЧ-инфекцию, даже если антитела по каким-то причинам задерживаются.
Алкоголь, иные психоактивные вещества, любая пища, БАДы, иммуностимуляторы, иммуномодуляторы, антибиотики и любые иные препараты, стресс, полнолуние, созерцание белого коня, усталость, общая болезненность и ослабленный иммунитет, грипп, ангина и прочие заболевания — все это не оказывает значимого влияния на риски ложноотрицательного результата теста на ВИЧ.
Чувствительность тестов на ВИЧ исследована и подтверждена в реальных условиях и на больших выборках, где люди принимают алкоголь, нервничают, принимают самые разные препараты, болеют различными заболеваниями, имеют самые разные отклонения лабораторных параметров.
Нет, не означает. Ни по каким анализам, кроме теста на ВИЧ, невозможно ни исключить ни подтвердить ВИЧ-инфекцию.
Будет. Никакие препараты, кроме препаратов АРТ в качестве постконтактной профилактики не влияют на достоверность теста на ВИЧ.
Если бы доминирующие ИФА системы отдельно показывали срабатывание At или Ag линии, то мы бы знали (т.е. мы и так это знаем, но вот имели бы статистику по этому поводу), что за редким исключением выявление ВИЧ происходит по At линии, а если бы мы неким волшебным образом знали дату инфицирования, то мы бы знали, что за редким исключением мы выявляем довольно поздно, спустя многие месяцы и годы. В отдельных группах риска под влияем активных действий ситуация может чуть смещаться в сторону более раннего выявления, но это все не меняет погоды по большому счету. Т.е. реальных практических рисков феномен второго окна не несет — любой врач будет рекомендовать и принимать во внимание тестирование на тех сроках, когда с очень высокой вероятностью будет антитела в достаточных для детекции количествах.
Нет, такого не бывает. Современные скрининговые ИФА-системы выявят любой подтип из группы M и O. Представителей групп N и P зарегистрировано единичное число, их очень непросто найти даже в Камеруне, где их число чуть больше ноля, и измеряется единицами. Как только, с точки зрения эпидпроцесса, распространенность группы превысит хотя бы сотые доли процента, и будут обнаружены в за пределами африканской глуши хотя бы единичные пациенты, то и тест-системы официально подтянутся, вслед за нуждами — будут проведены широкие исследования и появятся группы и подтипы в технических характеристиках систем, то, что их нет там сегодня означает лишь то, что их нет официально. На данный момент рассматривать подобные сценарии нет смысла.
По разным оценкам от 400 до 800 тысяч камерунцев живут с ВИЧ, и мы знаем, что возможно до 0,1% являются носителями группы N. Т.е. от 400 до 800 человек на планете.
Важно: все редкие группы и подтипы ВИЧ были выявлены исходно обычным методом ИФА. То, что в технических характеристиках систем не указаны эти подтипы, говорит лишь об одно — число пациентов слишком мало, чтобы можно было бы провести стандартные исследования, для которых требуется не несколько случаев, а сотни, и официально утвердить у регулятора новые строчки в инструкции.
Экспресс-тесты на антитела к ВИЧ в США одобрены с 2002 года, в том числе ультрабыстрые тесты, чувствительность таких тестов от 93% и специфичность — от 99%. Одобренный и доступный в РФ экспресс-тест Alere Determine HIV ½ Ag/Ab Combo, значительно уступает по способности к обнаружению антигена р24 ВИЧ по сравнению с коммерческими лабораторными системами 4 поколения.
Следует учитывать, что экспресс-тесты значительно чаще лабораторных дают ложный положительный результат. Положительный прогностический результат для РФ у экспресс-тестов будет примерно 50 на 50, т.е. если экспресс-тест дает положительный результат, то в среднем, т.е. для групп низкого риска, вероятность в данном случае наличия ВИЧ-инфекции лишь 50%, и любой положительный результат обязательно требует перепроверки методом ИФА в условиях лаборатории.
Да, можно. но не не рекомендуется. Хотя за последнее десятилетие метод стал значительно дешевле и точнее, но все же он до сих пор и дорог, более длительный, и технически сложен, что предполагает большие риски ошибок. В России, так же впрочем, как и США, количественный метод ПЦР не рекомендован для скрининга и диагностики ВИЧ-инфекции в обычных случаях.
РНК обычно используется в количественных тестах для оценки вирусной нагрузки у диагностированных лиц, например для оценки эффективности терапии. ДНК — в мононуклеарных клетках, например для диагностики у детей, там, где антитела к ВИЧ матерей мешает использовать метод ИФА. И тот и другой тест могут быть и количественными и качественными. И тот и другой можно в узких случаях применить как диагностический, с учетом конкретных ограничений, которые накладывают технические параметры системы.
Да, скорее всего можете, но вы делали это зря. Выше мы писали, что метод ПЦР не применяется для скрининга, а значит нужно делать ИФА.
Мы ответим на те вопросы, которые у вас могли остаться.
Прежде, чем задать вопрос, посмотрите, нет ли ответа на него в тексте выше и соответствует ли он теме тестирования на ВИЧ. Если есть или не соответствует, то не стоит задавать вопрос снова — он не пройдет премодерацию.
- 4474
- 3,5
- 0
- 5
Моноклональные антитела — новая надежда в лечении ревматических заболеваний.




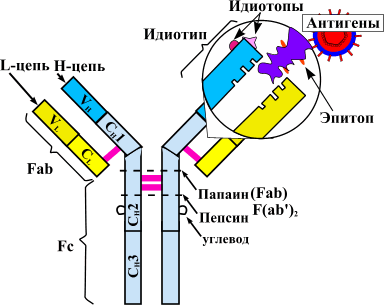
Теорию аутоиммунитета сформулировал еще столетие назад немецкий исследователь Пауль Эрлих. За последующие годы описано множество аутоиммунных заболеваний. К ним относятся ревматоидный артрит, системная красная волчанка (СКВ), системная склеродермия, миопатии, васкулиты и прочие патологии .
Болезни, ассоциированные с аутоиммунным компонентом, — серьезная проблема современного общества . Их распространенность в мировой популяции составляет примерно 5%. Заболевания быстро переходят в хроническую форму, из-за чего снижается качество жизни пациентов. Аутоиммунные патологии часто приводят к инвалидизации больных [1], [4].
Несмотря на многолетний поиск новых путей фармакотерапии, современная медицина не может предложить способов лечения, непосредственно влияющих на причину возникновения аутоиммунитета. Врачи способны лишь замедлить прогрессирование патологии и снизить выраженность клиники — провести патогенетическое и симптоматическое лечение. Для этого разработана базисная терапия, которая применяется уже многие годы. Однако не всегда проверенные препараты работают так, как надо.
Почему необходимо искать новые способы лечения?
Для лечения аутоиммунных заболеваний используют широкий арсенал противоревматических лекарств. Классическая терапия включает нестероидные противовоспалительные средства, глюкокортикоиды, цитостатики. В зависимости от особенностей развития заболевания подбирают препараты из той или иной группы [4].
- Большие иммунодепрессанты:
- глюкокортикоиды (преднизолон, дексаметазон);
- антибиотики (циклоспорин, такролимус);
- антиметаболиты (метотрексат, азатиоприн, меркаптопурин);
- цитостатики (циклофосфан).
- Малые иммунодепрессанты:
- плаквенил, хингамин;
- купренил;
- препараты золота (ауронофин);
- гепарин;
- нестероидные противовоспалительные средства.
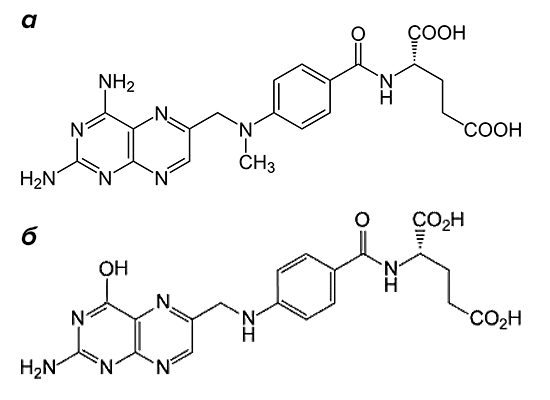
Рисунок 2. Структурные формулы метотрексата и фолиевой кислоты. Препарат (а) по строению похож на фолиевую кислоту (б). Он состоит из птеридиновых групп и парааминобензойной кислоты. Действующий компонент метотрексата отличается от структуры фолата отсутствием гидроксильной группы (–OH) и наличием дополнительного метильного радикала (–CH3).
По механизму действия метотрексат относится к антиметаболитам. Препараты этой группы тормозят физиологические реакции в организме, связываясь с ферментами и выключая их активность. Вещество, которое в норме участвует в реакции, уже не может попасть в биохимический круговорот из-за повышенной конкуренции с компонентами лекарства. Основной мишенью для действия метотрексата является фермент, расщепляющий фолиевую кислоту, — дигидрофолатредуктаза (ДГФ). Этот белок воздействует на поступающий в организм фолат, переводя его в активную форму. При этом образуется тетрагидрофолиевая кислота. Она участвуют в синтезе строительного материала для ДНК — пуриновых оснований и тимидилата.
Метотрексат вклинивается в цепочку реакций благодаря структурному сходству с молекулой фолиевой кислоты (рис. 2). Конкуренция за фермент приводит к тому, что содержание активного фолата в ткани значительно снижается. Нет строительного материала — нет и новых молекул ДНК, без которых клетки не могут размножаться. Повышенной чувствительностью к воздействию лекарства обладают те ткани, структурные элементы которых постоянно делятся. К ним относятся и компоненты костного мозга, из которых формируются будущие иммунные клетки.
Еще один важный момент в работе метотрексата связан с активностью его полиглутамированных метаболитов. Эти молекулы формируются после активации препарата непосредственно в клетках человеческого организма. Они ингибируют другие ферменты, которые взаимодействуют с фолиевой кислотой. В эту группу входят тимидилсинтетаза и АИКАР-трансамилаза. Активность производных метотрексата запускает процесс выработки аденозина. Он оказывает мощное противовоспалительное действие, благодаря чему снижается выраженность симптомов ревматоидного артрита [7].
Метотрексат удобно использовать — он легко дозируется и может назначаться длительными курсами. Кроме того, важное преимущество этого препарата — низкая цена, в сравнении с современными лекарствами импортных фармкомпаний [8]. Несмотря на все достоинства, лечение метотрексатом не всегда приводит к снижению активности заболевания. У многих пациентов использование препарата неэффективно даже в комбинации с другими классическими средствами [5]. Это подтверждается при анализе статистики. Исследования показали, что при проведении лечения метотрексатом и комбинациями базисных препаратов только половина пациентов достигла ремиссии [9], [10].
Несостоятельность классической терапии заставляет ученых искать новые способы лечения ревматоидного артрита. Стоит отметить, что, несмотря на новые разработки, борьбу с заболеванием все же начинают с назначения метотрексата и его аналогов. Дополнительные препараты используют только при высокой активности аутоиммунного процесса. У таких пациентов применение одного лекарства часто бывает неэффективно [7]. В зависимости от особенностей течения патологии подбирают подходящую схему терапии (рис. 3).
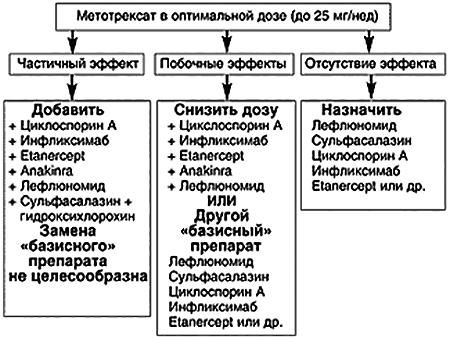
Рисунок 3. Тактика ведения пациента с ревматоидным артритом при неэффективности использования метотрексата.
Неэффективность препаратов базисной терапии встречается не только при ревматоидном артрите, но и при других заболеваниях аутоиммунного происхождения (системной красной волчанке, склеродермии, болезни Бехтерева). Это мотивирует специалистов-ревматологов разрабатывать другие лекарства и подбирать новые схемы терапии.
Генно-инженерные препараты: дополнение к базисной терапии
По-новому взглянуть на лечение аутоиммунных заболеваний позволила разработка терапевтических моноклональных антител [11]. Принципиально новый класс препаратов получен благодаря достижениям генной инженерии. Для понимания механизма действия этих лекарств стоит вспомнить о том, как работают иммунные клетки в норме и при патологии [1], [12].
При аутоиммунных заболеваниях можно подавлять сразу весь сложный механизм иммунитета, что и делают препараты классической терапии. Но это оставляет человека без защиты от вражеских агентов — бактериальных инфекций, вирусов и прочих патогенов. Поэтому предпочтительнее сохранить активность иммунной системы в целом, избавив человека от аутоагрессии определенных ее компонентов. Именно так работают новые препараты — моноклональные антитела.
- Ингибиторы ФНО (фактора некроза опухолей) — инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
- Блокаторы интерлейкиновых рецепторов — тоцилизумаб (ИЛ-6R), канакинумаб (ИЛ-1R), секукинумаб (ИЛ-17R).
- Анти-В-клеточные антитела (антитела к мембранным молекулам CD20) — ритуксимаб, белимумаб [17].
- Анти-Т-клеточные антитела (антитела к молекулам CD80 и CD86) — абатацепт [18].
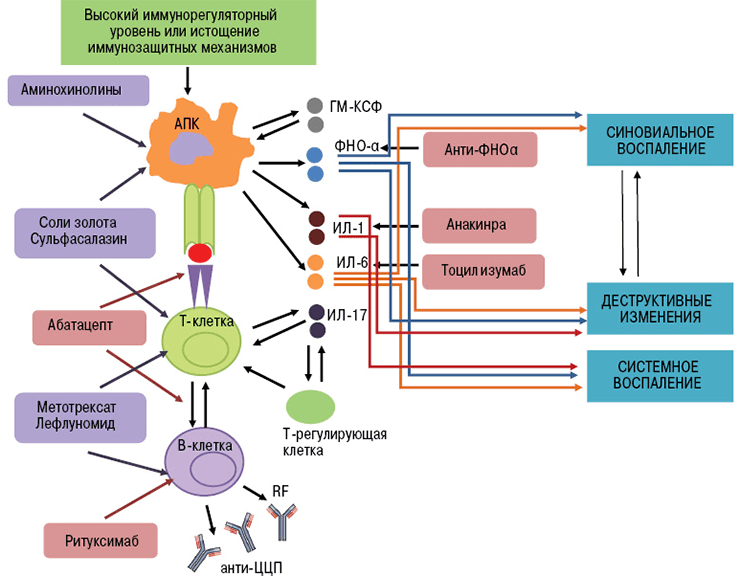
Ингибиторы фактора некроза опухолей — это первые моноклональные антитела, внедренные в ревматологическую практику. В эту группу входят инфликсимаб, этанерцепт, цертолизумаб, голимумаб, адалимумаб.
Фактор некроза опухолей (ФНО) — это провоспалительный цитокин (вещество, которое стимулирует развитие воспалительной реакции). В норме при его выделении происходит пролиферация клеток сосудов, активация макрофагов, лизис опухолевых агентов. Эти эффекты играют важную роль в защите организма от патогенов. Воспаление можно считать ответной реакцией на воздействие повреждающих факторов.
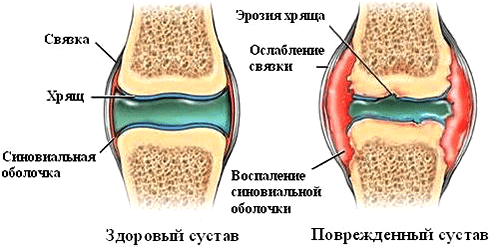
Рисунок 5. Патологические изменения в суставе при ревматоидном артрите. Аутоиммунный процесс вызывает появление эрозий, синовит (воспаление синовиальной оболочки), разрушение суставного хряща.
Такое строение связано с механизмом получения препарата. Первоначально синтезируют антитело к фактору некроза опухолей в организме мыши. Полученный иммуноглобулин специфичен к ФНО и уже может его обезвреживать, но полностью чужеродные белки вводить в организм пациентов, конечно, нельзя. Это вызовет активную иммунную реакцию — выработку антител уже против терапевтических агентов. Поэтому домены мышиного иммуноглобулина заменяют сходными участками человеческих белков. Антитела, имеющие фрагменты разного происхождения, называются химерными. Фактически, они берут лучшие качества своих предшественников. Мышиная часть обеспечивает высокую чувствительность к ФНО, а человеческие фрагменты снижают иммуногенность — вероятность развития иммунного ответа.
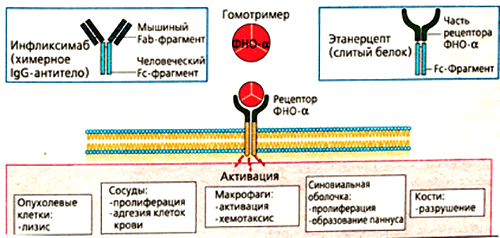
Рисунок 6. Основные эффекты ФНО и блокирующие его моноклональные антитела (инфликсимаб и этанерцепт). Мишенями для моноклональных антител являются свободная и мембраноассоциированная формы фактора некроза опухолей. Лекарства препятствуют связыванию цитокина с рецептором, благодаря чему снижается активность ревматоидного артрита.
В развитии аутоиммунного воспаления важную роль играют интерлейкины, которые, как и ФНО, относятся к провоспалительным цитокинам (рис. 7). Основными представителями этой группы являются ИЛ-6, ИЛ-1, ИЛ-17. Функция интерлейкинов — это контроль процессов дифференцировки, пролиферации и гибели (апоптоза) иммунных клеток, который осуществляется через соответствующие гены-мишени [20].
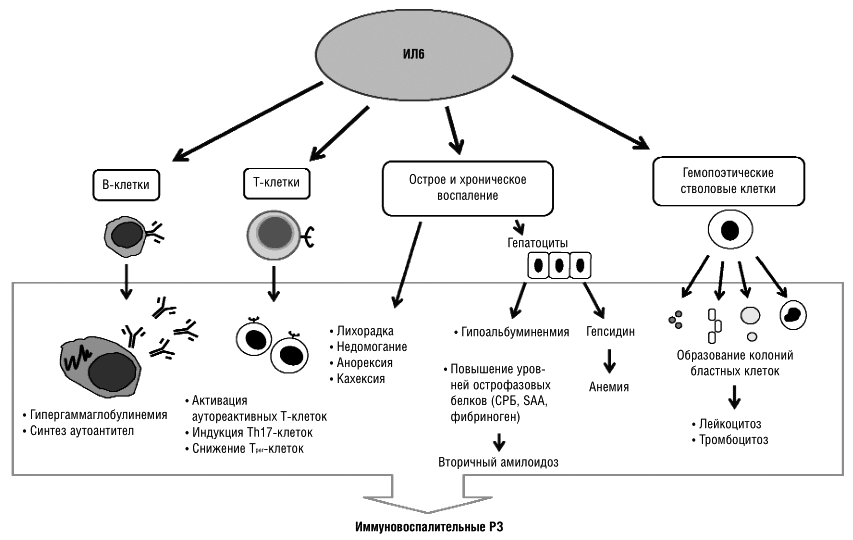
Рисунок 7. Механизм действия интерлейкинов при аутоиммунном воспалении (на примере ИЛ-6). Цитокин влияет на T- и B-лимфоциты, гемопоэтические клетки, гепатоциты. Он стимулирует выработку аутоантител В-клетками, а также формирование аутореактивных Т-клонов, которые непосредственно участвуют в аутоиммунном процессе. Влияние на костный мозг заключается в стимуляции выработки новых клеток крови — повышается число лейкоцитов и тромбоцитов. Воспаление сопровождается ответной реакцией клеток печени, появлением характерных симптомов аутоиммунного заболевания.
Тоцилизумаб — это препарат, который блокирует работу ИЛ-6. Рецептор этого вещества состоит из двух компонентов — мембранного ИЛ-6R (α-цепь) и гликопротеина g130 (β-цепь). Мембранная часть рецептора связывается с ИЛ-6, образуя устойчивый комплекс. Вместе они активируют компонент g130, вызывая изменение его структуры (гомодимеризацию). Образуется рецепторный комплекс из двух молекул g130, который в свою очередь активирует JAK1-киназу. Этот фермент запускает каскад реакций в клетке, который приводит к появлению биологического эффекта цитокина — развитию воспаления. В некоторых случаях ИЛ-6 связывает не мембранная, а растворимая форма α-цепи (рис. 8). Механизм действия рецептора при этом не меняется [21].
В основе работы тоцилизумаба лежит конкуретное ингибирование. Сигнальные молекулы активно связываются с моноклональным антителом. Вакантное место занято — интерлейкин не может образовать комплекс с рецептором, а значит, он не способен активировать процесс воспаления.
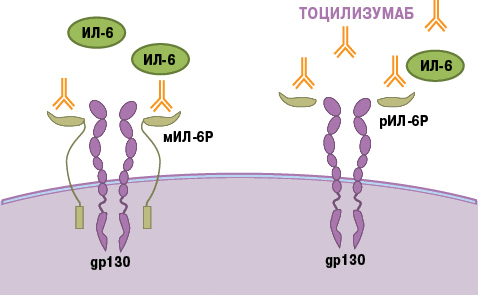
Рисунок 8. Механизм действия тоцилизумаба. Препарат связывает растворимые и мембранные рецепторы ИЛ-6, блокируя передачу сигналов.
Тоцилизумаб считается одним из самых безопасных препаратов, входящих в группу моноклональных антител. Это позволяет применять его при ювенильном идиопатическом артрите, который возникает в возрасте до 16 лет. Дети особенно остро реагируют на токсические воздействия, поэтому препараты, которые используют при их лечении, должны иметь минимальное число побочных реакций. Применение тоцилизумаба позволяет достигнуть необходимого эффекта лечения, не вызвав тяжелых осложнений.
Препараты из группы анти-B-клеточной терапии (ритуксимаб и белимумаб) блокируют активность В-лимфоцитов путем связывания их мембранных молекул CD20. Эти вещества есть только у определенных категорий В-клеток. Они специфичны для пре-В-лимфоцитов и зрелых В-лимфоцитов. CD20 нет у стволовых элементов и про-В-клеток, из которых будут образовываться новые лимфоцитарные элементы. Мембранные молекулы данного типа не содержатся и у плазматических клеток, которые вырабатывают иммуноглобулины [22].
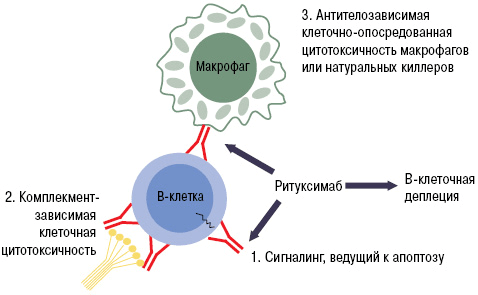
Рисунок 9. Механизм работы ритуксимаба. Fab-фрагмент моноклонального антитела связывается с CD20 на поверхности B-лимфоцита. Это запускает лизис клетки, который может осуществляться несколькими путями: через систему комплемента, программу апоптоза или агрессию натуральных киллеров и макрофагов.
Блокировка действия Т-лимфоцитов возможна благодаря особенностям их активации. Чтобы Т-лимфоцит вступил в аутоиммунный процесс и связался с антигеном, он должен получить два сигнала от антигенпрезентирующих клеток (АПК). Первый сигнал обеспечивает распознавание специфического аутоантигена Т-клеточными рецепторами. Второй сигнал — это неспецифический процесс связывания мембранных молекул CD80 и CD86 на поверхности АПК с рецептором CD28 лимфоцита. Сочетание этих взаимодействий вызывает активацию Т-клеток, которые в свою очередь стимулируют выработку провоспалительных цитокинов. Это и есть основной вклад Т-лимфоцитов в аутоиммунный процесс.
Знания о механизме активации Т-клеток использовали при разработке моноклональных антител. Основной представитель анти-Т-клеточных агентов — это абатацепт. Препарат представляет собой белок, состоящий из двух частей. Специфическая часть образована молекулой CTLA-4 (антиген 4 цитотоксических лимфоцитов). Неспецифическая область — это Fc-фрагмент человеческого иммуноглобулина G1 [23].
Воздействие абатацепта направлено как раз на неспецифический (костимулирующий) сигнал. Компонент CTLA-4 связывает белки CD80 и CD86 на поверхности антигенпрезентирующих клеток. Рецептор лимфоцита CD28 уже не может взаимодействовать с ними, из-за чего активация Т-клетки не завершается (рис. 10).
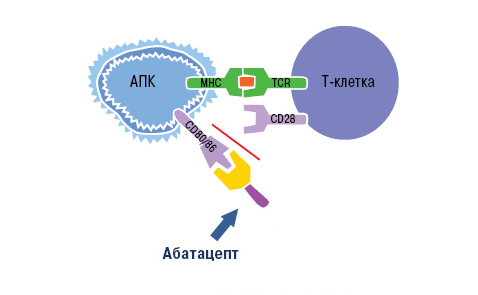
Рисунок 10. Механизм действия абатацепта. Абатацепт модулирует иммунный ответ через связывание с CD80/CD86 на антигенпрезентирующих клетках. Это препятствует связыванию CD80/CD86 с CD28 T-клеток, то есть активация Т-клеток отменяется через блокировку костимуляции.
Не всё так просто: возможные проблемы при использовании моноклональных антител
Например, одна пачка метотрексата стоит примерно 200 рублей. Цена упаковки инфликсимаба — около 43 тыс. рублей. Разница очевидна. За год лечения метотрексатом даже в максимальной дозировке пациент потратит на лекарство 1–2 тыс. рублей (в зависимости от фирмы-производителя, схемы лечения и стоимости препарата в местных аптеках). Цена годовой терапии инфликсимабом составляет примерно 700 тыс. рублей. Понятно, что самостоятельно обеспечить себя этим лекарством сможет только очень ограниченная группа пациентов.
Использование биологических препаратов допустимо в тех случаях, когда к базисным средствам у пациента развивается непереносимость. Больные испытывают тяжелое побочное воздействие лекарства, которое еще сильнее ухудшает их состояние. Применение препаратов с другим механизмом действия, в том числе и моноклональных антител, позволяет минимизировать побочные эффекты [18].
Другая сложность, с которой можно столкнуться при использовании биологических препаратов, — это побочные реакции. Параллельно с накоплением данных об эффективности использования лекарств выявляют все новые нежелательные эффекты от их применения. Большая часть таких реакций связана с процессом иммуносупрессии. Подавляя активность иммунных клеток, моноклональные антитела снижают защитную функцию организма. В первую очередь страдают противоинфекционный и противоопухолевый иммунитеты [18], [24].
Парадоксально, но применение новых лекарств против аутоиммунитета может вызвать острые аутоиммунные реакции. Все биологические препараты представляют собой белковые молекулы, которые в той или иной степени чужеродны для организма. Поэтому при проникновении терапевтических агентов в тело больного иммунитет может распознать их как антигены. Появляется активный иммунный ответ — вырабатываются антитела уже против компонентов препарата.
Несмотря на все возможные сложности, моноклональные антитела прочно вошли в регистр лекарств, применяющихся в ревматологии. Перспектива использования биологических препаратов и их место в ревматологии будет зависеть от результатов многолетних исследований, которые еще предстоит провести. Но даже сейчас можно сказать, что разработка терапевтических моноклональных антител является важным шагом на пути к победе над аутоиммунным воспалением.
Читайте также:


