Туберкулез лимфатических узлов у вич инфицированных
Проанализированы структуры заболеваемости изолированными внелегочными формами туберкулеза в зависимости от сопутствующей ВИЧ-инфекции и внелегочными формами туберкулеза с сопутствующим туберкулезом других локализаций по данным Новосибирского областного противотуберкулезного диспансера за 2015 год. Изолированные внелегочные формы туберкулеза были диагностированы у 95-ти пациентов — с одинаковой частотой регистрировали туберкулез костей и суставов и центральной нервной системы (ЦНС) — по 31,6 %. На долю туберкулеза ЦНС среди иммунокомпетентных лиц пришлось 4,1 %, у ВИЧ-инфицированных этот показатель составил 60,9 %, больных костно-суставным туберкулезом (КСТ) было больше более чем в 2 раза среди иммунокомпетентных лиц. На 3-м месте стоит туберкулез периферических лимфатических узлов — 14,7 %. На урогенитальный туберкулез суммарно пришлось всего 13,9 %. Сочетанные формы туберкулеза были выявлены у 97-ми пациентов, из них ВИЧ-инфицированных — 56 больных (57,7 %). Первично был выявлен туберкулез органов дыхания (ТОД) у 74-х из 97-ми (76,3 %), а у 23-х больных (23,7 %) заболевание манифестировало внелегочной формой туберкулеза. Среди сочетанных форм преобладают ТОД + ЦНС и ТОД + КСТ. Различное течение туберкулеза периферических лимфатических узлов в зависимости от наличия ВИЧ-инфекции демонстрируют 2 клинических наблюдения.
Ключевые слова: туберкулез, внелегочный туберкулез, лимфожелезистый туберкулез, структура заболеваемости, эпидемиология туберкулеза, лимфаденит, ВИЧ-инфекция, ко-морбидность ВИЧ и туберкулез.
Введение. Несмотря на позитивные тенденции в эпидемической ситуации по туберкулезу в целом, динамика заболеваемости внелегочными формами нестабильна [1–7].
Есть несколько парадоксов, препятствующих адекватной оценке эпидемической ситуации. Один из них — несопоставимость пропорций в зависимости от инфицирования вирусом иммунодефицита человека (ВИЧ) [8]. Согласно отчету Всемирной организации здравоохранения (ВОЗ), опубликованному в 2015 году, от туберкулеза погибло в 2014 году 1,5 млн человек (1,1 млн были ВИЧ-негативны, а 0,4 млн имели ВИЧ-инфекцию). В целом, 12 % среди всех 9,6 млн заболевших туберкулезом были ВИЧ-инфицированы [9]. Генерализованный туберкулез с поражением органов дыхания и центральной нервной системы (ЦНС) у больных с высоким уровнем первичной множественной лекарственной устойчивости возбудителя, сочетанным с ВИЧ-инфекцией, имеет тяжелые клинические проявления и протекает крайне неблагоприятно с высоким уровнем летальных исходов [10]. В Красноярском крае доля больных туберкулезом в сочетании с ВИЧ-инфекцией среди взятых на учет в противотуберкулезных учреждениях с впервые в жизни установленным диагнозом возросла с 5,3 % в 2009 году до 13,3 % в 2013 году [11]. Туберкулез, как наиболее распространенное оппортунистическое заболевание при ВИЧ-инфекции, стал главной причиной ухудшения течения болезни и смертности у этих больных. Частота выявления туберкулеза среди больных ВИЧ-инфекции в Европе составляет 5–15 %, а в развивающихся странах — 30–50 % [12].
Э. Б. Цыбикова [13] отмечает, что число субъектов Российской Федерации, имеющих высокий уровень распространения туберкулёза, сочетанного с ВИЧ-инфекцией, удвоилось по сравнению с 2000 годом и достигло 43-х. Динамика распространения туберкулёза, сочетанного с ВИЧ-инфекцией, в России в начале XXI века (2004–2013) представляет собой восходящий тренд, суммарный темп роста которого составил в 2013 году +777 % по сравнению с 2004 годом. Автор высказывает озабоченность тем фактом, что рост числа больных наблюдается преимущественно в молодых возрастных группах (от 25-ти до 44-х лет). Доля больных туберкулёзом, причиной смерти которых явилась ВИЧ-инфекция, в этих возрастных группах достигает 86 % от общего числа умерших больных. Доля больных туберкулёзным менингитом в этих возрастных группах в 2013 году достигала 70 % от их общего числа. Результаты корреляционного анализа показали, что в 83-х субъектах РФ вариации уровня смертности впервые выявленных больных туберкулёзом лёгких определяются не смертностью от туберкулёза, а смертностью от ВИЧ-инфекции и других сопутствующих заболеваний [13].
Цель исследования: определить влияние ВИЧ-инфекции на структуру внелегочного туберкулеза.
Материал и методы. Мы проанализировали структуру заболеваемости изолированными внелегочными формами туберкулеза в зависимости от сопутствующей ВИЧ-инфекции, а также структуру заболеваемости внелегочными формами туберкулеза с сопутствующим туберкулезом других локализаций по данным Новосибирского областного противотуберкулезного диспансера. Различное течение туберкулеза периферических лимфатических узлов демонстрируют два клинических наблюдения.
Результаты и обсуждение. Изолированные внелегочные формы туберкулеза были диагностированы в 2015 году у 95-ти пациентов, детальная структура представлена в табл. 1. В целом с одинаковой частотой регистрировали туберкулез костей и суставов (КСТ) и ЦНС — по 31,6 %. На третьем месте стоит туберкулез периферических лимфатических узлов (ТПЛУ) — 14,7 %. На урогенитальный туберкулез суммарно (туберкулез женских гениталий и мочевых и мужских половых органов) в прошлом году пришлось всего 13,9 %. Учитывая, что по-прежнему выявляют запущенные случае урогенитального туберкулеза [14–16], следует думать не об улучшении эпидемической ситуации, а о серьезных дефектах раннего выявления и выборе неоптимальной эмпирической терапии урогенитальных инфекций, под маской которых имеет тенденцию протекать урогенитальный туберкулез [14, 17]. Интересно, что хотя ВИЧ-инфекция считается инфекцией, передаваемой половым путем, ни у одного пациента с урогенитальным туберкулезом она диагностирована не была.
Спектр заболеваемости внелегочными формами туберкулеза в Новосибирской области в 2015 году
| Форма | Неинфицированные ВИЧ | Инфицированные ВИЧ | Всего | |||
|---|---|---|---|---|---|---|
| абс. | % | абс. | % | абс. | % | |
| Туб. ЦНС | 2 | 4,1 | 28 | 60,9 | 30 | 31,6 |
| Туб. МПО | 11 | 22,4 | 0 | 0 | 11 | 11,6 |
| Туб. ЖПО | 2 | 4,1 | 0 | 0 | 2 | 2,1 |
| УГТ | 13 | 26,5 | 0 | 0 | 13 | 13,9 |
| КСТ | 21 | 42,9 | 9 | 19,5 | 30 | 31,6 |
| ТПЛУ | 9 | 18,3 | 5 | 10,9 | 14 | 14,7 |
| Прочие формы | 4 | 8,2 | 4 | 8,7 | 8 | 8,4 |
| Всего | 49 | 100 | 46 | 100 | 95 | 100 |
Примечание: туб. ЦНС — туберкулез центральной нервной системы; туб. МПО — туберкулез мочевых и мужских половых органов; туб. ЖПО — туберкулез женских половых органов; УГТ — урогенитальный туберкулез суммарно; КСТ — костно-суставной туберкулез; ТПЛУ — туберкулез периферических лимфатических узлов
При сопоставлении структуры заболеваемости в зависимости от наличия ВИЧ-инфицирования обнаружены существенные различия, разница в пропорции достигает пятнадцатикратных величин! К примеру, на долю туберкулеза ЦНС среди иммунокомпетентных лиц в Новосибирской области в 2015 году пришлось всего 4,1 %, а у ВИЧ-инфицированных этот показатель составил 60,9 %. В ситуации, когда число ВИЧ-инфицированных ежегодно возрастает, а у каждого третьего пациента основной причиной смерти явился генерализованный туберкулез [14], этому аспекту следует уделять особое внимание. Вместе с тем больных КСТ более чем в 2 раза было больше среди иммунокомпетентных лиц; при ТПЛУ — незначительное преобладание, а заболеваемость прочими формами внелегочного туберкулеза не зависела от ВИЧ-инфекции. Наглядно спектр заболеваемости внелегочными формами туберкулеза представлен на рис. 1.
Рис. 1. Структура заболеваемости внелегочными формами туберкулеза в Новосибирской области в 2015 году
Еще одна проблема — сочетанные формы туберкулеза. И в России, и по рекомендациям ВОЗ принято считать ведущей формой туберкулез легких, поэтому, если у пациента диагностируют эту локализацию, всеми прочими пренебрегают. В Новосибирской области в 2015 году сочетанные формы туберкулеза были выявлены у 97-ми пациентов, из них ВИЧ-инфицированных было 56 больных (57,7 %). Первично был выявлен туберкулез органов дыхания (ТОД) у 74-х из 97-ми (76,3 %), а у 23-х больных (23,7 %) заболевание манифестировало внелегочной формой туберкулеза. Подробный спектр представлен в табл. 2.
Структура сочетанных форм туберкулеза в Новосибирской области в 2015 году (n = 97)
| Форма | Абс. | % |
|---|---|---|
| ТОД + УГТ | 4 | 4,1 |
| ТОД + абдоминальный туберкулез | 4 | 4,1 |
| ТОД + КСТ | 25 | 25,8 |
| ТОД + ТПЛУ | 10 | 10,3 |
| ТОД + туберкулез ЦНС | 42 | 43,4 |
| ТОД + туберкулез глаз | 4 | 4,1 |
| ТОД + множественные внелегочные локализации (КСТ + ТПЛУ + абдоминальный) | 8 | 8,2 |
| Итого | 97 | 100 |
Примечание: ТОД — туберкулез органов дыхания, ЦНС — центральная нервная система; УГТ — урогенитальный туберкулез суммарно; КСТ — костно-суставной туберкулез; ТПЛУ — туберкулез периферических лимфатических узлов
ВИЧ-инфекция не всегда означает ухудшение течения туберкулеза, иногда, напротив, мы наблюдаем парадоксально более благоприятное течение заболевания. Приводим для иллюстрации 2 примера.
Периферическая лимфатическая система инфицируется микобактерией туберкулеза (МБТ) во время лимфогенной диссеминации, но не у всех пациентов развивается клинически документированное поражение лимфоузлов. Фагоцитировавшие микобактерию макрофаги выделяют на поверхности маркеры, способствующие продукции провоспалительных цитокинов и хемокинов, чья основная роль заключается в блокировании распространения инфекции путем рекрутирования лимфоцитов и моноцитов в очаге воспаления. Однако в случае одновременного заражения вирусом иммунодефицита человека, эти сигналы значительно увеличивают как восприимчивость к инфицированию вирусом, так и способность вируса проникать внутрь клетки и реплицироваться. В отсутствие эффективного иммунного ответа МБТ может бесконтрольно размножаться внутри макрофага, приводя в конечном итоге к его гибели. Как следствие, возникает очередная волна диссеминации с преимущественным поражением органов вне бронхолегочной системы [18], особенно уязвимой у ВИЧ-инфицированных является периферическая лимфатическая система [19]. Вероятно, именно этот факт на фоне роста распространения ВИЧ-инфекции в мире послужил основой для прогноза о смещении пропорции в структуре заболеваемости внелегочным туберкулезом в сторону лимфожелезистого, однако эти прогнозы оправдались только в отношении развитых стран с низкой заболеваемостью туберкулезом. Анализ структуры заболеваемости внелегочным туберкулезом в Сибири и на Дальнем Востоке за 13 лет, проведенный нами ранее [2, 4, 6], показал относительно стабильную кривую доли ТПЛУ и даже с некоторой тенденцией к понижению. Максимальный процент больных ТПЛУ (16,5 %) был выявлен в 2008 году, в следующем году он опустился до минимума (11,0 %), затем опять вернулся на средневзвешенную позицию 12–13 %.
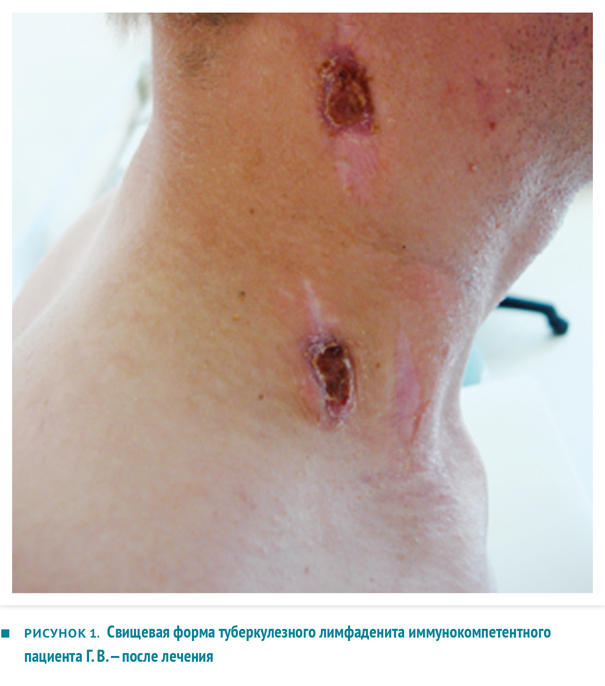
ТПЛУ, несмотря на кажущуюся относительную безопасность, является одной из самых сложных для излечения форм внелегочного туберкулеза со склонностью к непрерывно-рецидивирующему течению, абсцедированию, генерализации процесса — даже у иммунокомпетентных пациентов, не инфицированных ВИЧ. Наглядным примером является история болезни Г. В., 24 лет.
Анамнез жизни: контакт с больными туберкулезом отрицает. Простудные заболевания редко, алкоголем не злоупотребляет, материально-бытовые условия удовлетворительные. Непереносимости лекарственных веществ нет. St. localis: в надключичной области справа определяются два послеоперационных рубца. Под ними пальпируется группа увеличенных (2,5–3 см), плотных, умеренно болезненных лимфоузлов, отграниченных от окружающих тканей. В подчелюстной области — гиперемия вокруг старого послеоперационного рубца, пальпируется увеличенный несколько болезненный лимфоузел 1–1,5 см в диаметре с зоной размягчения. Диагноз при поступлении: туберкулез периферических лимфоузлов шейного отдела, абсцедирование.
Данные клинико-лабораторного обследования: M. tuberculosis в отделяемом свища люминесцентным методом не обнаружены. Посев на M. tuberculosis отделяемого свища от роста не дал. Роста неспецифической микрофлоры также не было получено.
Рентгенография органов грудной клетки в прямой проекции с томографией средостения: очаговых и инфильтративных изменений в легких не выявлено.
Больному была назначена индивидуальная схема лечения (Изониазид + Пиразинамид + ПАСК + Циклосерин + Левофлоксацин + Амикацин) в ежедневном режиме, комплексная патогенетическая терапия. На ее фоне выполнена лимфаденэктомия на шее справа и слева. Послеоперационный период протекал без осложнений. Гистологическое заключение и в июле, и в январе 2008 года — по-прежнему туберкулез, острое течение, экссудативная фаза. Только к апрелю 2009 года была достигнута относительная стабилизация процесса; полного заживления раны, тем не менее, не наступило.
Внешний вид больного Г.В. после двух лет консервативной терапии и шести хирургических вмешательств представлен на рис. 2.
Рис. 2. Свищевая форма туберкулезного лимфаденита иммунокомпетентного пациента Г. В. после лечения
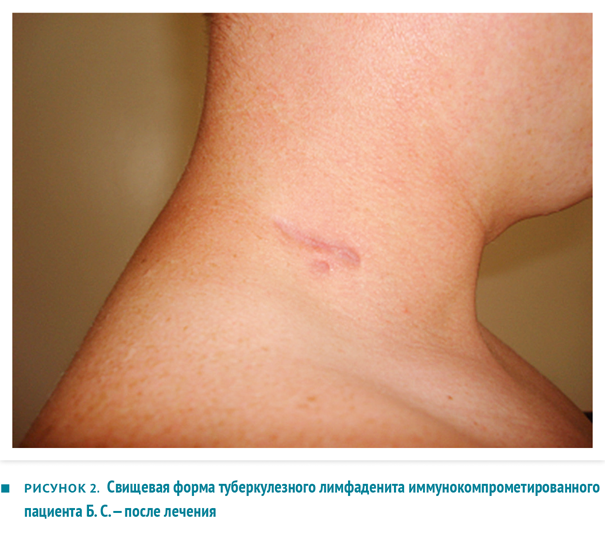
В противовес первому примеру мы наблюдали неожиданно благоприятное течение заболевания у ВИЧ-инфицированного пациента, что демонстрирует пример 2.
Б. С., 29 лет, житель Новосибирской области. Поступил в ННИИТ 29.03.2013 с жалобами на боль в области шейных лимфоузлов, подъем температуры до 37,4 °С вечером, потливость.
Анамнез заболевания: примерно 1 год назад, после освобождения из мест лишения свободы, был выявлен туберкулез шейных лимфатических узлов, гепатиты В и С, ВИЧ-инфекция. Получал противотуберкулезную терапию на фоне антивирального лечения в течение 2-х месяцев, затем прекратил, поскольку отметил достаточно хороший результат. Через 6 месяцев вновь воспалились лимфатические узлы, амбулаторная терапия в противотуберкулезном диспансере без эффекта, в связи с чем направлен на госпитализацию в ННИИТ.
Анамнез жизни: контакт с больными туберкулезом в семье (гражданская жена), в местах лишения свободы. Материально-бытовые условия удовлетворительные. Перенесенные заболевания: часто респираторные вирусные заболевания. St. localis: по наружному краю кивательной мышцы с обеих сторон визуализируются резко увеличенные (до 3–4 см) пакеты шейных лимфоузлов, плотные, болезненные, с признаками размягчения в центре.
Диагноз при поступлении: двусторонний туберкулез шейных лимфоузлов (абсцедирование), МБТ, 1-а ГДУ.
Результаты проведенных исследований: МБТ при бактериоскопии мокроты и мочи люминесцентным методом не обнаружены. В мокроте получен рост Streptococcus viridans group 5×10 4 КОЕ/мл; Neisseria non-meningitidis 5×10 4 КОЕ/мл; CN Staphylococcus spp. 4 КОЕ/мл; Candida albicans > 10 4 КОЕ/мл. Исследование Bactec 960 от 20.05.2013 — в мокроте М. tuberculosis не выделены. Бактериоскопия отделяемого свища от 05.04.2013 — визуализируются от 10 до 99 МБТ в поле зрения.
Томография органов грудной клетки от 20.05.13: выявлены единичные очаги в S6, средней доле справа, в S4 слева. Жидкости в плевральных полостях нет. Проходимость бронхов 1–3 порядка не нарушена. Заключение: очаговый туберкулез S 6,4 правого легкого в фазе рассасывания и уплотнения.
Больному проводили лечение по индивидуальному режиму: Изониазид, Левофлоксацин, ПАСК, Пиразинамид, Рифабутин, Этамбутол. Лечение было согласовано с инфекционистом, который одновременно назначил пациенту специфическую антивиральную терапию, 04.04.2013 выполнена абсцессотомия шейной области с обеих сторон, послеоперационный период протекал без осложнений с быстрым заживлением раны. Исследование на гемокультиваторе Bactec 9050 от 05.04.2013 — из операционного материала выделены М. tuberculosis. Внешний вид больного Б. В. представлен на рис. 3.
Рис. 3. Свищевая форма туберкулезного лимфаденита иммуноскомпрометированного пациента Б. С. — после лечения
Таким образом, мы наблюдали злокачественное течение туберкулеза периферических лимфатических узлов у благополучного пациента без ВИЧ-инфекции — и неожиданно благоприятный исход аналогичного заболевания у социально-дезадаптированного ВИЧ-инфицированного больного. Эти примеры свидетельствуют о значительной роли компенсаторных возможностей организма, об индивидуальности иммунного ответа, какие-либо прогнозы следует делать с осторожностью.
Государственная лицензия ФГБОУ ВО НГМУ Минздрава России
на образовательную деятельность:
серия ААА № 001052 (регистрационный № 1029) от 29 марта 2011 года,
выдана Федеральной службой по надзору в сфере образования и науки бессрочно
Свидетельство о государственной аккредитации ФГБОУ ВО НГМУ Минздрава России:
серия 90А01 № 0000997 (регистрационный № 935) от 31 марта 2014 года
выдано Федеральной службой по надзору в сфере образования и науки
на срок по 31 марта 2020 года
Адрес редакции: 630091, г. Новосибирск, Красный проспект, д. 52
тел./факс: (383) 229-10-82, адрес электронной почты: mos@ngmu.ru
Средство массовой информации зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор) —
Свидетельство о регистрации СМИ: ПИ № ФС77-72398 от 28.02.2018.
 |
|
08.02.2016 11.01.2016 28.12.2015 Туберкулёз — одна из главных оппортунистических инфекций у ВИЧ-инфицированных лиц. У больных, сначала инфицировавшихся М tuberculosis, а затем вирусом иммунодефицита человека (ВИЧ), риск развития туберкулёза составляет 5-10% в год. Если эти инфекции развиваются в обратном хронологическом порядке, их сочетание протекает более драматично: обычно более чем у 50% ВИЧ-инфицированных туберкулёз возникает в течение нескольких месяцев, сразу вслед за первичным инфицированием. По данным на 1997 год на Украине уровень заболеваемости туберкулёзом среди ВИЧ-инфицированных почти в 5 раз превышает таковой среди обычного населения. Исследования второй половины 90-х годов свидетельствует о том, что в США 3-4% больных туберкулёзом ВИЧ-серопозитивны. В Нью-Йорке 42% госпитализированных мужчин с туберкулёзом были ВИЧ-серопозитивны, большинство из них были наркоманами, вводившими наркотики внутривенно. В Африке туберкулёз — единственная ведущая инфекция, осложняющая СПИД, в Уганде 66% пациентов, госпитализированных по поводу туберкулёза, были ВИЧ-серопозитивными. ВИЧ разрушает лимфоциты и моноциты — главные клетки защиты, противостоящие туберкулёзной инфекции. Недостаточность противотуберкулёзного иммунитета проявляется рано, до существенного снижения количества CD4+-T-лимфоцидов. У ВИЧ-инфицированных лиц без клинических проявлений СПИДа кожная туберкулиновая чувствительность может быть утрачена, хотя ? ВИЧ-инфицированных пациентов, больных туберкулёзом, имеют положительные туберкулиновые пробы. Для ВИЧ-серопозитивных больных туберкулёзом типичное количество CD4+-T-лимфоцитов находятся в диапазоне от 150 до 200 клеток в 1 мл, хотя возможны значительные индивидуальные вариации. До появления СПИДа более 80% случаев туберкулёза локализовалось в легких. Однако до ? ВИЧ-инфицированных больных туберкулёзом имеют легочное и внелегочное поражение, либо только внелегочный туберкулёз. Примерно половина больных СПИДом имеют внелегочные формы с туберкулёзным лимфаденитом преимущественно передних шейных лимфатических узлов. Среди больных СПИДом и легочным туберкулёзом около половины имеют атипичную рентгенологическую картину с диффузными нежными легочными инфильтратами, аденопатией корней и прикорневой инфильтрацией. Плевральный выпот — довольно частая находка. Некоторые больные СПИДом с микробиологически доказанным наличием микобактерий в мокроте могуг иметь нормальную рентгенограмму органов грудной клетки. У больных СПИДом часто выявляют другие микобактериозы. В США примерно у 50% больных диагностируют диссеминированный процесс, вызванный М. avium, развивающийся на поздних этапах течение СПИДа. В то же время в Африке (район Сахары) среди больных СПИДом практически не отмечено случаев поражения М. avium. Эпидемия ВИЧ увеличила ущерб, причиняемый туберкулёзом, особенно в популяциях, где распространённость туберкулёзной инфекции является высокой среди молодых взрослых. По оценкам экспертов ВОЗ, во всем мире около двух миллиардов людей инфицировано МТБ, 16 миллионов ВИЧ-инфицированных. ВИЧ-инфекция является наиболее мощным фактором, повышения риска прогрессирования туберкулёзной инфекции. У лиц одновременно инфицированных ВИЧ и микробактерией туберкулёза риск развития туберкулёза в течение жизни составляет 50%. Такое сочетание становится непосильной нагрузкой для служб здравоохранения многих стран. По мере прогрессирования ВИЧ-инфекции лимфоциты CD4 уменьшаются в количестве и в функциях. Иммунная система становится менее способной предупреждать рост и локальное распространение МТБ. Диссеминированный и внелегочный туберкулёз являются наиболее частой формой заболевания у больных инфицированных ВИЧ. У ВИЧ инфицированных больных туберкулёз лёгких является наиболее распространенной формой туберкулёза. Проявления зависят от степени иммунодепрессии. В различных публикациях сообщается об увеличении случаев БК-отрицательного туберкулёза легких при сочетанной туберкулёз+ВИЧ эпидемии. В связи с чем, часто трудно отличить патологические проявления, обусловленные ВИЧ от туберкулёза легких. Наиболее частыми формами внелегочного туберкулёза являются: лимфоаденопатия, поражение плевры, перекардит, милиарный туберкулёз, менингит. Как и у взрослых, естественная история туберкулёза у детей, инфицированных ВИЧ-инфекцией, зависит от стадии развития ВИЧ-инфекции. В ранней фазе ВИЧ-инфекции, когда иммунитет ещё хороший, то проявление туберкулёза очень схоже с таковыми, как у ребенка, не инфицированного ВИЧ. По мере того, как ВИЧ-инфекция прогрессирует, иммунитет снижается, диссеминация микобактерий туберкулёза становится более частой. При этом чаще всего наблюдаются: туберкулёзный менингит, миллиарный туберкулёз, распространённая лимфоаденопатия. Противотуберкулёзное лечение ВИЧ-инфицированных больных туберкулёзом. Используются одни и те же критерии для установления групп лечения для больных туберкулёзом вне зависимости от статуса ВИЧ-инфекции. В общем, противотуберкулёзная химиотерапия одинакова как у ВИЧ-инфицированных, так и не инфицированных ВИЧ больных туберкулёзом, за исключением использования тиоацетозона. Тиоацетозон связан с повышенным риском тяжёлых, иногда фатальных кожных реакций, у ВИЧ-инфицированных индивидов. В связи с этим следует назначать этамбутол вместо тиоацетозона пациентам с установленной или подозреваемой ВИЧ-инфекцией. Там, где невозможно исключить тиоацетозон от использования, важно предупредить больного относительно риска тяжёлых кожных реакций. Важно дать советы больному не принимать тиоацетозон, как только он обнаруживает у себя появление зуда и других кожных реакций. Стрептомицин остаётся полезным препаратом в некоторых странах, где есть возможность надёжной стерилизации игл и шприцов. Смертность туберкулёз+ВИЧ больных в течение одного года после противотуберкулёзного лечения составляет около 20%. Этот показатель выше, по сравнению с туберкулёзными больными, не инфицированными ВИЧ. Смертность ниже у туберкулёз+ВИЧ больных, леченных стандартными схемами DOTs. Особенно эффективен при лечении туберкулёза рифампицин, поскольку он наряду с противотуберкулёзной активностью имеет широкий спектр антибактериальной активности. Это может способствовать снижению смертности от ВИЧ-обусловленной бактериальной инфекцией, в период противотуберкулёзного лечения. В нескольких исследованиях сделана попытка оценить клинические, рентгенологические и микробиологические реакции на DOTs у ВИЧ-инфицированных и ВИЧ-отрицательных больных туберкулёзом. Исключая умерших больных, эффективность химиотерапии оказалась одинаковой, как у ВИЧ-инфицированных, так и ВИЧ-отрицательных больных туберкулёзом. Частота рецидивов у ВИЧ-инфицированных и ВИЧ-отрицательных больных, закончивших DOTs, не отличаются.
Распространение ВИЧ-инфекции выявляет недостатки любой национальной противотуберкулёзной программы. Эпидемия ВИЧ-инфекции определяет необходимость концентрировать усилия на выявлении и лечении больных туберкулёзом. Принципы борьбы с туберкулёзом такие же, как и для большинства больных туберкулёзом и ВИЧ-инфицированных. Однако бороться приходится с большим количеством и постоянно увеличивающимся числом больных. При использовании материалов сайта ссылка на источник обязательна. Микобактерия туберкулеза (МБТ) инфицирует периферическую лимфатическую систему во время лимфогенной диссеминации, но не у всех пациентов развивается клиника поражения лимфоузлов. Макрофаги, фагоцитировавшие микобактерию, начинают экспрессировать поверхностные маркеры и продуцировать провоспалительные цитокины и хемокины, привлекающие в очаг воспаления лимфоциты и моноциты, которые в свою очередь блокируют инфекцию. Однако в случае одновременного заражения вирусом иммунодефицита человека (ВИЧ) эти сигналы значительно увеличивают восприимчивость клеток к инфицированию вирусом и его способность реплицироваться внутри клетки. В отсутствие эффективного иммунного ответа МБТ бесконтрольно размножается внутри макрофага, приводя в конечном итоге к его гибели. Как следствие, возникает очередная волна диссеминации с преимущественным поражением органов вне бронхолегочной системы [1]; особенно уязвима у ВИЧ-инфицированных периферическая лимфатическая система [2, 3]. На фоне распространения ВИЧ-инфекции в мире прогнозировалось смещение в структуре заболеваемости экстраторакальным туберкулезом в сторону лимфожелезистого; однако эти прогнозы оправдались только в отношении развитых стран с низкой заболеваемостью туберкулезом [4]. Анализ структуры заболеваемости экстраторакальным туберкулезом в Сибири и на Дальнем Востоке за 13 лет, проведенный ранее [5, 6], показал относительно стабильную кривую доли туберкулеза периферических лимфоузлов (ТПЛУ) и даже с некоторой тенденцией к понижению. Максимальный процент больных ТПЛУ (16,5 %) был выявлен в 2008 году, в следующем году он опустился до минимума (11,0 %), затем опять вернулся на средневзвешенную позицию 12–13 %.
Екатерина Валерьевна Кульчавеня ТПЛУ, несмотря на кажущуюся относительную безопасность, одна из самых сложных для излечения форм экстраторакального туберкулеза, со склонностью к непрерывно рецидивирующему течению, абсцедированию, генерализации процесса — даже у иммунокомпетентных пациентов, не инфицированных ВИЧ. Наглядным примером является история болезни Г. В., 24 года. Пациент Г. В.
Анамнез жизни: контакт с больными туберкулезом отрицает. Простудные заболевания редко, алкоголем не злоупотребляет, материально-бытовые условия удовлетворительные. Непереносимости лекарственных веществ нет. St. localis: в надключичной области справа определяются два послеоперационных рубца. Под ними пальпируется группа увеличенных (2,5–3 см), плотных, умеренно болезненных лимфоузлов, отграниченных от окружающих тканей. В подчелюстной области — гиперемия вокруг старого послеоперационного рубца, пальпируется увеличенный несколько болезненный лимфоузел 1–1,5 см в диаметре с зоной размягчения. Диагноз при поступлении: туберкулез периферических лимфоузлов шейного отдела, абсцедирование. Данные клинико-лабораторного обследования: кислотоустойчивые микобактерии (КУМ) в отделяемом свища люминесцентным методом 17.04.2008, 23.04.2008 не обнаружены. Посев на МБТ отделяемого свища от 17.04.2008, 16.06.2008 роста не дал. Роста неспецифической микрофлоры также не было получено. Рентгенография органов грудной клетки в прямой проекции с томографией средостения от 22.07.2008: очаговых и инфильтративных изменений в легких не выявлено. Пациенту была назначена индивидуальная схема лечения из шести противотуберкулезных препаратов резервного ряда в ежедневном режиме, комплексная патогенетическая терапия. На ее фоне 07.07.2008 выполнена лимфаденэктомия на шее справа, 26.01.2009 — слева. Послеоперационный период в обоих случаях протекал без осложнений. Гистологическое заключение в июле 2008 и в январе 2009 года — туберкулез, острое течение, экссудативная фаза. Только к апрелю 2009‑го года была достигнута относительная стабилизация процесса; полного заживления раны тем не менее достигнуто не было. Внешний вид пациента Г. В. после двух лет консервативной терапии и шести хирургических вмешательств представлен на фото рисунка 1. В противовес первому примеру мы наблюдали неожиданно благоприятное течение заболевания у ВИЧ-инфицированного пациента, что демонстрирует пример 2.
Пациент Б. С.Анамнез жизни: контакт с больными туберкулезом в семье (гражданская жена), в местах лишения свободы. Материально-бытовые условия удовлетворительные. Перенесенные заболевания: часто респираторные вирусные заболевания. St. localis: по наружному краю кивательной мышцы с обеих сторон визуализируются резко увеличенные (до 3–4 см) пакеты шейных лимфоузлов, плотные, болезненные, с признаками размягчения в центре. Диагноз при поступлении: двусторонний туберкулез шейных лимфоузлов (абсцедирование) без с выделения микобактерии туберкулеза. Результаты проведенных исследований: КУМ при бактериоскопии мокроты и мочи (люминесцентный метод) от 20.05.2013 не обнаружены. В мокроте получен рост Streptococcus viridans group 5×104 КОЕ/мл; Neisseria non-meningitidis 5×104 КОЕ/мл; CN Staphylococcus spp. 103 КОЕ/мл. Исследование Bactec 960 от 20.05.2013 — в мокроте М. tuberculosis не выделены. Бактериоскопия отделяемого свища от 05.04.2013–10–99 КУМ в препарате. Томография органов грудной клетки от 20.05.13: выявлены единичные очаги в S6, средней доле справа, в S4 слева. Томография органов грудной клетки от 14.06.13: динамики нет. В обоих легких (в S6, средней доле справа, в S4 слева) сохраняются единичные очаговые уплотнения, имеющие прежние характеристики. Продолжают визуализироваться неувеличенные лимфоузлы в средостении и корнях легких, количество и размеры их не изменились. Жидкости в плевральных полостях нет. Проходимость бронхов 1–3 порядка не нарушена. Заключение: очаговый туберкулез S 6, 4 правого легкого в фазе рассасывания и уплотнения. Пациенту проводилось лечение по индивидуальному режиму: изониазид 600 мг внутривенно капельно, офлоксацин 0,4 г внутрь, ПАСК 8000 мг внутрь, пиразинамид 1500 мг внутрь, рифабутин 600 мг внутрь, этамбутол 1,2 внутрь. Лечение было согласовано с инфекционистом, который одновременно назначил пациенту специфическую антивиральную терапию. 04.04.2013 выполнена абсцессотомия шейной области с обеих сторон, послеоперационный период протекал без осложнений, с быстрым заживлением раны. Исследование на гемокультиваторе Bactec 9050 (МБТ) от 05.04.2013 — из операционного материала выделены М. tuberculosis. Внешний вид пациента Б. В. представлен на рисунке 2. Диагноз при выписке: очаговый туберкулез S 6, 4 правого легкого в фазе рассасывания и уплотнения, без выделения микобактерии туберкулеза. Туберкулез периферических (шейных) лимфатических узлов. Абсцедирующая форма, с выделением микобактерии туберкулеза. Состояние после вскрытия и дренирования абсцесса шейной области с обеих сторон. 1‑а ГДУ. ВИЧ-инфекция. Стадия вторичных заболеваний. Фаза: ремиссия. Хронические вирусные гепатиты В и С. Таким образом, мы наблюдали злокачественное течение туберкулеза периферических лимфатических узлов у благополучного пациента без ВИЧ-инфекции — и неожиданно благоприятный исход аналогичного заболевания у ВИЧ-инфицированного больного. Эти примеры свидетельствуют о значительной роли компенсаторных возможностей организма, об индивидуальности иммунного ответа; какие‑либо прогнозы следует делать с осторожностью. Читайте также:
 Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу. Пожалуйста, не занимайтесь самолечением!При симпотмах заболевания - обратитесь к врачу.
Copyright © Иммунитет и инфекции
|