Синегнойная палочка и гонококк
Менингококкиотносятся к роду Neisseria, родN. meningitidis.
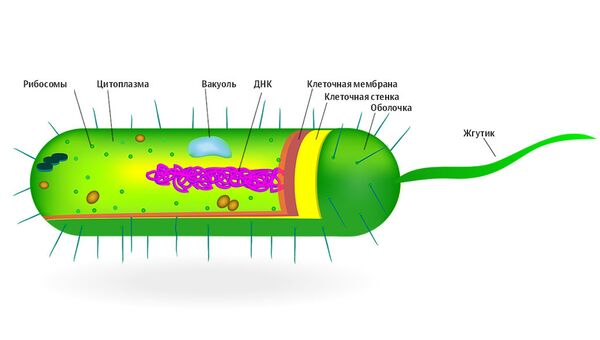
Это диплококки бобовидной формы, в мазках имеют вид кофейных зерен. Спор не образуют, жгутиков не имеют, в организме образуют капсулу. Грамотрицательные. Строгие аэробы.
Менингококки требовательны к питательным средам – растут только на средах, содержащих человеческий белок.
Факторы вирулентности менингококков:
1) адгезины – фимбрии (пили);
3) ферменты агрессии – гиалуронидаза, нейраминидаза;
4) поверхностные белки, обладающие антилизоцимной активностью;
5) сидерофоры – это клеточные включения, активно связывающие трехвалентное железо, конкурируя с эритроцитами.
Менингококки патогенны только для человека.
Менингококковая инфекция – антропонозная инфекция, источником является больной (или бактерионоситель). Основной путь передачи – воздушно-капельный.
После перенесенного заболевания формируется стойкий видоспецифический антимикробный иммунитет. У детей младшего возраста имеется пассивный иммунитет, обусловленный полученными от матери IgG.
Лечение: этиотропная терапия: сульфаниламиды, пенициллины, хлорамфеникол.
1) химическая менингококковая вакцина;
2) человеческий иммуноглобулин.
Относятся к роду Neisseria, вид N. gonorrhoeae.
Это диплококки бобовидной формы.
Спор не образуют, неподвижны, образуют микрокапсулу, грамотрицательные. Являются облигатными аэробами.
Гонококки исключительно требовательны к питательным средам, растут только на средах, содержащих человеческие белки.
Гонококковая инфекция – антропонозная инфекция, источник заражения – больной человек, носительства не бывает. Путь передачи половой, возможно заражение новорожденного при прохождении через родовые пути больной матери.
Клинические формы гонококковой инфекции:
1) гонорея (урогенитальная, экстрагенитальная);
2) гонококковая септикопиемия;
3) специфический конъюнктивит новорожденных.
1) свежую гонорею (длительность течения не более 2 месяцев):
2) хроническую гонорею (вялотекущее заболевание продолжительностью более 2 месяцев или с неустановленным сроком).
По клиническому течению различают:
1) неосложненную гонорею;
2) осложненную гонорею.
Лечение: этиотропная терапия антибиотиками.
Специфическая профилактика не разработана.
36. Гемофильная палочка. Синегнойная палочка
Гемофильная палочка.СемействоPasterellaceae, родHaemophilus, видH. influenza.
Это прямые палочки, неспоробразующие, неподвижные, грамотрицательные, аэробы. В организме образуют капсулу.
Для культивирования требуются питательные среды, содержащие кровь (кровяной агар) или ее препараты (шоколадный агар).
2) капсульный полисахарид, обладающий антифагоцитарной активностью.
Экзотоксин не продуцирует.
Гемофильная палочка может входить в состав нормальной микрофлоры слизистой ротоглотки и верхних дыхательных путей, поэтому инфекция может возникать как эндогенная.
При экзогенном инфицировании вызывает инфекции лор-органов и органов дыхания (отиты, пневмонии), менингит. Путь передачи воздушно-капельный. Источником инфекции являются больной или бактерионоситель (антропонозная инфекция).
Чаще всего заболевание развивается как вторичная инфекция при снижении общей резистентности организма.
Бактериальные менингиты, вызванные гемофильной палочкой, возникают чаще всего у детей от 6 месяцев до 3 лет.
Относится к семействуPseudomonadaceae, родуPseudomonas, видуP. aerugenosa. Это прямые или слегка изогнутые палочки средних размеров, подвижные, грамотрицательные, облигатные аэробы. Спор не образуют, имеют тонкую слизистую капсулу.
Синегнойная палочка нетребовательна к питательным средам, хорошо растет на искусственных питательных средах. Способность псевдомонад образовывать пигменты – наиболее характерный дифференциально-диагностический признак.
Культура синегнойной палочки при культивировании на питательных средах имеет специфический запах жасмина.
Устойчива во внешней среде. Обладает естественной устойчивостью к антибиотикам.
Синегнойная палочка может обитать в кишечнике человека, обнаруживается на коже и слизистых оболочках.
Чаще всего синегнойная инфекция является внутрибольничной. Источник – больной (или бактерионоситель). Может вызывать различные заболевания. Особенно часто выделяется при гнойно-воспалительных осложнениях ожоговых ран.
1) антибиотики (цефалоспорины, аминогликозиды);
2) синегнойный бактериофаг;
3) синегнойная иммунная плазма;
4) убитая лечебная стафило-протейно-синегнойная вакцина.
ДУШАНБЕ, 6 мая – Sputnik. Молекулярные биологи из институтов РАН усовершенствовали структуру белка, который вирусы-бактериофаги используют для проникновения в клетки синегнойной палочки, и превратили его в своеобразного "киллера" этих опасных микробов. Первые итоги его применения были представлены в журнале Metallomics, пишет РИА Новости.
"Мы экспериментально показали, что один из созданных нами белков-мутантов, дефектный по связыванию кальция, но устойчивый к аминокислоте ЭДТА, в присутствии этого связующего вещества разрушает клетки синегнойной палочки - потенциального возбудителя сепсиса и пневмонии", — рассказывает Виктор Кутышенко из Института теоретической и экспериментальной биофизики РАН в Пущино.

В последние годы перед медиками все шире и острее становится проблема появления так называемых супер-бактерий–микробов, стойких к действию одного или нескольких антибиотиков.
Среди них есть как редкие возбудители инфекций, так и очень распространенные и опасные патогены, такие как синегнойная палочка (Pseudomonas aerugenosa) или гонококк (Neisseria gonorrhoeae), возбудитель гонорреи.
В прошлом ученые боролись с этим феноменом, открывая новые антибиотики в природе, однако сейчас это становится делать все сложнее.
По этой причине многие исследователи пытаются решить эту проблему, меняя структуру уже существующих препаратов, способных убивать опасные бактерии или "перепрофилируя" на эту роль другие молекулы биологического происхождения.
Подобные эксперименты, как передает пресс-служба ИТЭБ РАН, ученые проводят, внося случайные или направленные мелкие мутации в структуру генов, отвечающих за производство этих веществ, и наблюдая за тем, как меняется их работа.
Это одновременно позволяет искать новые полезные препараты и изучать то, какую роль играют отдельные аминокислоты в белковых цепочках различных важных ферментов, с которыми экспериментируют исследователи.
Кутышенко и его коллеги экспериментировали с белком EndoT5, который вирус-бактериофаг T5 использует для того, чтобы разрушать оболочку синегнойной палочки на последних фазах его размножения.

Данный фермент, как недавно выяснили ученые, "включается" только в том случае, если в его окрестностях присутствует достаточно большое число ионов кальция. Российские исследователи пытались понять, почему это так, и одновременно хотели поменять его структуру таким образом, чтобы он работал и без кальция или активировался по другому сигналу.
Для этого ученые выделили из бактериофага участки ДНК, связанные с производством этого фермента, размножили и внесли мутации в них, после чего вставили их в клетки обычной кишечной палочки.
Когда микробы размножились и начали производить "мутантные" белковые молекулы, ученые проанализировали их структуру и проверили, как эти вещества повлияют на жизнь синегнойной палочки.
Как показали эти опыты, замены одиночных аминокислот в цепочке EndoT5 почти не сказывались на форме молекулы, но некоторые из подобных точечных мутаций сильно поменяли характер ее работы.
К примеру, замена аспарагиновой кислоты на аланин в критически важной части белка полностью выводила его из строя, а другие мутации превращали этот белок в сильнейший нейтрализатор "нормальных" молекул этого вещества или меняли его работу иными путями.
Внимание российских ученых привлекла одна из подобных мутаций, E123A, замена глутаминовой кислоты на аланин. Ее появление в белковой цепочке приводило к тому, что молекула начинала работать даже при самых низких концентрациях кальция в ее окрестностях, что заставило ученых проследить за тем, как оно будет действовать на синегнойную палочку.
Для этого ученые добавили в питательную среду с бактерией не только новую версию этого белка, но и аминокислоту ЭДТА, быстро поглощающую все ионы кальция и не дающую им взаимодействовать с ферментом-"киллером".
Как показали эти опыты, данный пептид достаточно эффективно уничтожает микробов даже в небольших концентрациях. Это делает его одним из самых перспективных новых средств для борьбы с пневмонией и заражением крови, не похожего на все существующие антибиотики.
МОСКВА, 7 мая — РИА Новости, Альфия Еникеева. Супербактерии, устойчивые к антибиотикам, — одна из главных проблем современной медицины. Возбудители гонореи, стафилококка, пневмококка мутировали, и теперь непонятно, как с ними бороться. Согласно прогнозам, особо стойкие инфекции угрожают миллионам жизней, поэтому перед наукой поставлена задача — разработать более мощные средства борьбы, а также альтернативу антибиотикам.

Обычная бактерия кишечной палочки Escherichia coli всего за 11 дней приспособилась к тысячекратной дозе антибиотиков. Видео, снятое в ходе эксперимента учеными Гарвардской медицинской школы, показывает, как постепенное увеличение концентрации препарата превращает ее в супермикроб, неуязвимый для любых лекарств.
Вырабатывать антибиотики и уметь им сопротивляться — естественная стратегия выживания в мире бактерий. Но в природе стойкие к антибиотикам штаммы оказывались в проигрыше, поскольку размножались медленнее "диких" бактерий.
В начале XX века Александр Флеминг открыл антибактериальные свойства пенициллина, и с 1950-х годов антибиотики производятся в промышленных масштабах для медицины и животноводства. Так люди неожиданно помогли мутировавшим штаммам микробов победить в эволюционной борьбе и подставили себя под удар. В 2017 году Всемирная организация здравоохранения (ВОЗ) объявила о наступлении "постантибиотиковой эры" и обнародовала список особо стойких инфекций.
Откуда берутся супербактерии
Антибиотики действуют на наименее устойчивые бактерии, а вот мутировавшие держатся до последнего. И если с ними не бороться, они передают ген устойчивости при размножении. Кроме того, бактерии обмениваются мутациями.
Такой супермикроб вырабатывает ферменты, разлагающие антибиотик. Его клеточная мембрана, по которой раньше лекарства наносили сокрушительный удар, теперь неуязвима. Некоторые супербактерии умеют обманывать антибиотики, выстраивая вокруг себя слой белков, мимикрирующих под рибосомы — внутриклеточные белковые фабрики. Препарат их уничтожает, настоящие же рибосомы продолжают функционировать, а бактерия — жить.
Три смертельно опасных мутанта
Из-за быстрой приспособляемости к антибиотикам супербактерии опаснее для человечества, чем климатические изменения или загрязнение окружающей среды. Уже сегодня, по данным ВОЗ, в мире от заболеваний, вызванных этими микробами, умирает примерно 800 тысяч человек в год. А к 2050-му, по прогнозам специалистов, суперинфекции ежегодно будут уносить до десяти миллионов жизней.
Три супербактерии признаны ВОЗ критически опасными для человека — они показали резистентность практически ко всем антибиотикам, даже к так называемым препаратам последнего резерва, колистину и бета-лактамным антибиотикам широкого спектра. Это акинетобактерия Баумана, приводящая к пневмонии и инфекциям крови, синегнойная палочка, вызывающая кожную сыпь, ушные инфекции у здоровых людей, серьезные кровяные инфекции, пневмонии у пациентов в больницах, а также энтеробактерии, населяющие кишечник человека, в частности сальмонелла и кишечная палочка.
Сильно опасными ВОЗ считает более распространенные золотистый стафилококк (Staphylococcus aureus), пневмококк (Klebsiella pneumoniae) и гонококк (Neisseria gonorrhoeae), вызывающий гонорею. Кстати, первый случай супергонореи, от которой не помогают антибиотики, недавно зафиксировали в Великобритании. Пациент, чье имя не раскрывают, заразился инфекцией после полового контакта с жительницей Юго-Восточной Азии.
Ученые также опасаются супербактерии туберкулеза, поскольку почти половина штаммов этого патогена устойчива к изониазиду и другим средствам противотуберкулезной терапии. Шестнадцать процентов штаммов не поддаются воздействию ни одного из имеющихся антибиотиков. Такие суперустойчивые туберкулезные палочки выявлены в Индии и Ираке.
Суперантибиотики против супербактерий
Для борьбы с супербактериями ученые создают новые антибиотики либо модифицируют существующие под генетические изменения в конкретных микроорганизмах. Именно этот путь выбрали исследователи МГУ, разработавшие принципиально новый гибридный антибиотик — митохондриально направленный антиоксидант, воздействующий на мембранный потенциал, который обеспечивает бактериальные клетки энергией.
Другой перспективный препарат создан на основе теиксобактина — антибиотика, открытого в 2015 году в образцах почвы. Совсем недавно ученые успешно применили его синтетическую форму для лечения бактериальной инфекции у лабораторных мышей. Предполагается, что это лекарство поможет в борьбе с метициллин-резистентным стафилококком и энтерококком, устойчивым к ванкомицину.
Помимо антибиотиков, ученые разрабатывают и совершенно новые классы препаратов. Так, исследователи из российско-американской лаборатории биомедицинской химии ИХБФМ СО РАН создали аналоги нуклеиновых кислот — фосфорилгуанидины, умеющие проникать в клетку и вступать во взаимодействие с ДНК и РНК, уничтожая бактерию. Ученые отмечают, что в будущем такие вещества можно будет создавать под каждый конкретный патоген на основе анализа его генома.
Еще один точечный метод — бактериофаги, то есть вирусы, поражающие бактериальные клетки. Совсем недавно команда ученых из ИБХ РАН, ИТЭБ РАН и ИБФМ имени Г. К. Скрябина РАН научила фермент бактериофага Т5 разрушать клеточные стенки бактерии кишечной палочки даже с утолщенной из-за мутаций мембраной. Кроме того, исследователи выяснили, что фермент эффективнее уничтожает бактерии, когда ему помогает агент (например, хлоргексидин в очень низких концентрациях).
Эксперты все же считают, что с супербактериями лучше бороться с помощью антибиотиков. Но необходимо ограничивать их свободную продажу в аптеках и применение в сельском хозяйстве — иначе даже новые высокоэффективные препараты не помогут.
Предисловие
Антипрививочное движение недалеких и ограниченных людей с явными психопатами и мошенниками во главе и преступно доступное и широкое применение антибиотиков привели к тому, что мы остались практически беззащитны! Да, мы уже почти победили врага, зажали его в угол, кого-то вообще извели… И расслабились!
Глава 1
Кто в чьем мире живет?
«И назвал Бог сушу землёю, а собрание вод назвал морями. И увидел Бог, что [это] хорошо.
Бактерии проникли в организм самых первых людей. Хорошо, не Адам и Ева, но кто-то же был первым? Если это та самая пресловутая обезьяна, которая вдруг стала мыслить и пошла разжигать костер, – там и подавно микроорганизмы уже исчислялись миллиардами! Дальше вообще не очень понятно… Могли ведь сразу убить! До всякого там иммунитета – его надо было еще развить!
То, что я сейчас говорю, скорее гипотеза, не надо относиться к ней слишком серьезно. И все-таки меня поразило недавнее исследование, доказавшее, что токсоплазма может менять поведение людей!
Токсоплазма, попадая в организм человека, остается там навсегда. Исследование показало, что носители токсоплазмы и люди, свободные от нее, ведут себя по-разному. Дальше. Важнейшее и абсолютно незаменимое звено в цикле развития токсоплазмы – это кошки. Посмотрите, как мы их любим! Лелеем, холим! Пророк Мухаммед, чтобы не потревожить кошку, спавшую на широком рукаве его шелкового халата, вставая, просто этот рукав отрезал! В древней Грузии за убийство кошки полагалась смертная казнь!
Подумайте о трех фактах:
1. Доказано, что токсоплазма может менять поведение человека.
2. Токсоплазме необходимы кошки.
3. Большинство из нас обожает кошек.
Вывод, основанный на этих фактах, таков: токсоплазма, поселившись у нас в организме, подспудно генерирует у нас любовь к кошкам и заставляет проявлять заботу о них, превращая нас в своеобразных пастухов, необходимых их организмам!
Хотите опровергнуть? Для этого надо сравнить анализы крови на носительство токсоплазмоза у тех, кто обожает кошек, и тех, их не любит! Конечно, это до некоторой степени фантазии!
Теперь совесть может быть чиста: это не мы тянем очередную конфету в рот, не по своей воле наворачиваем зараз пачку пельменей, а потом еще и идем ночью к холодильнику – это всё живущие в нас бактерии дергают за веревочки, а без них бы мы, конечно, питались одними фруктами и цветочной пыльцой!
Микробы могут изменять поведение и привычки человека. Так считают американские врачи.
Шутки шутками, но работы по исследованию возможности влияния бактерий на поведение человека продолжаются, и, боюсь, дождемся-таки данных о связи хламидийной инфекции или уреаплазмы с нашими предпочтениями в выборе половых партнеров! Хотя в 2012 году ВОЗ признала любовь заболеванием (да-да, код в Международной классификации болезней: F63.9), теперь не хватало еще, чтобы инфекционным!
Давайте знакомиться с микромиром, где мы то ли гости, то ли домашний скот, то ли жертвы…
Общая масса бактерий на Земле – около 500 млрд тонн. Они необходимы для нашего существования.
Давайте познакомимся поименно с теми бактериями, которые у нас на слуху как основные виновники многих серьезных болезней.
Пневмококк. Частый возбудитель пневмонии, потому так и назван! Но он вполне может поспорить за лидерство за место, уже занятое другой бактерией под названием менингококк, которая является наиболее частой причиной менингитов у детей (тот менингококк на втором месте!). Вообще, эта бактерия поражает наиболее часто детей до двух лет (отит!) и пожилых людей (65+). Отсюда очевидна необходимость прививок не только детям, но и людям в возрасте. Иначе по мере снижения естественного иммунитета у пожилых пневмококк рождает таких монстров! Это сепсис, воспаление клапанов сердца, суставов, костей, нервной системы…
Также очень подвержены поражающему действию пневмококка алкоголики и люди с удаленной селезенкой, как уже было сказано. Около 30 % всех пневмококков устойчивы к антибиотикам пенициллинового ряда. Вся надежда на прививки, благо вакцина есть!
Вакцинация от менингококка входит в список обязательных прививок (для безответственных родителей справка: смертность от менингита у детей – 30 %).
Заметки на полях
Как-то ко мне пришел главный врач соседней больницы и попросил совета по поводу своего родственника, стоит ли ему исправлять давнее искривление носовой перегородки? Храп, затруднение носового дыхания, конечно, делать надо! В остальном – здоров как бык, молодой, 45 лет. Положил я его к себе – мы славимся своим ЛОР-отделением – короткая операция и все хорошо. Хорошо первые 2 дня. А потом – в точности, как я только что описал: температура, сыпь, падение давления и шок! Больной в реанимации, приходят родственники, тот же соседский главврач, и я должен смотреть им в глаза и лепетать про 1–3 случая на 100 000 операций… Слава Богу, вытащили мы его с того света! А я сам по сей день так и продолжаю ходить с искривленной носовой перегородкой, все понимаю, но… Вместе с тем золотистый стафилококк часто живет на нашей коже и слизистых, не вызывая никаких симптомов до поры до времени. У кого-то он потом провоцирует гнойничковые инфекции кожи, у кого-то рвоту и понос, у кого-то инфекционное поражение костей или даже сердца! Вакцины нет, мойте чаще руки и соблюдайте правила личной гигиены!
Стрептококк. Обычно мы знаем только это название, хотя их много разновидностей (тот же пневмококк относится к стрептококкам). То, что так часто вызывает ангины и может дать осложнения на сердце и почки, – стрептококк группы А. Он виноват еще и в ревматизме, скарлатине и в том же синдроме токсического шока (на пару с золотистым стафилококком). Стрептококковый фарингит (ангина) характеризуется наличием трех компонентов: температура за 38, увеличенные болезненные лимфоузлы на передней поверхности шеи и отечные миндалины. Если есть все три признака – шанс стрептококковой инфекции 50 %! Наши действия: подтвердить мазком и назначить антибиотики на 10 дней как профилактику осложнений!
Группа Б не менее злая: поражает новорожденных (основная причина воспаления легких и менингитов у детей до трех месяцев, это потом пневмококк выходит на лидирующие позиции) и стариков. А также алкоголиков, диабетиков, беременных. Вакцины нет.
То же относится и к гемофильной палочке. Живет она у детей в слизистых дыхательных путях (к 18 месяцам жизни носители бактерии – больше 1/3 детей), передается воздушно-капельным путем. После введения в 1985 году вакцины число заболеваний, вызванных гемофильной палочкой, резко снизилось, смертность при них была 15 %… По официальным данным, в России от прививок отказываются 5 % родителей, в действительности, видимо больше, судя по вспышке потенциально контролируемых инфекций. Обидно смотреть!
Женщины должны с осторожностью пользоваться тампонами. Зафиксированы многие случаи, когда последствием был синдром токсического шока.
Синегнойная палочка. Один из самых неприятных микроорганизмов, основной источник головной боли врачей и исследователей. Очень распространен, особенно в воде, иногда даже в дистиллированной! Добро бы просто в воде… Синегнойная палочка живет в аппаратах искусственного дыхания и больничных раковинах, поражая и так тяжелобольных людей! Она – вторая причина пневмоний, полученных внутри больницы, причастна к инфекции мочевыводящих путей, к инфицированию послеоперационных ран. Смертельно опасна для больных со СПИДом, с обширными ожогами, муковисциозом, диабетом, низким уровнем лейкоцитов. Для борьбы с этой бактерией разработаны специальные антибиотики – надо их знать и не применять неправильно! Вакцины нет.
Сальмонеллы. Они бывают разные, самая известная – та, что вызывает тиф: сальмонелла тифа группы Д. Приходит к нам с едой (молоком), водой. Во время мировой и гражданской войн эпидемии брюшного тифа выкашивали людей целыми ротами и опустошали фронты! Люди также могут быть и носителями. Где бы вы думали, мы ее носим до поры до времени? В содержимом желчного пузыря! Вакцина есть, не такая уж и эффективная: защищает процентов на 70–80…
Есть и нетифоидные сальмонеллы – частая причина пищевых токсикоинфекций, отравлений. Источник – замороженные продукты, особенно куры, молоко, яйца. Также возможно распространение через экзотических животных: игуан, черепах и проч. Лечение антибиотиками обычно не ускоряет выздоровление, а лишь переводит больных в разряд носителей, поэтому лечат время, терпение и большое количество жидкости!
Легионелла. По меркам микробиологии совсем недавно открытая бактерия – в 1976 году. Обитает в воде, передается воздушно-капельным путем. Те несчастные ветераны Американского легиона, у которых эта бактерия была впервые выделена, заразились через кондиционер. Действительно, кондиционеры, системы охлаждения и отопления, душ – лучшая среда для бактерии, у которой комфортная температура для размножения 40–60 гр. Вызывает воспаление легких, сопровождаемое и другими симптомами: поносом, спутанностью сознания, при низком уровне натрия. Рентгенограмма таких больных всегда выглядит значительно хуже, чем можно предположить, выслушивая больного фонендоскопом! Ключ к диагнозу: вовлечение в процесс различных органов и систем. Вакцины нет.
Листерия. Вот про эту бактерию мы практически не слышали. Вместе с тем про нее надо знать хотя бы беременным женщинам. Да, беременность – это не болезнь, но состояние, при котором происходит снижение защитных сил организма (они же теперь прикрывают двоих, а то и троих-четверых). Листерия – такая бактерия, которая с сильным организмом может и не справиться (максимум, что грозит, это понос), а вот на слабых набрасывается! Она еще и бич алкоголиков, больных СПИДом и новорожденных: частая причина менингитов у этих категорий! Так вот беременные особенно чувствительны к инфекциям мочевыводящих путей. Поэтому к ним такое повышенное в этом плане внимание: если в обычной ситуации наличие бактерий в моче не требует лечения, то у беременных тут необходимо назначение антибиотиков и в первую очередь тех, что действуют на листерию! Здесь, кстати, тонкость: то, чем обычно лечат мочевую инфекцию, на листерии не действует! Поэтому беременным надо давать эффективный в этой ситуации и безопасный для будущей мамы ампициллин. Вообще, беременным надо помнить несколько простых правил предохранения от листерии. Надо исключить следующие продукты:
3. Мясную кулинарию.
5. Копченые морепродукты.
Как видим, у листерии губа не дура, знает, где селиться! Вакцины нет.
Хелиобактр пилори. По частоте инфицирования человека занимает первое место! Врачи открыли ее еще 100 лет назад, но осознание ее роли в провоцировании стольких проблем у человека пришло только в 80-х годах XX века, когда была обнаружена связь между этим микроорганизмом и язвой желудка. Врачи за это исследование получили Нобелевскую премию, а мы уже 4-й десяток лет никак не привыкнем, что язва желудка – инфекционная болезнь! И эрозивный гастрит, и лимфома желудка, и еще некоторые малоприятные состояния! И как только эта бактерия только выживает в очень кислом содержимом желудка?
До 50 % населения Земли заражено этой бактерией. С возрастом эта цифра приближается к 80 %. Передается от человека к человеку (мы – основной ее резервуар), носителями могут быть и кошки, и овцы, иногда может передаваться с водой… Вакцины нет, одна надежда пока на внучку Аполлона – Гигиену! Нас еще в институте учили: Гигиена – дочка Эскулапа и внучка Аполлона! Когда на экзамене по гигиене в свое время получил одну из немногих троек, это запомнил на всю жизнь!
Заметки на полях
Ученые проследили последовательность генных изменений этой бактерии и пришли к заключению, что ей уже как минимум 58 000 лет, примерно тогда же человечество стало расселяться из своей колыбели – Африки. Теперь врачи (и я в том числе) активно стараемся ее искоренить: вот искореним – и не будет у нас язв, эрозий и изжоги… Но ведь получается, что без этой бактерии люди никогда и не жили! Нарушить экосистему легко, но истребишь вредных насекомых – и начинают от голода вымирать птицы и далее по цепочке… Может, отчасти и поэтому сегодня рекомендации такие: изничтожать хелиобактер пилори, только если есть симптомы – диспепсия, изжога, боль. Если бессимптомное носительство, то и не трогать!
Спирохеты бывают не только бледные. Ниже будет сказано про болезнь Лайма или боррелиоз, которую распространяют клещи. Там возбудитель тоже спирохета, только другая ее разновидность. Коварная болезнь, поражающая не только кожу, но и сердце, суставы, нервную систему. Может давать ложноположительный тест на сифилис (тот, что остается положительным навсегда).
Есть еще и лептоспироз. Эта спирохета передается с водой и через зараженных животных, очень распространена в странах третьего мира, поражает печень, мозг, легкие… От спирохет вакцин нет.

В прессе все чаще говорят о скором кошмарном будущем, где можно будет погибнуть от безобидного пореза: все лекарства окажутся бессильны против даже самой простой инфекции. Апокалиптические сценарии еще далеки от реальности, но проблема антибиотикорезистентности – устойчивости бактерий к лекарствам – с каждым годом становится все острее.
На прошедшей неделе в Давосе британский министр здравоохранения Мэтт Хэнкок призвал "предотвратить ужасное будущее", в котором люди окажутся беззащитны перед бактериями с множественной лекарственной устойчивостью (их иногда называют "супербактериями" или "супермикробами").
Представляя свой план борьбы, Хэнкок сравнил масштаб проблемы антибиотикорезистентности с войнами и изменением климата. Похожими формулировками оперирует Всемирная организация здравоохранения (ВОЗ) и специалисты по всему миру.
Насколько все плохо?
Ситуация пока не критическая, но очень серьезная. Бактерии научились противостоять даже самым сильным и редко применяемым лекарствам ("антибиотикам резерва", таким как колистин), при этом с 1980-х годов принципиально новых антибиотиков практически не появлялось. Исследования идут, но они слишком долгие и дорогие – а бактерии вырабатывают неуязвимость против антибиотиков куда быстрее. Дело осложняется и простотой путешествий: супербактерии получают возможность легко распространяться по всему миру.
Авторы британского исследования антибиотикорезистентности (2016 год) оценивали, что количество смертей от таких супербактерий в мире может вырасти примерно с 700 тысяч в год до 10 миллионов ежегодно к 2050 году – это больше, чем число жертв онкозаболеваний (на момент публикации). Потери ВВП при таком сценарии достигнут 100 триллионов долларов.
Пока не существует систем, позволяющих полноценно отслеживать мировую ситуацию с антибиотикорезистентностью в мировом масштабе. Проект ВОЗ под названием GLASS стартовал в 2015 году и по состоянию на конец 2018 года включал в себя лишь 71 страну. В последний отчет (опубликован в январе 2019 года) вошли данные об антибиотикорезистентности всего из 49 стран, при этом их качество пока не позволяет сравнивать между собой ситуацию в различных государствах и регионах.
В региональных отчетах также не много поводов для оптимизма. Страны Евросоюза за восемь лет (2007-2015) зафиксировали более чем двукратный рост числа погибших от инфекций, вызванных неуязвимыми для антибиотиков микробами, говорится в недавнем исследовании. По количеству потерянных лет здоровой жизни в пересчете на 100 тысяч населения (170) подобные инфекции практически сравнялись с суммарным эффектом ВИЧ, гриппа и туберкулеза (183). Более всего таким инфекциям в ЕС подвержены дети до года и люди старше 65 лет.
Хотя в еще одной свежей публикации крупный госпиталь Марселя показал, что за 15 лет (2001-2016) у них ситуация с резистентностью к антибиотикам не ухудшилась. К тому же, судя по мировой прессе, пока неуязвимые к абсолютно всем антибиотикам инфекции все же не носят массовый характер: громче всего обсуждали отчет двухлетней давности о 70-летней американке, погибшей от неуязвимой для всех антибиотиков бактерии (ее она скорее всего подхватила в Индии, где попала в больницу с переломом).
Какие именно организмы называют супербактериями?
Супербактерии (супермикробы) – это микроорганизмы, обладающие устойчивостью сразу к нескольким антибиотикам. Иногда – ко всем существующим.
В 2017 году ВОЗ опубликовала список из 12 бактерий, для борьбы с которыми срочно нужны новые антибиотики. Критически важны лекарства, способные справиться с устойчивыми к карбапенему энтеробактериями (например, кишечной палочкой E.Coli), синегнойной палочкой (Pseudomonas aeruginosa) и ацинетобактером (Acinetobacter baumannii). Чаще всего именно эти возбудители вызывают так называемые "внутрибольничные инфекции", с которыми врачам особенно сложно бороться из-за множественной устойчивости бактерий и ухудшенного состояния больных.
Также в список ВОЗ попали ванкомицин-резистентные энтерококки (Enterococcus faecium), невосприимчивый к метициллину и ванкомицину золотистый стафилококк (methicillin-resistant staphylococcus aureus, MRSA), цефалоспорин- и фторхинолон-резистентный гонококк, кларитромицин-резистентный хеликобактер и другие бактерии. Они вызывают серьезные болезни: заражение крови, менингит, пневмонию, инфекции мочевыводящих путей и гонорею.
Часто в материалах об антибиотиках фигурируют понятия “грамположительные бактерии” и “грамотрицательные бактерии”. Последние (например, кишечная палочка) обладают двумя клеточными мембранами: с ними сложнее бороться, и эффективных против них антибиотиков в мире меньше.
Как действуют антибиотики и появляется резистентность?
Антибиотики или "противомикробные препараты" – особые вещества, останавливающие рост клеток бактерий или уничтожающие их. Для этого существуют несколько механизмов: как правило антибиотики атакуют клеточную стенку, мешают синтезу белка или ДНК бактерий.
Резистентность к антибиотикам обнаружили вскоре после их появления. Первый в мире антибиотик – перевернувший медицину ХХ века пенициллин – Александр Флеминг открыл в 1928 году, но массово применять его начали лишь в 1942-м. Еще до этого, в 1940-м стало известно об устойчивой к пенициллину кишечной палочке.
Бактерии постоянно меняются, чтобы стать невосприимчивыми к действию антибиотиков: "выгодные" мутации передаются бактериями друг другу. Микробы приспосабливаются к антибиотикам даже в огромной концентрации крайне быстро. Посмотрите на видео, как всего за 11 дней кишечная палочка адаптируется к тысячекратной дозе (в центре) антибиотика:
Главными "инкубаторами" супербактерий оказываются больницы: там, где постоянно применяются мощные антибиотики, растут популяции невосприимчивых к ним микробов. Способствует развитию устойчивости бактерий и сельское хозяйство: там антибиотики широко применяют для профилактики болезней и ускорения роста животных.
Смертельна ли встреча с супербактерией?
Для здорового человека с нормальным иммунитетом – нет. Но чаще всего такие микробы встречаются в больницах, куда попадают люди, уже ослабленные той или иной болезнью. Для пациентов (например, находящихся на искусственной вентиляции легких) встреча с супербактериями может запросто стать фатальной.
Сейчас без антибиотиков невозможны сложные хирургические операции, трансплантации и борьба с раком посредством химиотерапии. Последняя обычно значительно подавляет иммунитет: для таких больных даже самая обычная инфекция может стать смертельной, не говоря уже о вызванной супермикробами.
При этом с инфекциями от мультирезистентных бактерий, пока на них действуют хоть какие-то антибиотики, можно жить, пусть даже это и будет сопряжено со страданиями.
Эмили Моррис рассказала, что супербактерию в ее мочевом пузыре обнаружили в подростковом возрасте, и с тех пор ей пришлось перепробовать множество антибиотиков, в том числе "препараты резерва" вроде карбапенема.
Во время беременности она была вынуждена принимать антибиотик, не проверявшийся на беременных, ее новорожденному ребенку пришлось сразу пройти курс терапии антибиотиками. "Это было очень страшно", – рассказывала 24-летняя Моррис журналу New Scientist в 2017 году.
32-летняя Кэтрин Уильямс уже более 10 лет постоянно принимает антибиотики из-за болезни мочевыводящих путей, вызванной супербактериями.
"Каждый раз, когда заканчивается курс приема антибиотиков, болезнь возвращается, – говорила она в интервью BBC. – Боль просто приковывает тебя к постели до следующего курса приема антибиотиков. То, что мне придется принимать антибиотики всю жизнь, меня очень пугает".
Почему так долго не появляются новые антибиотики?
За последние десятилетия арсенал медиков практически не пополнялся антибиотиками принципиально новых классов. Причин тому несколько.
Разработка таких лекарств – это сложное и затратное занятие, обходящееся в сотни миллионов или миллиарды долларов. Для фармакологических компаний оно не всегда интересно с коммерческой точки зрения: курсы антибиотиков обычно краткосрочны, в отличие от лекарств для хронических заболеваний (антиретровирусная терапия, например, людям с ВИЧ необходима всю жизнь). К тому же из-за быстрого возникновения резистентности растет риск обесценивания инвестиций в разработку новых препаратов.
Тем не менее, в последнее время вошли в обиход мощные антибиотики, полученные на базе старых открытий – в первую очередь, Линезолид (Зивокс). Да и представители существующих классов все время совершенствуются и нередко могут усиливать эффект при совместном использовании.
Что делать?
ВОЗ рекомендует использовать антибиотики только по назначению врача (а врачам – их разумно назначать) и всегда полностью проходить курс лечения, а не останавливать прием антибиотиков сразу после улучшения самочувствия.
Также рекомендуется не хранить, не использовать заново и не передавать другим оставшиеся дозы лекарства.
Важно не пытаться лечить вирусные заболевания антибиотиками, вакцинироваться, укреплять собственный иммунитет и тщательно соблюдать правила гигиены, рекомендует ВОЗ.
Также есть смысл по возможности избегать больниц в регионах, где санитарная ситуация далека от идеальной. В первую очередь – в Азии и Африке. По данным британского отчета, там к 2050 году будет больше всего погибших от инфекций супербактериями.
Если у вас или у близких есть подозрение на такую инфекцию, добейтесь консультации специалиста по инфекционным болезням. Недавнее исследование показало, что это может на 50% снизить смертность от инфекций, вызванных бактериями с множественной лекарственной устойчивостью.
Чего ждать в будущем?
Проблемой невосприимчивости к антибиотикам годами занимаются ученые и специалисты в области охраны общественного здоровья, и поводы для оптимизма есть.
ВОЗ в 2015 году одобрила глобальный план по борьбе с устойчивостью к противомикробным препаратам. Различные страны, в том числе США, Россия и совсем недавно Великобритания, принимают комплексы мер по борьбе с устойчивостью бактерий к антибиотикам. Они включают информирование пациентов и врачей о разумном использовании препаратов, ограничения на применение антибиотиков в сельском хозяйстве и содействие разработкам новых классов антибиотиков.
Несмотря на все сложности, такие разработки уже идут и появляются отдельные многообещающие результаты. Например, теиксобактин – принципиально новый антибиотик, открытый в 2015 году группой ученых из США, Германии и Великобритании.
В конце 2017 года его научились эффективно синтезировать, а в 2018-м действие синтетического теиксобактина успешно проверили на мышах. Но до появления лекарства для людей еще далеко: по оценкам ученых, 6-10 лет.
Оно может и вовсе не появиться: например, многообещающий платенсимицин, представленный в 2006 году, так и не добрался до полноценных клинических тестов из-за его неэффективности при введении стандартными методами. Однако исследования принципов работы платенсимицина позволяют надеяться на появление новых, более эффективных разработок.
В начале 2018 года ученые Рокфеллеровского университета в США представили еще один принципиально новый класс антибиотиков – малацидины, но до появления лекарств на их основе понадобится еще больше времени.
Рассматриваются и другие варианты терапии против супербактерий: целенаправленное усиление иммунитета, антимикробные пептиды, синтетические вещества, позаимствованные у вирусов, добавление особых элементов к уже существующим антибиотикам для повышения эффективности и другие способы. Однако все они пока находятся на разных стадиях готовности и для массового клинического использования не одобрены.
Читайте также:




