Синдром мальабсорбции при вич
ВИЧ/СПИД у детей
Украина относится к числу государств, для которых характерен эпидемический тип распространения ВИЧ/СПИДа. И на сегодняшний день темпы роста эпидемии не замедлились. Причин для этого много, и они достаточно подробно изложены (UNAIDS/WHO, 2008). Вместе с тем врачам различного профиля приходится оказывать помощь как пациентам с известным ВИЧ-статусом, так и тем больным, которые не обследованы и не знают о своем диагнозе, а в ряде случаев сознательно скрывают его. В нашей практике встречались случаи, когда дети несколько лет лечились по поводу проявлений ВИЧ-инфекции (дерматитов, стоматитов, анемии, паротитов, пневмонии) у различных специалистов, но при этом им не проводилось обследование на ВИЧ, и соответственно не был выставлен правильный диагноз.
Поэтому настороженность врача в отношении этой патологии должна базироваться на знании целого ряда симптомов ВИЧ-инфекции, многие из которых имеют свои характерные клинические проявления, в то время как некоторые симптомы могут встречаться и у не ВИЧ-инфицированных пациентов.
ВИЧ-инфекция — болезнь, вызываемая вирусом иммунодефицита человека (ВИЧ), поражающим клетки иммунной, нервной и других систем и органов человека, с длительным хроническим персистирующим течением, завершающаяся развитием СПИДа (синдрома приобретенного иммунодефицита) и сопровождающих его оппортунистических инфекций.
ВИЧ относится к семейству ретровирусов (Retroviride) и представлен двумя типами — ВИЧ-1 и ВИЧ-2. Вирусная частица представляет собой ядро, окруженное оболочкой. Ядро содержит РНК и ферменты — обратную транскриптазу (ревертазу), интегразу, протеазу.
Пути передачи ВИЧ-инфекции у детей:
1. От матери ребенку: во время беременности, родов и кормления грудью.
2. Парентеральный путь: переливание крови, ее компонентов и препаратов, при инъекциях и манипуляциях с использованием инструментов, контаминированных кровью ВИЧ-инфицированного, при трансплантации органов.
3. Половой путь (у подростков).
В отсутствие профилактических мероприятий частота передачи ВИЧ от матери ребенку во время беременности и родов составляет 15–30 %.
При попадании ВИЧ в клетку под воздействием вирусной ревертазы синтезируется провирусная ДНК, которая с помощью вирусной интегразы встраивается в ДНК клетки хозяина, и начинается продукция новых вирусных частиц. Вирус поражает клетки, несущие на своей поверхности рецептор СD4, прежде всего Т-хелперы, а также моноциты, макрофаги, клетки микроглии и др. Прогрессирующее снижение содержания лимфоцитов СD4 ведет к нарастанию иммунодефицита с поражением всех звеньев иммунитета и к развитию оппортунистических инфекций.
Клинические проявления ВИЧ-инфекции включают поражения органов и систем, связанные с непосредственным воздействием ВИЧ, а также развитием оппортунистических инфекций.
К основным поражениям органов и систем ВИЧ относят: увеличение периферических лимфатических узлов, печени и селезенки, нарушение темпов физического развития, синдром истощения (вастинг-синдром), поражения кожи (дерматиты, ксероз, васкулиты, пятнисто-папуллезные высыпания), паротит, поражение дыхательной системы (лимфоидная интерстициальная пневмония), поражение ЦНС (ВИЧ-энцефалопатия), поражения сердечно-сосудистой системы (кардиопатия, сердечная недостаточность), нефропатию (протеинурия, нефротический синдром, почечная недостаточность), поражение пищеварительного тракта (синдром мальабсорбции), гематологические изменения (анемия, лейкопения, тромбоцитопения).
Вастинг-синдром — синдром истощения (рис. 1), относится к диагностическим критериям СПИДа и определяется как:
— снижение массы тела более чем на 10 %;
— хроническая диарея (более 30 дней и дольше);
— документированная лихорадка (интермиттирующего или постоянного типа) на протяжении 30 дней и более.
Вастинг-синдром является независимым прогностическим фактором смерти больных. На рис. 1а показаны начальные проявления истощения, на рис. 1б — нарастание истощения у ребенка вплоть до резкого уменьшения подкожно-жирового слоя.
Паротит (рис. 2). У 2–14 % детей отмечается поражение слюнных желез, что проявляется припухлостью околоушных желез. В одних случаях (рис. 2а) слюнные железы увеличиваются в результате лимфоцитарной инфильтрации, при этом поражение может быть стойким, как односторонним, так и двусторонним, может сопровождаться ксеростомией и болью во рту. При пальпации слюнные железы эластичные, безболезненные, кожа над ними не изменена. При надавливании на железу из протока выделяется прозрачная слюна.
В других случаях (рис. 2б) возникает бактериальный паротит, чаще односторонний, рецидивирующий, который сопровождается лихорадкой, местной болезненностью и гиперемией кожи. При пальпации железа плотная, болезненная, при ее массировании из протока выделяется гной.
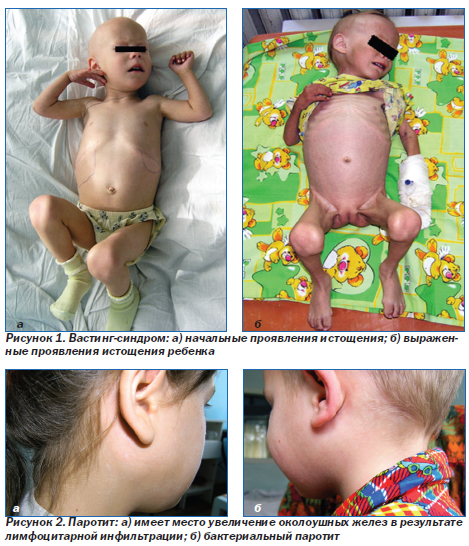
Атопический дерматит (рис. 3). Наряду с частыми инфекционными поражениями кожи при ВИЧ-инфекции у детей возможны проявления атопического дерматита. На рис. 3 — эритематозная сыпь на коже щек.
Ксероз — патологическая сухость кожи (рис. 4) — частое осложнение любого иммунодефицита. Обнаруживаются множественные чешуйки (отторгнутые роговые пластинки) на коже лица (рис. 4) и всего тела. Характерны жалобы на сухость кожи и зуд.
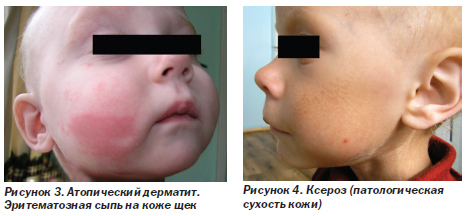
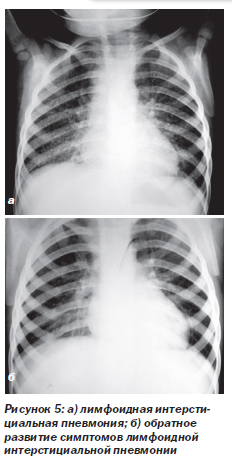
Лимфоидная интерстициальная пневмония (ЛИП) (рис. 5). ЛИП — медленно прогрессирующее состояние. Составляет 30–40 % поражений дыхательных путей у ВИЧ-инфицированных детей. Гистологически ЛИП характеризуется диффузной инфильтрацией межальвеолярных перегородок и лимфатических сосудов зрелыми, преимущественно СD8 Т-лимфоцитами, плазматическими клетками и гистиоцитами. Одним из кофакторов развития заболевания считают вирус Эпштейна — Барр. Клинические проявления обычно возникают в возрасте 2–3 лет (постепенно нарастающая одышка и быстрая утомляемость, иногда кашель). Этим дыхательным симптомам сопутствуют генерализованная лимфаденопатия, гепатоспленомегалия, увеличение околоушных слюнных желез и лимфоцитоз. Физикальные данные обычно отсутствуют или скудные. В далеко зашедшей стадии определяются признаки хронической гипоксии (цианоз, утолщение ногтевых фаланг в виде барабанных палочек). На рентгенограммах грудной клетки (рис. 5а) выявляют двусторонние сетчато-узловые или очаговые альвеолярные инфильтраты, наиболее выраженные в нижних долях. Стойкое обратное развитие симптомов болезни наблюдается только после начала высокоактивной антиретровирусной терапии (ВААРТ) (рис. 5б).
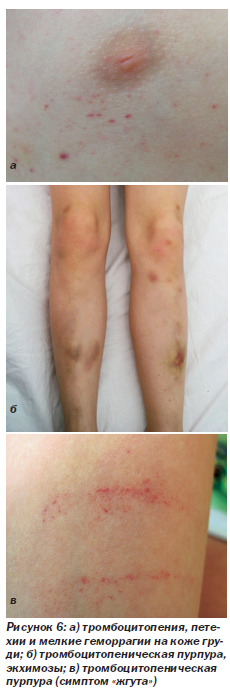
Тромбоцитопения (рис. 6). Выявляется примерно у 30 % детей и подростков, инфицированных ВИЧ. Считается, что при ВИЧ-инфекции тромбоцитопения обусловлена как снижением выработки тромбоцитов, так и ускоренным их разрушением, связанным с иммунными механизмами (это подтверждается эффективностью лечения глюкокортикоидами). Иногда число тромбоцитов самостоятельно возвращается к норме, однако в большинстве случаев без лечения тромбоцитопения сохраняется и прогрессирует. Легкая тромбоцитопения обычно протекает бессимптомно. Однако когда число тромбоцитов снижается до 20 000–50 000 мкл–1, появляется геморрагический синдром. На рис. 6а — петехии и мелкие геморрагии на коже груди. На рис. 6б — экхимозы различной давности на нижних конечностях.
Оппортунистические инфекции: пневмоцистная пневмония, микозы (кандидоз, криптококкоз, кокцидиоидоз), бактериальные инфекции, в том числе туберкулез и атипичные микобактериозы, герпесвирусные инфекции, паразитозы (токсоплазмоз, криптоспоридиоз), опухоли и др.
Пневмоцистная пневмония (рис. 7) — самое частое из СПИД-индикаторных заболеваний. Возбудителем является Pneumocistis jiroveci. Заболевание у детей обычно начинается внезапно, хотя возможно и постепенное развитие болезни в течение нескольких недель. Характерны высокая лихорадка, тахипноэ, одышка, цианоз и непродуктивный кашель. Гипоксемия обычно глубже, чем можно ожидать по результатам физикального обследования.
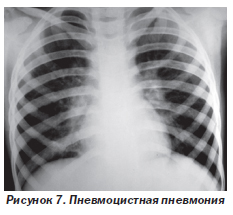
При рентгенографии грудной клетки чаще всего обнаруживают повышение прозрачности легочных полей и двусторонние диффузные интерстициальные изменения (рис. 7). Иногда результаты рентгенографии могут быть нормальными либо могут быть выявлены едва заметные изменения паренхимы. Возможна также сетчатая перестройка легочного рисунка в сочетании с множественными мелкоочаговыми тенями, на фоне которых видны светлые полоски бронхов.
Окончательный диагноз ставят после обнаружения возбудителя при микроскопии окрашенных мазков из содержимого носоглотки, мокроты, бронхоальвеолярной жидкости.
В последние годы заболеваемость пневмоцистной пневмонией резко снизилась после появления высокоактивной антиретровирусной терапии и повсеместного использования медикаментозной профилактики триметопримом/сульфометоксазолом.
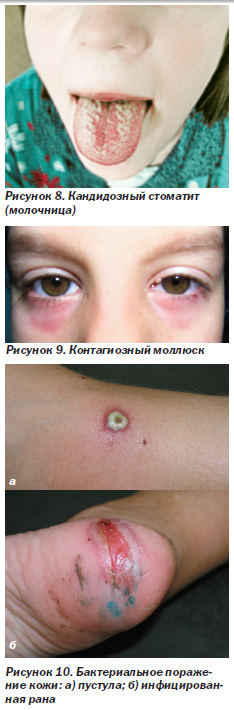
Кандидозный стоматит — молочница (рис. 8) — самая частая оппортунистическая инфекция ротовой полости у ВИЧ-инфицированных детей (распространенность 28–67 %). Обычно развивается при низком или снижающемся числе лимфоцитов СD4. Может проявляться образованием на слизистой красных очагов (атрофический, или эритематозный, кандидоз), белым налетом, который можно снять шпателем (рис. 8, псевдомембранозный кандидоз, или молочница), а также покраснением и трещинами в углах рта (кандидозный хейлит, или заеда). Нередко протекает без жалоб, но иногда сопровождается жжением или болью во рту. Диагноз ставится по клинической картине и подтверждается бактериоскопическим и бактериологическим исследованием. Чаще всего обнаруживаются Candida spp.
Контагиозный моллюск (рис. 9) вызывается ДНК-содержащим вирусом из семейства поксвирусов. Характерны высыпания в виде множественных полусферических папул с пупковидным вдавлением в центре, которые чаще появляются на лице, но могут располагаться и на других участках тела. Диагноз подтверждается при обнаружении в биоптате (содержимом папулы) характерных моллюсковых телец, которые представляют собой крупные вирусные включения овальной формы в цитоплазме кератиноцитов. На рис. 9 — контагиозный моллюск век. При локализации папул по краю век может развиться хронический кератоконъюнктивит.
Бактериальные поражения кожи (рис. 10). ВИЧ-инфицированные дети болеют теми же самыми легкими и тяжелыми бактериальными инфекциями, что и дети с нормальным иммунитетом, но чаще и тяжелее, требуют более серьезной и длительной антибиотикотерапии. Фолликулит, абсцессы, фурункулез, везикулопустулез, импетиго и другие заболевания, которые вызывают банальные бактериальные микроорганизмы, часто обнаруживают у ВИЧ-инфицированных детей с иммуносупрессией. Нередко развиваются рецидивы и гематогенная диссеминация возбудителя. На рис. 10а — пустула, образовавшаяся на месте мелкого поверхностного повреждения кожи (выделен S.aureus). На рис. 10б — инфицированная рана в области стопы.
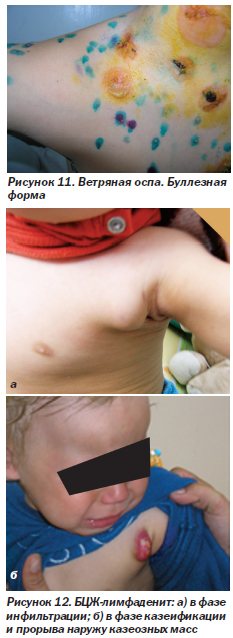
Ветряная оспа (рис. 11). Первичная инфекция герпесвируса человека типа 3 (varicella zoster). У ВИЧ-инфицированных детей она протекает тяжелее и затягивается дольше, чем у детей с нормальным иммунитетом, а также чаще возможны повторные случаи заболевания. Может приобретать буллезную форму (рис. 11) с преобразованием некоторых типичных везикул в различные по размеру буллы. Возможно развитие генерализованной формы с поражением внутренних органов. Описаны случаи хронического течения ветряной оспы у ВИЧ-инфицированных детей, не получающих ВААРТ, когда новые высыпания появлялись в течение 1 месяца и держались от 2 до 24 месяцев.
Вакцинация БЦЖ (рис. 12). Вакцинация против туберкулеза детям с ВИЧ-инфекцией противопоказана из-за повышенного риска развития осложнений. На рис. 12а показан БЦЖ-лимфаденит в фазе инфильтрации, на рис. 12б — БЦЖ-лимфаденит в фазе казеификации и прорыва наружу казеозных масс.
1. Запорожан В.М., Аряєв М.Л. ВІЛ-інфекція і СНІД. — К.: Здоров''я, 2004. — 636 с.
3. Джон Бартлетт, Джоэл Галант. Клинические аспекты ВИЧ-инфекции. — Балтимор, Мэриленд, 2003. —577 с.
Полный текст:
Морфологические и функциональные расстройства пищеварительной системы при ВИЧ-инфекции встречаются на всей протяженности желудочно-кишечного тракта: в ротовой полости, пищеводе, желудке, тонкой и толстой кишке, печени, поджелудочной железе, желчном пузыре. Представлен литературный обзор этиологии и клинических проявлений патологии желудочно-кишечного тракта у ВИЧ-инфицированных. Показано, что поражение пищеварительной системы при ВИЧ-инфекции обусловлено не только прямым действием вируса, но и влиянием оппортунистических агентов, а также хроническим воспалением и усугублением иммунодефицита без антиретровирусной терапии. На фоне специфического лечения поражение желудочно-кишечного тракта может развиваться за счет полифармации. Перспективным направлением восстановления биоценоза кишечника у пациентов с ВИЧ-инфекцией можно считать применение пробиотиков.
д-р мед. наук, профессор кафедры инфекционных болезней
450008, г. Уфа, ул. Ленина, 3
канд. мед. наук, заместитель директора, ассистент
100097, Узбекистан г. Ташкент, ул. Чилонзар, 6–36
100007, Узбекистан, г. Ташкент, ул. Паркентская, 51
д-р мед. наук, ст.н.с.
100097, Узбекистан г. Ташкент, ул. Чилонзар, 6–36
100007, Узбекистан, г. Ташкент, ул. Паркентская, 51
канд. мед. наук, директор, ассистент
100097, Узбекистан г. Ташкент, ул. Чилонзар, 6–36
100060, Узбекистан, г. Ташкент, Мирабадский р-н, ул. Яхъе Гулямова, 74
канд. мед. наук, доцент, заведующая отелом методической и профилактической работы Центра по профилактике и борьбе со СПИД и инфекционными заболеваниями, доцент Школы биомедицины Дальневосточного федерального университета
690001 г. Владивосток, ул. Борисенко, 50
клинический ординатор кафедры инфекционных болезней
450008, г. Уфа, ул. Ленина, 3
1. Ахмеджанова З.И., Урунова Д.М., Исаева Г.Н. [и др.]. Распространенность и частота сопутствующих и оппортунистических заболеваний на разных стадиях ВИЧ-инфекции // Журн. теоретич. и клин. медицины. 2015. № 4. С. 166–168.
2. Барановский А.Ю. Европейский регистр Helicobacter pylori (Hp-EuReg): анализ данных 2360 больных, получавших терапию первой линии в России // Тер. архив. 2018. № 2. С. 35–41.
3. Багненко С.Ф., Беляков Н.А., Ястребова Е.Б. [и др.]. Обоснование, задачи и реализация междисциплинарной подготовки в области социально-значимых инфекций // Ученые записки СПбГМУ им. И.П. Павлова. 2014. Т. XXI, № 2. С. 10–16.
4. Белякова Н.А., Рахманова А.Г. Вирус иммунодефицита человека: руководство для врачей. М.: Медицина, 2011. 655 с.
5. Воронин Е.Е., Афонина Л.Ю. Рахманов А.Г. [и др.]. Диспансерное наблюдение, уход и лечение детей, рожденных ВИЧ-инфицированными женщинами, и детей с ВИЧ-инфекцией // Краткое руководство для специалистов центров по профилактике и борьбе со СПИДом. М., 2006. 108 с.
6. Бегайдарова Р.Х. Сагимбаев Б.Ж., Алшынбекова Г.К. [и др.]. Профилактика передачи ВИЧ-инфекции от матери ребенку // Актуальные вопросы ВИЧ-инфекции: тез. междунар. научно-практ. конф. СПб., 2016. С. 37–40.
7. Гурбанова Э.В. Микробиоценоз кишечника и особенности иммунного ответа у детей, больных паразитозами // Детские инфекции. 2010. № 2. С. 34–37.
8. Змушко Е.И. Системная оценка риска распространения инфекционных заболеваний (на моделях туберкулезной и ВИЧ-инфекции) // Эпидемиология и инфекционные болезни. 2012. № 3. С. 60–61.
9. Колько А.П., Рыбковская О.С. Поражение печени и желудочно-кишечного тракта при ВИЧ-инфекции // Научные стремления: молодежный сборник научных статей. Гомель, 2014. № 4. C. 52–53.
10. Ли Ю.А., Скляр Л.Ф., Маркелова Е.В., Борисенко Е.А. Роль интерферона-альфа в иммунологическом ответе на фоне противовирусной терапии хронического гепатита С у пациентов с ВГС/ВИЧ-коинфекцией // Тихоокеанский медицинский журнал. 2009. № 4. С. 52–54.
11. Матиевская Н.В., Токунова И.О. Клинико-лабораторные проявления ВИЧ-инфекции в зависимости от тропизма вируса // Актуальные вопросы ВИЧ-инфекции: тез. межд. научно-практ. конф. СПб., 2016. С. 278.
12. Мусабоев Э.И., Латыпов Р.Р. Диарейный синдром при ВИЧ-инфекции // Инфекция, иммунитет и фармакология. 2011. № 4–5. C. 123–125.
13. Нурузова З.А., Хасанов Ф.Ш., Ганиева С.К. Изменчивость кишечной микрофлоры у ВИЧ-инфицированных больных // Биология и интегративная медицина [Электронный журнал]. 2016. № 4. С. 15–35.
14. Охонская Л.В., Воронин Е.Е. ВИЧ-инфекция у детей в Российской Федерации (клинико-эпидемиологическая характеристика) // Актуальные вопросы ВИЧ-инфекции: Мат. междунар. научно-практ. конф. СПб., 2016. С. 12–20.
15. Покровская А.В., Козырина Н.В., Гущина Ю.Ш. Женщины, живущие с ВИЧ: кто они? // Актуальные вопросы ВИЧ-инфекции: мат. междунар. научно-практ. конф. СПб., 2016. С. 293.
16. Рахманова А.Г., Яковлев А.А., Дмитриева М.И. [и др.]. Анализ причин смерти ВИЧ-инфицированных в 2008–2010 гг. по материалам клинической инфекционной больницы им. С.П. Боткина, г. Санкт-Петербург // Казанский медицинский журнал. 2012. Т. 93, № 2. С. 522–526.
17. Хасанова Г.М., Борискова К.И., Хасанова А.Н., Калимуллина Л.М. Клинико-лабораторные проявления вирусных диарей у детей на современном этапе // Инфекционно-воспалительные заболевания как междисциплинарная проблема: Мат. межрег. научно-практ. конф., посвященной 50-летию МГУ им. Н.П. Огарева. Саранск, 2017. С. 231–235.
18. Хасанова Г.М., Гатиятуллина Г.Т., Мухутдинова Ю.И., Музыченко А.В. Проблемы диагностики цитомегаловирусного гепатита // Инфекционные болезни. 2014. Т. 12, № S1. С. 329.
19. Хасанова Г.Р., Анохин В.А., Биккинина О.И. [и др.]. Нарушения микробиоценоза кишечника у больных ВИЧ-инфекцией // Казанский медицинский журнал. 2013. № 1. С. 34–39.
20. Хасанова Г.М., Шафеева Л.С. Организация социально-медицинской помощи ВИЧ-инфицированным // Актуальные проблемы социогуманитарного знания: сборник научных статей. Уфа, 2014. С. 61–69.
21. Brenchley J.M., Douek D.C. HIV infection and gastrointestinal immune system // Mucosal Immunol. 2008. Vol. 1. P. 23–30.
22. Brenchley J.M., Douek D.C. The mucosal barrier and immune activation in HIVpathogenesis // Curr. Opin. HIV AIDS. 2008. Vol. 3, No. 3. P. 356–361.
23. Clavel F., Hance A.J. HIV drug resistance // NEJM. 2004. Vol. 350, No. 10. P. 1023–1035.
24. Deeks S.G., Lewin S.R., Havlir D.V. The end of AIDS: HIV infection as a chronic disease // The Lancet. 2013. Vol. 382 (9903). P. 1525–1533.
25. Gori A., Tincati C., Rizzardini G. [et al.]. Early impairment of gut function and gut flora supporting a role for alteration of gastrointestinal mucosa in human immunodeficiency virus pathogenesis // J. Clin. Microbiol. 2008. Vol. 46, No. 2. P. 757–758.
26. Kooij K.W., Wit F.W., van Zoest R.A. [et al.]. Liver fibrosis in HIV-infected individuals on long-term antiretroviral therapy: associated with immune activation, immunodeficiency and prior use of didanosine // J. AIDS. 2016. Vol. 30, No. 11. Р. 1771–1780.
27. Laderman M.M., Margolis L. The lymph node in HIV pathogenesis // Semin. Immunol. 2008. Vol. 20, No. 3. P. 187–195.
28. Monachese M., Cunningham-Rundles S., Diaz M.A. [et al.]. Probiotics and prebiotics to combat enteric infections and HIV in the developing world: a consensus report // Gut microbes. 2011. Vol. 2, No. 3. P. 198–207.
29. O’Rourke A. Infective oesophagitis: Epidemiology, cause, diagnosis and treatment options // Curr. Opin. Otolaryngol. 2015. Vol. 23, No. 6. P. 459–463.
30. Piroth L. Liver steatosis in HIV-infected patients //AIDS Rev. 2005. No. 7. P. 197–209.
31. Puri P., Kumar S. Liver involvement in human immunodeficiency virus infection // Indian J. Gastroenterol. 2016. Vol. 35, No. 4. – P. 260–273.
32. Redd A.D., Gray R.H., Quinn, T.C. Is microbial translocation a cause or consequence of HIV disease progression? // J. Infect. Dis. 2011. Vol. 203, No. 5. P. 744–745.
33. Roe B., Hall W. Cellular and molecular interactions in coinfection with hepatitis C virus and human immunodeficiency virus // Expert Rev. Mol. Med. 2008. No. 10. P. 30.
34. Underhill D.M., Iliev I.D. The mycrobiota: interactions between commensal fungi and the host immune system // Nat. Rev. Immunol. 2014. Vol. 14, No. 6. P. 405–416.
35. Wachssmannova L., Ciernikova S., Majek J. [et al.]. Internalization property of intestinal bacteria in colon cancer and HIV/AIDS patient // Neuro Endocrinol. Lett. 2016. Vol. 37, No. 3. P. 245–250.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.


Автореферат диссертации по медицине на тему Клинико-лабораторная характеристика микроспоридиоза и криптоспоридиоза у ВИЧ-инфицированных пациентов.
На правах рукописи
СОКОЛОВА Ольга Игоревна
КЛИНИКО-ЛАБОРАТОРНАЯ ХАРАКТЕРИСТИКА МИКРОСПОРИДИОЗА И КРИПТОСПОРИДИОЗА У ВИЧ-ИНФИЦИРОВАННЫХ ПАЦИЕНТОВ
14.01.09 - инфекционные болезни
диссертации на соискание ученой степени кандидата медицинских наук
доктор медицинских наук профессор Яковлев Алексей Авенирович Официальные оппоненты:
Жданов Константин Валерьевич, доктор медицинских наук профессор
Лиознов Дмитрий Анатольевич, доктор медицинских наук
Защита состоится А0-02013 года в /«/ часов на заседании совета по защите докторских и кандидатских диссертаций Д215.002.01 на базе Федерального государственного казенного военного образовательного учреждения высшего профессионального образования "Военно-медицинская академия имени 'С.М. Кирова" Министерства обороны Российской Федерации (194044, Санкт-Петербург, ул. Академика Лебедева, 6).
С диссертацией можно ознакомиться в фундаментальной библиотеке Военно-медицинской академии имени С.М. Кирова
Автореферат разослан « 2013 года
Ученый секретарь диссертационного совета доктор медицинских наук профессор
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Возникновение микроспоридиоза и криптоспоридиоза сопровождается развитием синдрома мапьабсорбции, что приводит к длительным диареям и развитию синдрома истощения у ВИЧ-инфицированных пациентов [Kotler, D. Р., Orenstein, J. M, 1998; Cama,V. et al., 2007].
В клиниках Российской Федерации диагностика микроспоридиоза не выполняется, а диагностика криптоспоридиоза осуществляется с использованием устаревших методик. Данных по распространенности, клинической картине, спектру возбудителей, эпидемиологическим характеристикам криптоспоридиоза в России крайне мало, а исследования, посвященные микроспоридиозу человека, ранее не проводились никогда.
Степень разработанности темы исследования. Микроспоридии человека и вызываемые ими оппортунистические инфекции у больных иммунодефицитом активно изучались европейскими и американскими учеными, I. Desportes, A. Cali , Е. S. Didier, L. M. Weiss, D. M. Orenstein, C. Franzen и др. Микроспоридии человека в России не изучались. В то же время, в Санкт-Петербурге в Институте защиты растений (ВИЗР) активно работает научная группа под руководством известного паразитолога проф. И. В. Исси,
которая занимается проблемами биологии микроспоридий на паразито-хозяинных системах с участием насекомых. Особенности клинико-лабораторного течения и распространенность криптоспоридиозов человека освещены в работах Л. Ксяо., Р. Фанера., В. Кама (США) и др. В России большую роль в изучении криптоспоридиозов человека сыграла проф. Т. В. Бейер. Под ее руководством был отработан светооптический метод диагностики криптоспоридиоза у домашних животных и человека.
Настоящее исследование - попытка восполнить пробел в изучении микроспоридий и криптоспоридий человека в России, а также роли этих патогенов в развитии диарейного синдрому у ВИЧ-инфицированных пациентов.
Цель исследования: изучить клинические проявления и лабораторные показатели при микроспоридиозе и криптоспоридиозе у ВИЧ-инфицированных пациентов.
1. Определить частоту встречаемости и видовой состав представителей рода Cryptosporidium и типа Microsporidia, выявленных у ВИЧ-инфицированных пациентов в Санкт-Петербурге.
2. Оценить клинические проявления и лабораторные показатели при микроспоридиозе у ВИЧ-инфицированных пациентов.
3. Изучить клинические проявления и лабораторные показатели при криптоспоридиозе у ВИЧ-инфицированных пациентов.
4. Исследовать факторы риска развития микроспоридиоза и криптоспоридиоза у ВИЧ-инфицированных пациентов.
Научная новизна исследования.
Отработана и проведена клиническая диагностика микроспоридиоза у ВИЧ-инфицированных пациентов, определен видовой состав
микроспоридий, описаны клинико-лабораторные особенности течения криптоспоридиоза и микроспоридиоза, а также проанализирована значимость этих инфекционных заболеваний в развитии диарейного синдрома и синдрома потери веса у ВИЧ-инфицированных пациентов.
В частности, показано, что частота встречаемости микроспоридиоза и криптоспоридиоза в Санкт-Петербурге - соответственно 19% и 17,2%. Основные виды микроспоридиий, паразитирующих в кишечнике ВИЧ-инфицированных пациентов это Encephalitozoon intestinalis, Enc. cuniculi, Enterocytozoon bieneusi и Enc. hellem, а криптоспоридий - Cryptosporidium parvum и С. hominis. Микроспоридиальные инфекции вызывают диарею, осложненную синдромом мальабсорбции, с преимущественным нарушением всасывания углеводов, что приводит к тяжелой (более 10%) потери веса и к развитию анемии. Микроспоридиоз чаще обнаруживается у ВИЧ-инфицированных пациентов с низким (менее 100 клеток/мл крови) количеством CD4(+) Т-лимфоцитов. Для криптоспоридиоза характерно развитие длительных (более 10 суток) диарей. Криптоспридиоз чаще обнаруживается у ВИЧ-инфицированных пациентов с количеством CD4(+)
Т-лимфоцитов менее 200 клеток/мл крови. Развитие микроспоридиоза характерно для лиц без определенного места жительства и для лиц, злоупотребляющих алкоголем. Развитие криптоспоридиоза ассоциировано с употреблением внутривенных наркотических препаратов.
Теоретическая и практическая значимость работы. Полученные данные позволяют расширить представления об оппортунистических инфекциях, возникающих при СПИДе. Проведенные исследования позволили определить группы риска, предложить методы диагностики криптоспоридиоза и микроспоридиоза и сформулировать рекомендации для практического здравоохранения.
Пациентов с ВИЧ-инфекцией, сопровождающейся длительной диареей, необходимо обследовать на микроспоридиоз и криптоспоидиоз, т.к. показана достаточно частая встречаемось микроспоридий и криптоспоридий у данной группы пациентов и выявлена взаимосвязь наличия этих возбудителей с развитием синдрома мальабсорбции. Пациентам с микроспоридиозом и криптоспоридиозом необходимо назначать специальную терапию или начинать антиретровирусную терапию для повышения уровня CD4(+) Т-лимфоцитов, иррадикации возбудителей, предотвращения синдрома мальабсорбции и восстановления функции кишечника.
ВИЧ-инфицированным пациентам без определенного места жительства, а также, имеющим зависимость от алкоголя, которые наиболее подвержены заражению микроспоридиями, следует назначать обследование на микроспоридиоз и криптоспоридиоз в обязательном порядке.
Отработаны лабораторно-клинические методы диагностики изучаемых патогенов. В частности, показано, что для диагностики и определения видовой принадлежности микроспоридиий предпочтительнее использовать метод ПЦР.
Методология и методы исследования.
В исследовании использованы общенаучные и специальные эпидемиологические, клинические, и лабораторные методы, широко используемые в современных научных исследованиях. К ним относятся: стандартные методы сбора эпидемиологического анамнеза и объективного осмотра больных; микроскопические методы анализа мазков с помощью световой и флуоресцентной микроскопии; молекулярно-биологические методы, такие как выделение ДНК, ПЦР, гель-электрофорез; анализ сиквенсов. Достоверность всех полученных результатов оценивалась статистическими методами.
Основные положения, выносимые на защиту.
1. Частота встречаемости микроспоридиоза в Санкт-Петербурге среди ВИЧ-инфицированных пациентов составила 19%. Основными выявленными видами микроспоридий были Encephalitozoon intestinalis, Enc. cuniculi, Enterocytozoon bieneusi и Enc. hellem. Частота встречаемости криптоспоридиоза составила 17,2%. Основными возбудителями были Cryptosporidium parvum и Cryptosporidium hominis.
2. Развитие микроспоридиоза характерно для лиц без определенного места жительства и для лиц, злоупотребляющих алкоголем. Развитие криптоспоридиоза ассоциировано с употреблением внутривенных наркотических препаратов.
3. Микроспоридиальные инфекции вызывают диарею, осложненную синдромом мальабсорбции, с преимущественным нарушением всасывания углеводов, что приводит к тяжелой (более 10%) потери веса и к развитию анемии. Микроспоридиоз чаще обнаруживается у ВИЧ-инфицированных пациентов с низким (менее 100 клеток/мл крови) количеством CD4(+) Т-лимфоцитов. Для криптоспоридиоза характерно развитие длительных (более 10 суток) диарей. Криптоспоридиоз чаще обнаруживается у ВИЧ-инфицированных пациентов с количеством CD4(+) Т-лимфоцитов менее 200 клеток/мл крови.
Степень достоверности и апробация результатов исследования.
Достоверность полученных результатов обусловлена
репрезентативностью и достаточностью выборки пациентов, включенных в исследование, объемом проанализированного материала, адекватностью методов исследования. Методологические подходы, использованные в исследовании, корректны и современны. Лабораторные эксперименты осуществлялись на сертифицированном и проверенном оборудовании.
Основные положения и материалы диссертации были представлены в виде докладов на 5-м Европейском протистологическом конгрессе (V European Congress of Protistology and XI European Conference on Ciliate Biology), Санкт-Петербург, 2004 г.; на 12-м Международном симпозиуме по оппортунистическим протестам (IWOP-12), Нью-Йорк, 2012 г., на 7-й и 8-й Ассамблеях молодых ученых и специалистов СПбГУ. По материалам диссертации опубликовано 9 печатных работ, в том числе 3 статьи в рецензируемых изданиях, рекомендованных ВАК Минобрнауки РФ, а также две в иностранных журналах.
Результаты исследований внедрены в практическую деятельность кафедры Инфекционных болезней, эпидемиологии и дерматовенерологии Медицинского факультета СПбГУ, СПб ГУЗ Клинической инфекционной больницы им. С.П. Боткина, включены в план тематических занятий со студентами, интернами, ординаторами и аспирантами Медицинского факультета СПбГУ.
Объем и структура диссертации. Диссертационная работа состоит из введения, основной части, включающей обзор литературы, описание
материалов и методов и результатов исследования, заключения, состоящего из обсуждения полученных результатов и выводов, списка литературы. Работа изложена на 121 странице машинописного текста, иллюстрирована 14 рисунками, 28 таблицами и одним приложением. Список литературы содержит 145 источников, в том числе 7 отечественных и 138 зарубежных.
Микроспоридиоз и криптоспоридиоз - оппортунистические инфекции у-пациентов с выраженным иммунодефицитом [Didier, Е. S., Weiss, L. M., 2006]. Зараженность микроспоридиозом больных СПИДом колеблется от 2 до 50% [Canning, Е: U., Hollister, W. S., 1990]. Самый распространенный вид микроспоридий человека — Enterocytozoon bieneusi, далее следуют Encephalitozoon. intestinalis, Enc. cuniculi и Enc. hellem [Didier, E. S., Weiss, L. M., 2006, Endeshaw, T., et al., 2006]. Реже встерчаются другие виды микроспоридий. Частота встречаемости криптоспоридиоза составляет 5 -20% [Cama, V. et al., 2007]. У человека паразитируют 2 вида криптсопоридий — С. parvum, передающийся к человеку от животных, и С. hominis, для которого характерен антропонозный механизм передачи [Cama, V. et al., 2007, Raccurt, С. et al., 2006, Muthusang, D. et al., 2010].
Возникновение этих заболеваний сопровождается поражением слизистой оболочки кишечника и развитием ряда патологических изменений, проявляющихся в снижении активности гликолитических ферментов: лактазы, а-глюкозидазы, а также в снижении абсорбции крахмала, d-ксилозы и некоторых моносахаров [Kotler, D. P., Orenstein, J. M., 1998, Schmidt, W., 1997]. В результате формируется синдром мальабсорбции и диарейный синдром, с длительностью более 4-х недель [Endeshaw, T. et al., 2006, Bern, С. et al., 2005], который приводит к выраженному снижению массы тела [Dascomb, К. et al., 1999]. Некоторые виды способны вызывать диссеминированные процессы [Didier, E. S., 1995, Dillingham, R. А., 2002].
Материалы и методы исследования.
Работа выполнена в клинической инфекционной больнице им. С.П. Боткина. Всего было обследовано 158 ВИЧ-инфицированных пациентов.
Для выявления микроспоридий и криптоспоридий изучались образцы стула, взятые у пациентов, находящихся в стационаре. В группу пациентов, обследуемых на микроспоридиоз, было включено 158 пациентов, а в группу обследуемых на криптоспоридиоз - 99 пациентов. Критерии включения: ВИЧ-инфицированные пациенты с диареей в возрасте от 20 до 50 лет. Критерии исключения: ВИЧ-инфицированне пациенты, получающие АРВТ, выявление шигеллеза и сальмонеллеза при бактериологическом исследовании.
Клиническое наблюдение за больными включало в себя сбор анамнеза заболевания и эпидемиологических данных, опрос пациента, анализ историй болезней пациентов, анализ температурной кривой во время нахождения в 2 стационаре и оценка динамики веса пациентов за последние 2 года. Также
изучались лабораторные показатели клинического анализа крови, данные микроскопического исследования кала, посевов кала на бактерии родов Shigella, Salmonella, условно-патогенную флору, грибы рода Candida. Иммунологические показатели снижения С04-клеток оценивались однократно в ближайшие 2 недели до или после сбора кала на исследования.
Среди обследованных на микроспоридиоз было 107 мужчин и 51 женщина (67,7% и 32,3% соответственно). Средний возраст женщин составил 31,0 ± 8,27 лет, а мужчин - 32,3 ± 8,56 лет. Среднее количество CD4 (+) Т-лимфоцитов для всех пациентов составило 106,5 кл/мкл (Рю=11, Р9о=543).
Среди обследованных на криптоспоридиоз, было 64 мужчины и 35 женщин (64,6% и 35,4% соответственно). Возраст женщин составил 30,0 ± 6,96 лет, а мужчин - 33,7 ± 9,24 лет. Среднее количество CD4(+) Т-лимфоцитов для всех пациентов составило 63,5 кл/мкл (Рю=9, Р9о=450).
Для выявления микроспоридий и криптоспоридий от одного до трех последовательных образцов стула от одного пациента собирались в течение трех дней и хранились либо в 2,5% растворе К2Сг207 при температуре 4°С, либо замороженными при температуре -20°С. Всего было собрано 247 образцов от 158 пациентов.
Световая микроскопия. Для выявления микроспоридий стекла с нанесенными мазками стула фиксировали метанолом, окрашивали флуоресцентным красителем Калькофлором и/или Голубым Трихромом и просматривали под микроскопом Leica DM 2500. Для выявления криптоспоридий фиксированные мазки окрашивали карбол-фуксином (модификация окраски по Цилю-Нильсену) (Garcia et al., 1983) и просматривали в световом микроскопе при увеличении 1.000Х.
ГШР-диагностика. Выделение ДНК из образцов кала для диагностики микроспоридиоза и криптоспоридиоза проводилось по методике Xiao, L. et al. (2002). Амплификация ДНК выполнялась методом вложенного ПЦР (nested PCR).
Сиквенирование продуктов ПЦР. Для видовой диагностики микроспоридиозов ампликоны нужного размера вырезали из 2% агарозного геля. ДНК извлекали из геля с помощью набора Wizard SV Gel and PCR Cleanup System (Promega, Madison, WI, USA) согласно инструкции производителя. ПЦР для сиквенирования проводилась на амплификаторе системы Applied BioSystems BigDie Terminator (version 3.1); ПЦР-продукты анализировалась на сиквенаторе Beckman Coulter Seq 8000 DNA sequencer. Для сиквенирования использовали гтраймеры MSP-3, МСП-4А, и MSP-4B; каждый ампликон прочитывался в двух направлениях.
Для видовой диагностики криптоспоридиоза реакцию сиквенирования осуществляли при помощи набора реагентов DYEnamic ET dye terminator cycle sequencing kit (US81090, Applied Biosystems) с праймерами AL3532, AL3534 и промежуточным праймером AL3533: 5'-GAG ATATATCTTGGTGCG-3 '.
Анализ полиморфизма длин рестрикционных фрагментов (ПДРФ). С
целью установления вида криптоспоридий ДНК, амплифицированную с помощью ПЦР (ББи гТША области геномной ДНК), подвергали рестрикционному анализу. Для рестрикции ПЦР продукта использовали две рестриктазы: Ээр! и Узр1 (Сибэнзим, Россия) (Таблица 1).
Для статистической обработки данных использовалась программа 81а^иса 6.0.
Распределение длин рестрикционных фрагментов продуктов ПЦР ЗБи _области у представителей разных видов криптоспоридий_
Вид возбудителя криптоспоридиоза Фермент рестрикции Длины получаемых при рестрикции фрагментов (количество пар оснований), ♦жирным выделены видимые в геле фрагменты
С. hominis Sspl 450,267,111, 12, И
С. parvum Sspl 450,267,108, 12, 11
VspI . 629,115, 104
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Диагностика возбудителей. Световая микроскопия показала наличие спор микроспоридий в стуле у 17 пациентов после окраски мазков Калькофлором, и у 19 пациентов после окраски Трихромом. Метод ПЦР выявил наличие ДНК микроспоридии у 28 пациентов (Таблица 2).
Количество пациентов, у которых были диагностированы
Оба красителя Калькофлор - Трихром - Оба красителя - Всего
отр. положит. положит. положит.
PCR-отриц. 125 1 2 2 130
PCR-положит. 10 3 4 11 28
Всего 135 4 6 13 158
Инфицированными микроспоридиями мы считали пациентов, в образцах от которых возбудители были обнаружены при использовании ПЦР или обоих методов световой микроскопии. Таковыми оказались 30 (19%) из 158 обследованных пациентов.
Сиквенирование продуктов ПЦР и сравнение полученных сиквенсов с имеющимися в базе данных Генбанка позволило идентифицировать большинство видов микроспоридий. Вид Е. intestinalis был выявлен у 21 пациента (70%), Е. amiculi - у 3 человек (10%), Е. hellem - у одного (3,33%), а Е. bieneusi - у 2 (6,66%) пациентов. У одного пациента были обнаружены микроспоридии двух видов Е. intestinalis и Е. cuniculi (Таблица 3).
Результаты обследования пациентов на микроспоридии методами _световой микроскопии, ПЦР и сиквенирования___
Вид возбудителя № паи Номер образца, исследуемого различными методами'
Читайте также:


