Пневмоцистная пневмония у вич инфицированных гистология
Похожие темы научных работ по клинической медицине , автор научной работы — Чабан Т. В., Бочаров В. М.
Матер1али конференцП / РгосеесНпдэ of Conference
чшки збер1галось у 18 (32,1 %) пащентгв. У маркерному профш на момент виписки виявлено збережен-ня циркуляцп в кров1 HBsAg — у 36 (64,3 %) хворих, аЩьНВсог — у в еаъ просвете альвеол, наличие разрушенных альвеоцитов 1-го типа, эозинофильный белковый экссудат и характерные признаки воспаления указывают на развитие ПП у данных больных.
Выводы. Таким образом, недиагностированная пневмоцистная пневмония и, как следствие, отсутствие соответствующей этиотропной терапии явились непосредственной причиной смерти больных.
На наш взгляд, на поздних стадиях ВИЧ-инфекции у больных при выявлении объективных клинических и рентгенологических признаков поражения легких следует проводить исследование мокроты, а при возможности — бронхолегочного содержимого методом ПЦР дня возможного обнаружения Р. ргтеа и решения вопроса о назначении соответствующей этиотропной терапии.
Чабан Т, В. \ Чубач М.И.\ Бочаров В. МЛ Дзыгал Р.П.1, Пастерначенко Н.С.2, Верба Н.В.1
Циклоспороз: особенности течения и клинические случаи
Актуальность. Транспортировка различных патогенов между государствами и странами сегодня является неизбежной, поскольку многие продукты перевозятся на большие расстояния, что сопряжено с контактом с людьми. Высокий удельный вес импортированных продуктов из развивающихся стран приводит к тому, что диарея путешественников становится возможной и в высокоразвитых странах. При этом заболевшим необязательно совершать международные поездки.
Цель: показать особенности клинических проявлений и течения циклоспороза.
стороженности и знаний врачей. В июне 2018 г. в Одессе лабораторно подтверждены 2 случая циклоспороза, привезенного из Мексики. Источником инфекции послужил, возможно, салат из свежих овощей.
Циклоспоридиоз, или циклоспороз — заболевание, вызванное простейшими Cyclospora cayetanensis, сопровождающееся выраженной диареей. Эти кокцидии таксономически связаны с изоспорами (род Isosporci) и Cryptosporidium parvum.
Cyclospora cayetanensis — новый возбудитель диа-рейного синдрома, возникающего у иммунокомпетен-тных, иммуноскомпрометированныхлиц, ВИЧ-инфи-цированных и больных СПИДом.
Инкубационный период составляет от 2 до 14 дней. Основной симптом — внезапная, водянистая диарея без крови, с лихорадкой, коликами в животе, тошнотой, анорексией, недомоганием и потерей веса. У иммуно-компетентных пациентов болезнь обычно заканчивается спонтанно, но может длиться в течение 9 недель.
У больных с угнетением клеточно-опосредованно-го иммунитета циклоспороз может явиться причиной тяжелой, непрекращающейся, обильной диареи, напоминающей криптоспоридиоз. Внекишечные заболевания у ВИЧ-инфицированных могут включать холецистит иди ссеминированную инфекцию.
Диагноз устанавливается в случае обнаружения оо-цист при микроскопическом исследовании кала. Обнаружение облегчается окрашиванием образцов кала по Цилю — Нильсену модифицированной кислотостойкой окраской или модифицированным сафранином.
При исследовании на простейшие обнаружены Cyclospora cayetanensis, у больного Д. в количестве 0—2— 4 ооцисты в поле зрения, а у больного П. в количестве 3—5—7 ооцист в поле зрения.
Обоим больным проводили регидратационную терапию, в качестве этиотропного лечения назначали ци-профлоксацин 1000 мг два раза в день в течение 7 дней.
Пациенты выписаны из стационара в удовлетворительном состоянии, после троекратного контрольного отрицательного результата исследования кала на наличие ооцист Cyclospora cayetanensis.
Выводы. На наш взгляд, при острых гастроэнтеро-колитах и диареях неясной этиологии целесообразным является обследование на наличие ооцист Cyclospora cayetanensis, особенно в случаях, когда больные прибыли из регионов, эндемичных по циклоспорозу.
Aktual'naä Infektologiä, ISSN 2312-413Х (print), ISSN 2312-4148 (online)
Аннотация научной статьи по клинической медицине, автор научной работы — Михайловский Алексей Модестович, Чуркин Сергей Александрович
Цель исследования анализ патоморфологических проявлений сочетанной патологии пневмонии, вызванной Pneumocystis carinii и прогрессирующего туберкулеза у больных на поздних стадиях ВИЧ-инфекции . Материал и методы. Проведено патолого-анатомическое исследование 6 пациентов с наличием генерализованных форм туберкулеза , ВИЧ-инфекции и пневмоцистной пневмонии . Группу исследованных больных составляли 4 мужчин и 2 женщины в возрастном промежутке от 20 до 37 лет, с поздними стадиями ВИЧ-инфекции (4Б, 4В стадии) с уровнем CD 4 T-лимфоцитов менее 200 кл/мкл. Результаты и их обсуждение. Наличие распространенных генерализованных форм туберкулеза у больных ВИЧ-инфекцией не исключает наличие других инфекционных заболеваний, которые иногда выходят на первый план в генезе смерти. Заключение. Выявлено, что у больных на поздних стадиях ВИЧ-инфекции может выявляться сочетание множественных инфекционных заболеваний, которые иногда выходят на первый план в генезе смерти. Это указывает на необходимость проведения дополнительных методов исследования с целью выявления всей инфекционной патологии у пациента (морфологические, бактериологические, молекулярно-генетические методы).
Похожие темы научных работ по клинической медицине , автор научной работы — Михайловский Алексей Модестович, Чуркин Сергей Александрович
Pneumocystis carinii in pattients with combined coinfection (HIV/tuberculosis) according to patomorfological researches
Aim. The analysis of pathomorfological picture of combined infection: pneumonia induced by Pneumocystis carinii and progressing tuberculosis in patients with late stages of a HIV-infection . Material and methods. Pathomorfological research of 6 patients with multiple forms of tuberculosis inflammation, HIV-infection and Pneumocystis carinii pneumonia was conducted. The group of the investigated patients contained of 4 men and 2 women in an age interval from 20 to 37 years, with late stages of a HIV-infection and with level CD 4 T-lymphocytes tuberculosis and HIV-infection does not exclude presence of other infectious diseases which sometimes play an important role in death. Conclusion. Patients at late stages of a HIV-infection can often have combined infectious diseases. It is revealed that patients at late stages of a HIV-infection may have combination of multiple infectious diseases which sometimes play an important role in death. It specifies a necessity of carrying out of additional methods of research to reveal all infection pathology in patient (morphological, bacteriological and genetic methods).
in multiple sclerosis / H. Takeuchi J. Wang, J. Kawanokuchi [et al.] // Neurobiology Disease. — 2006. — Vol. 22. — P33—39.
17. Baseline MRI predicts future attacks and disability in clinically isolated syndromes / M. Tintore, A. Rovira, J. Rio [et al.] // Neurology. — 2006. — Vol. 67(6). — P968—972
18. Ziemsenn, T. A new era in multiple sclerosis: new consideration for therapeutic approaches / T. Ziemsenn, M. Tintore // Elsevier. — 2010. — 94 p.
1. Voloshina, N.P. Vozmozhnosti magnitno-rezonansnoi tomografii v diagnostike i prognoze techeniya rasseyannogo skleroza v zavisimosti ot pola i vozrasta bol'nyh [The possibility of magnetic resonance imaging in the diagnosis and prognosis of multiple sclerosis according to the sex and age of the patients] / N.P Voloshina, I.K. Gaponov // Ukrains'kii visnik psihonevrologii. — 2010. — T. 2, № 3(64). — S.19—23.
2. Flomin, Yu.V. Ispol'zovanie MRT pri rasseyannom skleroze [The use of MRI in multiple sclerosis] / Yu.V. Flomin, A.E. Kostyukovskaya, V.N. Kucyn // Neiron-revyu [Neuron-revue]. — 2008. — № 6. — S.1—12.
3. Shmidt, T.E. Rasseyannyi skleroz [Multiple Sclerosis] / T.E. Shmidt, N.N. Yahno. — M., 2012. — 271 s.
4. Cadavid, D. Clinical cosequences of MRI activity in treatyd multiple sclerosis / D. Cadavid, S. Kim, B. Peng // MS Journal. — 2011. — Vol. 17, № 1. — P.32—42.
5. Compston, A. Multiple sclerosis / A. Compston, A. Coles // Lancet. — 2008. — № 372. — P1502—1517.
6. Dobson, R. An under-studied source of biomarkers in Multiple Sclerosis / R. Dobson // MS and related disorders. — 2012. — Vol. 1. — P.76—80.
7. EFNS guidlines on the use of neuroimaging in the management of multiple sclerosis / M. Fillipi, M.A. Rocca, D.L. Arnold [et al.] // Eur. J. Neurol. — 2006. — № 16. — Р448—456.
8. Fisniku, L. Disability and T2 MRI lesins: a 20-year followup of patient with relapse onset of multiple sclerosis / L. Fisniku, M.A. Rocca, J. Comi // Brain. — 2008. — № 131. — Р808—817.
9. Inglese, M. Magnetic Resonance Imaging Monitoring of Multiple Sclerosis Lesion Evolution / M. Inglese, R.I. Grossman, M. Filippi // J. of Neuroimaging. — 2006. — Vol. 15(sup. l4). — P22—29.
10. Miller, A. Translation toards personalized medicine in Multiple Sclerosis / A. Miller, N. Aidan, N. Tzunz-Henig // J. of the Neurolog. Sciences. — 2012. — Vol. 274. — P68—75.
11. Reproducibility over a 1-month period of 1H-MR spectroscopic imaging NAA/Cr ratios in clinically stable multiple sclerosis patients / J.P. Mostert, Y. Blauw, M.W. Koch [et al.] // Eur. Radiol. — 2008. — Vol. 18(8). — P1736—1740.
12. Narayana, P.A. Magnetic Resonance Spectroscopy in the Monitoring of Multiple Sclerosis / P.A. Narayana // J. Neuroimaging. — 2005. — Vol. 15(supp. l4). — P46—57.
13. Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria / C.H. Polman, S.C. Reingold, B. Banwell [et al.] // Ann. Neurol. — 2011. — Vol. 69. — P292—302.
14. Ramagopalan, S.P. Multiple sclerosis: risk factors, prodromes and potential causal pathways / S.P Ramagopalan, R. Dobson, U.C. Meier // Lancet Neurol. — 2010. — Vol. 9. — P.727—739.
15. H-MR spectroscopy of the brain in multiple sclerosis subtypes with analysis of the metabolite concentrations in gray and white matter: initial findings / P.E. Sijens, J.P Mostert, M. Oudkerk [et al.] // Eur. Radiol. — 2006. — Vol. 16(2). — P489—495.
16. Interferon-Y induces microglial-activation-induced cell death: A hypothetical mechanism of relapse and remission in multiple sclerosis / H. Takeuchi J. Wang, J. Kawanokuchi [et al.] // Neurobiology Disease. — 2006. — Vol. 22. — P33—39.
17. Baseline MRI predicts future attacks and disability in clinically isolated syndromes / M. Tintore, A. Rovira, J. Rio [et al.] // Neurology. — 2006. — Vol. 67(6). — P968—972
18. Ziemsenn, T. A new era in multiple sclerosis: new consideration for therapeutic approaches / T. Ziemsenn, M. Tintore // Elsevier. — 2010. — 94 p.
ПНЕВМОЦИСТНАЯ ПНЕВМОНИЯ У БОЛЬНЫХ С СОЧЕТАННОЙ
патологией туберкулеза и вич-инфекцией по данным патоморфологических исследований
Реферат. Цель исследования — анализ патоморфологических проявлений сочетанной патологии — пневмонии, вызванной Pneumocystis carinii и прогрессирующего туберкулеза у больных на поздних стадиях ВИЧ-инфекции. Материал и методы. Проведено патолого-анатомическое исследование 6 пациентов с наличием генерализованных форм туберкулеза, ВИЧ-инфекции и пневмоцистной пневмонии. Группу исследованных больных составляли 4 мужчин и 2 женщины в возрастном промежутке от 20 до 37 лет, с поздними стадиями ВИЧ-инфекции (4Б, 4В стадии) с уровнем CD4 T-лимфоцитов менее 200 кл/мкл. Результаты и их обсуждение. Наличие распространенных генерализованных форм туберкулеза у больных ВИЧ-инфекцией не исключает наличие других инфекционных заболеваний, которые иногда выходят на первый план в генезе смерти. Заключение. Выявлено, что у больных на поздних стадиях ВИЧ-инфекции может выявляться сочетание множественных инфекционных заболеваний, которые иногда выходят на первый план в генезе смерти. Это указывает на необходимость про-
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
ведения дополнительных методов исследования с целью выявления всей инфекционной патологии у пациента (морфологические, бактериологические, молекулярно-генетические методы).
Ключевые слова: пневмоцистоз, пневмоцистная пневмония, туберкулез, ВИЧ-инфекция, сочетанная патология
PNEUMOCYSTiS OARINii iN PATTiENTS WITH COMBiNED COiNFECTiON (HiV/TUBERCULOSiS) ACCORDiNG TO PATOMORFOLOGiCAL RESEARCHES
Abstract. Aim. The analysis of pathomorfological picture of combined infection: pneumonia induced by Pneumocystis carinii and progressing tuberculosis in patients with late stages of a HIV-infection. Material and methods. Pathomorfological research of 6 patients with multiple forms of tuberculosis inflammation, HIV-infection and Pneumocystis carinii pneumonia was conducted. The group of the investigated patients contained of 4 men and 2 women in an age interval from 20 to 37 years, with late stages of a HIV-infection and with level CD4 T-lymphocytes Не можете найти то, что вам нужно? Попробуйте сервис подбора литературы.
В части альвеол обнаруживались типичные гиалиновые мембраны, повторяющие контуры альвеол, что указывает на развитие острого респираторного дистресс-синдрома (рис. 6).
Для проведения дифференциальной диагностики с легочным диспротеинозом, проводилась окраска гистологических препаратов легких по
Рис. 5. а — скопление трофозоидов Р.с. на поверхности А1. ТЭМ. х 34000; б — трофозоиды Р.с. в фагосомах нейтрофильных лейкоцитов. ТЭМ. х 25000
Рис. 6. Диффузное альвеолярное повреждение. Широкие эозинофильные ленты повторяют контур альвеол. Окраска гематоксилин-эозином, х 200
Граму — Вейгерту и Броуну — Хоппсу. Она дала отрицательные результаты в отношении выявления фибрина.
Заключение. Патоморфологические исследования 6 случаев сочетания пневмоцистной пневмонии и генерализованного туберкулеза показало, что при снижении CD4 Т-лимфоцитов менее 200— 150 кл/мкл у больных ВИЧ-инфекцией возможны проявления не одной, а нескольких инфекционных патологий. В приведенных случаях именно развитие недиагностированной пневмоцистной пневмонии послужило непосредственно причиной смерти пациентов в результате развития острой дыхательной недостаточности. Таким образом, наличие распространенных генерализованных форм туберкулеза у больных ВИЧ-инфекцией не исключает наличие других инфекционных заболеваний, которые иногда выходят на первый план в генезе смерти. Это указывает на необходимость проведения дополнительных методов исследования с целью выявления всей инфекционной патологии у пациента (морфологические, бактериологические, молекулярно-генетические методы и метод компьютерной томографии с высоким разрешением).
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
1. Пневмоцистная пневмония в сочетании с туберкулезом как первые клинические проявления на поздних стадиях ВИЧ-инфекции / Т.Н. Ермак, Н.Г. Литвинова,
Э.Р Самитова [и др.] // Терапевтический архив. — 2005. — № 11. — С.21—23.
2. Пневмоцистная пневмония, туберкулез легких и их сочетание у больных ВИЧ-инфекцией / Т.Н. Ермак,
Н.Г Литвинова, Э.Р. Самитова [и др.[ // Эпидемиология и инфекционные болезни. — 2008. — № 3. — С.31 —34.
3. Клеточная биология легких в норме и патологии: руководство для врачей / под ред. В.В. Ерохина, Л.К. Романовой. — М.: Медицина, 2000. — 496 с.: ил.
4. Лепеха, Л.Н. Пневмоцистоз легкого в эксперименте и клинике / Л.Н. Лепеха, Т.Г Бархина, Ю.Г. Пархоменко // Архив патологии. — 1998. — № 5. — С.46—52.
6. Михайловский, А.М. Особенности клинико-морфологических проявлений туберкулеза, сочетанного с ВИЧ-инфекцией в Оренбургской области: автореф. дис. . канд. мед. наук / Михайловский Алексей Модество-вич. — М., 2011. — 27 с.
7. Самитова, Э.Р. Случай сочетания пневмоцистной пневмонии с диссеминированным туберкулезом легких у больного ВИЧ-инфекцией / Э.Р Самитова, А.К. Токмалаев, ТН. Ермак // Вестник РУДН. — 2006. — № 1. — С.81—83.
8. Current Epidemiology of Pneumonia / A. Morris, J.D. Lundren, H. Masur [et al.] // Emerg. Infect. Dis. — 2004. — Vol. 10(10). — P1713—1720.
1. Pnevmocistnaya pnevmoniya v sochetanii s tuberkulezom kak pervye klinicheskie proyavleniya na pozdnih stadiyah VICH-infekcii [P.C. pneumonia in a combination with
tuberculosis as the first clinical displays at late stages of a HIV-infection] / T.N. Ermak, N.G. Litvinova, E.R. Samitova [i dr.] // Terapevticheskii arhiv [Therapeutic Archives]. — 2005. — № 11. — S.21—23.
2. Pnevmocistnaya pnevmoniya, tuberkulez legkih i ih sochetanie u bol'nyh VICH-infekciei [P.C. pneumonia, tuberculosis of lungs and their combination at sick of a HIV-infection] / T.N. Ermak, N.G. Litvinova, E.R. Samitova [i dr.[ // Epidemiologiya i infekcionnye bolezni. — 2008. — № 3. — S.31—34.
3. Kletochnaya biologiya legkih v norme i patologii: rukovodstvo dlya vrachei [Cellular biology of lungs in norm and a pathology] / pod red. V.V. Erohina, L.K. Romanovoi. — M.: Medicina, 2000. — 496 s.: il.
4. Lepeha, L.N. Pnevmocistoz legkogo v eksperimente i klinike [Lung pneumocystosis in experiment and clinic] / L.N. Lepeha, T.G. Barhina, Yu.G. Parhomenko // Arhiv patologii. — 1998. — № 5. — S.46—52.
6. Mihailovskii, A.M. Osobennosti kliniko-morfologicheskih proyavlenii tuberkuleza, sochetannogo s VICH-infekciei v Orenburgskoi oblasti [Features of kliniko-morphological displays of a tuberculosis, combined with a HIV-infection in the Orenburg region]: avtoref. dis. . kand. med. nauk / Mihailovskii Aleksei Modestvovich. — M., 2011. — 27 s.
7. Samitova, E.R. Sluchai sochetaniya pnevmocistnoi pnevmonii s disseminirovannym tuberkulezom legkih u bol'nogo VICH-infekciei [Combination case of P.C. pneumonia with a lung tuberculosis at sick of a HIV-infection] / E.R. Samitova, A.K. Tokmalaev, T.N. Ermak // Vestnik RUDN. — 2006. — № 1. — S.81—83.
8. Current Epidemiology of Pneumonia / A. Morris,
J.D. Lundren, H. Masur [et al.] // Emerg. Infect. Dis. — 2004. — Vol. 10(10). — P.1713—1720.
РЕТРОСПЕКТИВНЫЙ АНАЛИЗ РЕЗУЛЬТАТОВ
селективного портосистемного шунтирования у Больных с портальной гипертензией
ФЕРУЗ ГАФУРОВИЧ НАЗЫРОВ, док. мед. наук, профессор, директор Республиканского специализированного центра
хирургии им. акад. В. Вахидова, Ташкент, Узбекистан, тел. 8-371-233-49-09, e-mail: cs75@mail.ru
АНДРЕЙ ВАСИЛЬЕВИЧ ДЕВЯТОВ, докт. мед. наук, профессор, главный научный сотрудник отделения хирургии
портальной гипертензии и панкреатодуоденальной зоны Республиканского специализированного центра хирургии
им. акад. В. Вахидова, Ташкент, Узбекистан, тел. 8-371-277-06-17, e-mail: avdevyatov1777@gmail.com
АЗАМ ХАСАНОВИЧ БАБАДЖАНОВ, канд. мед. наук, старший научный сотрудник отделения хирургии портальной
гипертензии и панкреатодуоденальной зоны Республиканского специализированного центра хирургии
им. акад. В.Вахидова, Ташкент, Узбекистан, тел. 8-371-277-06-7, e-mail: azam747@mail.ru
сАлохиддин Абдуллаевич раимов, стажер-исследователь, соискатель отделения хирургии портальной
гипертензии и панкреатодуоденальной зоны Республиканского специализированного центра хирургии
им. акад. В. Вахидова, Ташкент, Узбекистан, тел. 8-371-277-06-17, e-mail: cs75@mail.ru
ренат рАВильЕВиЧ БАйБЕкОВ, младший научный сотрудник отделения хирургии портальной гипертензии
и панкреатодуоденальной зоны Республиканского специализированного центра хирургии им. акад. В. Вахидова,
Ташкент, Узбекистан, тел. 8-371-277-06-17, e-mail: renat.baybekov@gmail.com
Эльнар ильдАрОВиЧ нигМАтУллин, резидент магистратуры двухлетнего обучения Ташкентской медицинской академии, Ташкент, Узбекистан, тел. 8-371-277-06-17, e-mail:etoyaek@mail.ru
Реферат. Цель исследования — проанализировать результаты селективного портосистемного шунтирования (ПСШ) у больных с портальной гипертензией (ПГ). Материал и методы. Проведен анализ в 3 группах исследования: 1-я группа — этап внедрения, который охватил период с 1976 по 1992 г.; 2-я группа — этап формирования
ВЕСТНИК СОВРЕМЕННОЙ КЛИНИЧЕСКОЙ МЕДИЦИНЫ 2015 Том 8, вып. 2
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено: увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей; внедрением в практику пересадки донорских органов, трансплантации кос
Количество пациентов со сниженным иммунитетом постоянно растет, что обусловлено:
- увеличением диапазона применения цитостатической терапии с целью лечения злокачественных опухолей;
- внедрением в практику пересадки донорских органов, трансплантации костного мозга и других форм гематологических манипуляций, выполняемых с гематопоэтической и гематопротезирующей целью;
- эпидемией СПИДа/ВИЧ-инфекции;
- врожденными нарушениями иммунитета, а также ростом числа лиц с аутоиммунными заболеваниями;
- проводимыми многолетними курсами иммуносупрессивной терапии у пациентов с болезнями соединительной ткани;
- алкоголизмом, наркоманией и расширением контингента лиц с асоциальным типом поведения [11].
Объединяющим свойством различных популяций пациентов в данном случае является их повышенная восприимчивость к различным инфекционным агентам, что объясняется снижением пороговых значений вирулентности [1, 6]. Повреждения легочной ткани как инфекционной, так и неинфекционной природы являются едва ли не самой часто описываемой патологией среди пациентов с различными нарушениями иммунитета. При этом легочная инфекция занимает лидирующее положение среди всех инвазивных инфекций, которые диагностируются у такого рода больных [6, 9, 10].
Риск возникновения инфекций нижних дыхательных путей (ИНДП) в группе больных со сниженным иммунитетом весьма различается и зависит от ряда факторов, наиболее важными среди которых являются: нейтропения, аспирация, характер и степень выраженности изменений со стороны иммунной системы (табл. 1), а также эпидемиологическая ситуация в регионе. Одним из наиболее серьезных факторов риска возникновения ИНДП у данной категории пациентов является выраженная и продолжительная нейтропения [5, 8].
Пациент с нарушениями иммунитета, с одной стороны, постоянно находится под воздействием патогенов окружающей среды, а с другой — именно наличие дефекта иммунитета определяет тип легочной инфекции, которая у него развивается. У таких пациентов наиболее распространенными причинами развития ИНДП являются: нозокомиальная инфекция, зачастую резистентная к антибиотикам; воздействие факторов окружающей среды (воздушно-капельная инфекция и/или инфекция, передающаяся через питьевую воду); инфекции, порог вирулентности которых высок среди популяции; реактивация ранее перенесенных инфекций (например, туберкулез) [10, 12].
Каковы же основные особенности респираторных инфекционных процессов у больных со сниженным иммунитетом, знание которых помогает своевременно распознать и как можно быстрее начать проводить специфическое, адекватное терапевтическое лечение.
- При выявлении незначительных по степени интенсивности затемнений легочной ткани во время обычного рентгенологического исследования органов грудной клетки (ОГК) в данной группе пациентов должна в обязательном порядке назначаться компьютерная томография ОГК.
- В случае выявления многофокусных легочных инфильтраций инфекционной (вирусной, бактериальной или грибковой) этиологии, неинфекционной природы, а также при подозрении на метастатическое поражение легочной ткани выполнение рентгенографии ОГК в сочетании с исследованием мокроты не может являться адекватной диагностической процедурой из-за низкой результативности.
- Серологическая диагностика обычно малоинформативна у этих пациентов, в организме которых не генерируется своевременная выработка антител в ответ на инфекцию; в силу этого чаще используются методики, основу которых составляет определение антигена и/или ДНК - полимеразные цепные реакции (ПЦР).
- Выполнение в наиболее сжатые сроки компьютерного томографического исследования легких, а также постановка патоморфологического диагноза (по результатам гистологического и культурального исследований полученных образцов тканей и смывов из трахеи и бронхов) в значительной степени повышают выживаемость пациентов в данной группе.
- В легочной ткани одновременно могут протекать несколько процессов, в частности инфекционный с наличием одного или нескольких патогенов (Pneumocystis сarinii/jiroveci, цитомегаловирусная инфекция (ЦМВ) и т. д.). Нередко выявляется суперинфекция на фоне течения других процессов (например, на фоне развития острого респираторного дистресс-синдрома (ОРДС) или лекарственного поражения легочной ткани).
- Использование сокращенных схем назначаемой иммуносупрессивной химиотерапии (особенно кортикостероидами) может являться столь же значительным фактором риска развития инфекции, как и назначаемая антибактериальная терапия.
Успешность проводимой эмпирической антибактериальной терапии во многом зависит от предварительно проведенного микробиологического обследования и идентификации возбудителя. В абсолютном большинстве случаев речь идет о грибковой или смешанной бактериально-грибковой флоре. Этиологическая расшифровка ИНДП у данной категории больных представлена следующим образом [1–3, 6, 11]:
- типичные бактерии - 37%;
- грибы - 12%;
- вирусы - 15%;
- Pneumocystis carinii/jiroveci - 8%;
- Nocardia asteroides - 7%;
- Mycobacterium tuberculosis - 1%;
- микст-инфекция - 20%.
Довольно часто в популяции пациентов с нейтропенией [11, 12] возникают микст-инфекции, основу которых составляют: инфекции респираторно-сентициального вируса, либо ЦМВ, или инвазия Aspergillus spp. в сочетании с грамотрицательной флорой или P. carinii/jiroveci. Пневмоцистоз в виде моноинфекции и/или в виде микст-инфекции чаще всего описывается у пациентов, получающих системную кортикостероидную терапию (это касается как длительных курсов монотерапии кортикостероидами, так и использования их в качестве составной части режима химиотерапевтической поддержки у онкологических больных).
В современной литературе описывается увеличение количества грибковых поражений и их торпидное течение у пациентов со сниженным иммунитетом, несмотря на применение новейших противогрибковых препаратов [8, 11, 12]. В настоящее время наиболее актуальными являются три инфекционных агента, вызывающих легочные изменения: Pneumocystis carinii/jirovici, представители рода Aspergillus (особенно A. fumigatus) и Cryptococcus neoformans [12, 14].
Таксономически пневмоцисты относят к грибам. В начале нового тысячелетия тип Pneumocystis carinii, вызывающий инфекции у человека, был выделен в отдельный вид Pneumocystis jiroveci — в честь чешского ученого-паразитолога Отто Йировеца, впервые описавшего этот микроорганизм как причину заболевания у человека.
P. jiroveci, являющийся внеклеточным паразитом с преимущественным тропизмом к легочной ткани, поражает пневмоциты 1-го и 2-го порядков. Сложности при проведении дифференциальной диагностики в случае подозрения на развитие у пациента пневмоцистной пневмонии (ПП) в основном объясняются тем фактом, что стандартное обследование больных малоинформативно, до 20% из них имеют стертую клинику, а рентгенологическое обследование не выявляет патологии. Первыми признаками развивающейся ПП являются медленно нарастающая гипоксемия, одышка и кашель при скудности данных физического осмотра и рентгенологических проявлений.
С клинических позиций выделяют три стадии болезни.
- Отечная стадия, продолжительностью в среднем 7-10 дней, характеризуется медленно нарастающей одышкой, которая неуклонно прогрессирует, вплоть до выраженной одышки в покое, и сопровождается сухим непродуктивным кашлем. В легких хрипы не выслушиваются, дыхание, как правило, ослабленное. Симптомы общей интоксикации незначительны (субфебрилитет, общая слабость). Рентгенологическая картина в начале заболевания неясная, чаще всего описываемая как вариант нормы; реже выявляется прикорневое снижение пневматизации легочной ткани и усиление интерстициального рисунка.
- Для ателектатической стадии (продолжительность около 4 нед) характерна выраженная одышка в покое (до 30-50 дыхательных движений в 1 мин), пациентов беспокоит малопродуктивный кашель с выделением вязкой мокроты, нередко описывается вздутие грудной клетки. Часто отмечается фебрильная лихорадка. Аускультативная картина характеризуется жестким и/или ослабленным дыханием (локально или над всей поверхностью легких), иногда выслушиваются сухие хрипы. На более поздних этапах в клинической картине заболевания на первый план выходят симптомы дыхательной и сердечно-сосудистой недостаточности. Рентгенологи на этой стадии более чем в половине случаев выявляют билатеральные облаковидные инфильтраты (симптом "бабочки"), а также - обильные очаговые тени ("ватное" легкое).
- Последняя, эмфизематозная стадия характеризуется развитием эмфизематозных лобулярных вздутий и, возможно, разрушением альвеолярных перегородок с развитием пневмоторакса. Клинически может наблюдаться некоторое улучшение состояния больных, уменьшение одышки.
Диагностические мероприятия, направленные на выявление Pneumocystis jiroveci, начинают с получения индуцированной мокроты. Материал исследуют методом прямой микроскопии окрашенных мазков. В последнее время для более точной диагностики разработаны и применяются метод ПЦР, иммунофлюоресцентные методы с моно- и поликлональными антителами. Бронхоскопия с бронхоальвеолярным лаважем в сочетании с трансбронхиальной биопсией позволяет почти в 100% случаев обнаружить возбудителя и, следовательно, является наиболее эффективным и достоверным методом диагностики ПП. В тех случаях, когда пациенты прибегали к лечению пентамидином, эффективность диагностики с использованием бронхоальвеолярного лаважа снижалась до 60%. Окончательный диагноз пневмоцистоза ставится при обнаружении цист или трофозоидов в ткани или альвеолярной жидкости [7, 9].
В настоящее время обследование пациентов с подозрением на развитие ПП проводится по следующей схеме — всем больным с пневмонией лечение назначается эмпирически, и только при тяжелом легочном процессе проводится легочная биопсия. В отсутствие адекватного специфического лечения пневмоцистоза летальность достигает 100% у пациентов с иммунодефицитами и 50% — у недоношенных детей. Прогноз остается неблагоприятным (зависит от фонового состояния), и без коррекции иммунного статуса у 15% пациентов возникают рецидивы ПП [4, 8].
У пациентов, не получающих триметоприм-сульфаметоксазол (или иные антибактериальные препараты, назначаемые в режиме химиопрофилактики при высоком риске развития пневмоцистоза (табл. 2), сохраняется высокая вероятность возникновения пневмоцистоза на фоне развития ЦМВ-инфекции, что, возможно, связано с блокировкой альвеолярных макрофагов и снижением функции CD4-лимфоцитов.
Относительно частоты выявления пневмоцистоза в группе пациентов с иммунодефицитными состояниями (в которую не вошли пациенты с ВИЧ-инфекцией), следует отметить, что при отсутствии своевременно проводимых профилактических мероприятий примерно у 5–12% пациентов развивается развернутая клиника пневмоцистоза [13]. Применение активной антиретровирусной терапии существенно снижает риск развития ПП при СПИДе. В случае снижения уровня CD4 Рисунок 1. Обзорная рентгенография органов грудной клетки от 11.11.04.
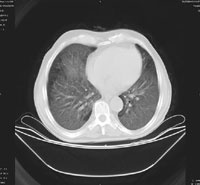
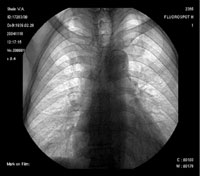
На момент госпитализации: состояние средней степени тяжести, обусловленное дыхательной недостаточностью. При осмотре кожных покровов видны сухие следы расчесов, акроцианоз. В подмышечных, паховых областях с обеих сторон пальпируются единичные, мягко-эластичной консистенции безболезненные лимфатические узлы. В легких при аускультации выслушивается жесткое дыхание, хрипов нет. Частота дыхания — 23–24 в минуту, пульс — 87 в минуту, артериальное давление — 140/80 мм рт. ст. Со стороны пищеварительной, мочеполовой, нервной систем патологии не выявлено. Больному была назначена антибактериальная терапия, включающая ципрофлоксацин, рифампицин. Помимо антибиотиков пациент получал муколитики, фестал, альмагель, бисакодил. На фоне проводимого лечения сохранялись гектические подъемы температуры, нарастала дыхательная недостаточность. С учетом затяжного течения пневмонии больной повторно был осмотрен фтизиатром, данных, подтверждающих туберкулез, снова не было выявлено. В ходе обследования методом иммуноферментного анализа и иммунного блотинга были выявлены антитела к ВИЧ, что заставило пересмотреть диагностический алгоритм и предположить развитие у больного ПП либо поражения легких в рамках ЦМВ-инфекции; окончательно не был исключен из диагностического ряда и вариант развития туберкулезного процесса в легких. Ввиду вышесказанного к проводимой терапии был добавлен бисептол в адекватных дозах. При иммунологическом исследовании выявлено абсолютное снижение CD4 до 19,3/ мкл. Все вышеперечисленное позволило диагностировать у больного ВИЧ-инфекцию в стадии 3Б (СПИД-ассоциированный комплекс), двустороннюю субтотальную пневмонию. При проведении (11.11.04) повторного рентгенологического исследования ОГК (рис. 1) отмечалась отрицательная динамика в виде нарастания объема и интенсивности инфильтрации легочной ткани. При ультразвуковом исследовании органов брюшной полости обнаружены диффузные изменения печени, поджелудочной железы, селезенки, увеличение лимфоузлов подмышечных, паховых областей. При контрольной компьютерной томографии ОГК отмечалась отрицательная динамика в виде прогрессирования диффузных изменений в обоих легких (рис. 2, 3). На фоне лечения у больного нарастала дыхательная недостаточность, сохранялись гектические подъемы температуры, развился ОРДС, в связи с чем пациент был переведен в отделение реанимации и интенсивной терапии, где осуществлялись респираторная поддержка, проводились антибактериальная, дезинтоксикационная терапия, противоязвенное и антитромботическое лечение, симптоматическая терапия. Однако, несмотря на все перечисленные мероприятия, 23.11.04 г. наступила остановка сердечной деятельности по типу асистолии.
 |
| Рисунок 4. Гиалиновые мембраны на стенках альвеол (окраска гематоксилином и эозином). Микрофотография |
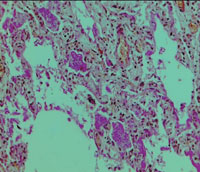 |
| Рисунок 5. Скопления Pneumocystis jiroveci в просветах альвеол (окраска PAS-методом). Микрофотография |
Согласно материалам аутопсии у больного было подтверждено наличие двухсторонней полисегментарной ПП, ОРДС: полнокровие капилляров альвеолоцитов и наличие гиалиновых мембран на стенках альвеол (рис. 4, 5).
- Collin B. A., Ramphal R. Pneumonia in the compromised host including cancer patients and transplant patients//Infect. Dis. Clin. North. Am. 1998; 12: 781.
- Junghanss C., Marr K. A. Infectious risks and outcomes after stem cell transplantation: are nonmyeloablative transplants changing the picture?//Curr. Opin. Infect. Dis. 2002; 15: 347.
- Bodey G., Rodriguez V., Chang H. et al. Fever and infection in leukemic patients: A study of 494 consecutive patients. Cancer. 1978; 41: 1610.
- Coker D. D., Morris D. M., Coleman J. J. et al. Infection among 210 patients with surgically staged Hodgkin's disease//Am. J. Med. 1983; 75: 97.
- Sickles E. A., Greene W. H., Wiernik P. H. Clinical presentation of infection in granulocytopenic patients//Arch. Intern. Med. 1975; 135: 715.
- Rubin R. H., Greene R. Clinical approach to the compromised host with fever and pulmonary infiltrates//In: Clinical Approach to Infection in the Compromised Host, 3rd edition, Rubin R. H., Young L. S. (Eds), Plenum Press, New York. 1994; 121.
- LiPuma J. J., Spilker T., Coenye T., Gonzalez C. F. An epidemic Burkholderia cepacia complex strain identified in soil//Lancet. 2002; 359: 2002.
- Escalante C. P., Rubenstein E. B., Rolston K. V. Outpatient antibiotics therapy for febrile episodes in low-risk neutropenic patients with cancer//Cancer Invest. 1997; 15: 237.
- Talcott J. A., Whalen A., Clark J. et al. Home antibiotic therapy for low-risk cancer patients with fever and neutropenia: A pilot study of 30 patients based on a validated prediction rule//J. Clin. Oncol. 1994; 12: 107.
- Rosenow E. C., Wilson W. R., Cockerill F. R. Pulmonary disease in the immunocompromised host//Mayo. Clin. Proc. 1985; 60: 473.
- Junghanss C., Marr K. A., Carter R. A. et al. Incidence and outcome of bacterial and fungal infections following nonmyeloablative compared with myeloablative allogeneic hematopoietic stem cell transplantation: a matched control study//Biol. Blood. Marrow. Transplant. 2002; 8: 512.
- Ascioglu S., Rex J. H., de Pauw B. et al. Defining opportunistic invasive fungal infections in immunocompromised patients with cancer and hematopoietic stem cell transplants: an international consensus//Clin. Infect. Dis. 2002; 34: 7.
- Fishman J. A. Prevention of infection due to Pneumocystis carinii//Antimicrob. Agents. Chemother. 1998; 42: 995.
- Fishman J. A. Treatment of infection due to Pneumocystis carinii//Antimicrob Agents. Chemother. 1998; 42: 1309.
- Furrer H., Egger M., Opravil M. et al. Discontinuation of primary prophylaxis against Pneumocystis carinii pneumonia in HIV-1-infected adults treated with combination antiretroviral therapy. Swiss HIV Cohort Study//N. Engl. J. Med. 1999; 340: 1301.
А. Ф. Шепеленко, доктор медицинских наук, доцент
М. Б. Миронов, кандидат медицинских наук
А. А. Попов
Главный военный клинический госпиталь им. Н. Н. Бурденко,
ММА им. И. М. Сеченова, ГИУВ МО РФ, Москва
Читайте также:


