Диссеминированный процесс в легких при вич
Володина С.В., Тяжельникова З.М., Анциферова Л.И., Волкова Т.А.
Трудности рентгенологической верификации пневмоцистной пневмонии и туберкулёза у больных с поздней стадией ВИЧ-инфекции.
г. Красноярск, Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого , кафедра лучевой диагностики ИПО,
Возбудители пневмоцистоза широко распространены в окружающей среде, и большинство из нас носит их в легких без негативных последствий. Но при нарушении иммунной системы под действием ВИЧ эти простейшие организмы, считающиеся условно-патогенными, становятся смертельно опасными. P. с arinii заражено около 80% больных СПИДом . Пневмоцистная пневмония - это самая распространенная оппортунистическая инфекция дыхательных путей у ВИЧ - инфицированных. В числе ведущих вторичных поражений у больных ВИЧ-инфекцией фигурирует и туберкулёз, который в последние годы становится едва ли не основной причиной госпитализации и смерти больных ВИЧ-инфекцией, он уносит жизнь более 60% больных на её поздних стадиях. Всё чаще регистрируется сочетание нескольких вторичных поражений, в т.ч. пневмоцистная пневмония и туберкулёз, что затрудняет своевременную диагностику и лечение. Летальные исходы у таких больных связаны, прежде всего, с поздней дифференциальной диагностикой.
Цель нашего исследования состояла в анализе рентгенологических проявлений диссеминированного туберкулеза и пневмоцистной пневмонии на фоне ВИЧ-инфекции.
Материалы и методы:
Наши исследования основаны на анализе 43 историй болезни пациентов, имеющих различные формы специфического туберкулеза легких на фоне ВИЧ-инфекции.
Как пример сложности дифференциальной рентгенологической диагностики пневмоцистной пневмонии и туберкулёза у больной с тяжелым иммунодефицитом, обусловленным ВИЧ - инфекцией, представляем историю болезни пациентки Б., лечившейся и обследовавшейся последовательно в Городской больнице №1, инфекционном и противотуберкулёзном отделениях Городской больницы №2 г. Норильска.
Поступила в экстренном порядке в пульмонологическое отделение Городской больницы №1 с жалобами на одышку при минимальной бытовой нагрузке, слабость, непродуктивный кашель, лихорадку до 39 0 с ознобом, потерю веса до 8 кг за последние 3 недели. До поступления в стационар лечилась амбулаторно с диагнозом ОРВИ, при нарастании симптомов заболевания госпитализирована .
На рентгенограммах (прямая и боковые проекции) при поступлении: с обеих сторон по всем лёгочным полям, преимущественно в средних и нижних отделах лёгких, отмечено усиление и обогащение лёгочного рисунка за счёт интерстициального компонента, перивазальная , перибронхиальная нечёткость корней и рисунка в прикорневых отделах. С обеих сторон в S 8 – S 9 определяется очаговая инфильтрация лёгочной ткани с реакцией прилежащей плевры. Синусы свободны. Сердце и аорта без особенностей. Заключение: двухсторонняя полисегментарная пневмония, интерстициальная при системном заболевании. Дифференциальный диагноз с лимфогенным карциноматозом , туберкулёзом.
При томографическом дообследовании ср. 7,5-8: с обеих сторон, преимущественно в средних и нижних отделах и субплеврально , больше слева, на фоне интерстициального компонента определяются множественные очаговые тени, сливающиеся в фокусы без чётких контуров, распада не выявлено, бронхи 1-2 порядка проходимы. Увеличены размеры паратрахеальных и трахеобронхиальных ВГ лимфоузлов , больше справа. Закл .: Двухсторонняя полисегментарная грибковая пневмония на фоне ВИЧ-инфекции, не исключается пневмоцистная пневмония.
За период наблюдения дважды консультирована фтизиатром, данных за активный туберкулёз не выявлено.
В результате проведённого лечения клинико-рентгенологические показатели практически не улучшились, больная переведена в инфекционное отделение Городской больницы №2 с диагнозом: Внебольничная двухсторонняя полисегментарная пневмония грибковой этиологии, пневмоцистная ?, тяжёлое течение, ДН- II , туб-настороженность , Фон - ВИЧ-инфекция.
На рентгенограмме: динамика отрицательная прогрессирования интерстициального компонента, на фоне обеднения лёгочного рисунка по всем лёгочным полям определяются сливные очаговые тени, не исключается появление в вернем лёгочном поле слева фокуса с распадом. Корни малоструктурны за счёт увеличения размеров внутригрудных лимфоузлов . Дифференциальный диагноз ВИЧ-ассоциированного диссеминированного туберкулёза лёгких и пневмоцистной пневмонии. Консультация фтизиатра: Диссеминированный туберкулез легких в фазе инфильтрации и распада.
Переведена в ПТО с отрицательной динамикой для дальнейшего обследования и лечения. Дважды исследована мокрота на МБТ бактериоскопическим методом – отр . В стационаре противотуберкулезного отделения состояние пациентки резко ухудшилось и зафиксирован летальный исход.
Патологоанатомический диагноз: Основное заболевание: ВИЧ-инфекция, категория В (СПИД): СД4 4кл.(1%); двусторонняя полисегментарная субтотальная пневмония (ЦМВ + пневмоцистная ); ЦМВ - э пинефрит . Делимфотизация лимфатических узлов, селезенки, миндалин. Гранулематозный лимфаденит бифуркационных лимфатических узлов. ВИЧ - кахексия.
1. На поздних стадиях ВИЧ-инфекции рентгенологическая картина туберкулёза теряет типичные черты, а именно локализация патологических элементов меняется на средние и нижние отделы лёгких , в структуре туберкулеза в этот период исчезают формы с преимущественными продуктивными процессами. Туберкулезный процесс в легких становится более распространенным, преобладают диссеминация и поражение внутригрудных лимфатических узлов, что напоминает R -картину пневмоцистной пневмонии.
2. Дифференциальный диагноз затрудняет сходство клинических проявлений туберкулёза и оппортунистических пневмоний на данном этапе ВИЧ-инфекции.
3. Необходимо использовать КТ и МСКТ органов грудной полости как наиболее достоверные с высокой разрешающей способностью, т.к. обычная рентгенография и томография малоинформативны и неспецифичны.
4. Целесообразно внедрять в практику специфические методики определения возбудителей оппортунистических инфекций.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
ЦНИИ туберкулеза РАМН
Д иссеминированные заболевания легких (ДЗЛ) – гетерогенная группа болезней, объединенная рентгенологическим синдромом двусторонней диссеминации. Сегодня можно назвать около 200 заболеваний, подходящих под рубрику ДЗЛ. Каково же место ДЗЛ среди всех болезней легких?
| Диссеминированные заболевания легких - гетерогенная группа болезней, объединенная рентгенологическим синдромом двусторонней диссеминации. |
Терминология и классификация
Главная общая черта этих болезней – альвеолит, причем в большинстве случаев иммунной природы. Основные отличительные признаки – степень и уровень вовлечения в патологический процесс основных структур легкого, а также выраженность и характер прогрессирования дыхательной недостаточности. Так, при саркоидозе, экзогенном аллергическом альвеолите (ЭАА), альвеолярном протеинозе поражаются в первую очередь строма легкого и дольковые структуры. При туберкулезе легких и пневмокониозах – дольковые структуры; при идиопатическом фиброзирующем альвеолите и ревматических болезнях – внутридольковые структуры.
Все ДЗЛ по этиологическому признаку можно разделить на заболевания с известной этиологией, неустановленной природы и вторичные (при системных заболеваниях).
Наиболее распространенные ДЗЛ известной этиологии:
• Диссеминированный туберкулез легких
• ДЗЛ при ВИЧ–инфицировании
• Экзогенные аллергические альвеолиты
Среди инфекционных ДЗЛ первое место по значимости принадлежит туберкулезу. Не всегда легко отличить его от других форм ДЗЛ, особенно у пожилых ослабленных больных. Легочные микозы чаще всего бывают вторичными, и их появлению обычно предшествует формирование иммунодефицита. В диагностике паразитарного поражения легких важное значение имеет тщательно собранный эпидемиологический анамнез. Для респираторного дистресс–синдрома характерно наличие септицемии, тяжелой травмы или интоксикации. Для больных СПИД характерен распространенный инфекционный процесс, вызываемый атипичными микроорганизмами – пневмоцистами, легионеллами, микобактериями, и пр.
В диагностике неинфекционных ДЗЛ важен профанамнез, знание факторов экологической агрессии, а также сведения об употреблении лекарств (амиодарон, нитрофураны, метотрексат, циклофосфамид, блеомицин, препараты золота нередко являются причиной ДЗЛ). В неосложненных случаях диагностика заболеваний этой группы не представляет больших затруднений.
Около половины всех ДЗЛ относятся к категории заболеваний с неустановленной этиологией. Наиболее распространенные ДЗЛ неустановленной природы:
• идиопатический фиброзирующий альвеолит
• идиопатический легочный гемосидероз
• некротизирующие васкулиты: гранулематоз Вегенера, синдром Churg–Strauss
Каждое из этих заболеваний имеет свои наиболее характерные клинические признаки, позволяющие приблизиться к диагнозу. Так, ИФА обычно начинается с тяжелой прогрессирующей одышки, приносящей максимальные неудобства больному. При саркоидозе диагностика легочного поражения нередко является случайной находкой при рентгенологическом исследовании грудной клетки. У больных гистиоцитозом X умеренная одышка сочетается с рецидивирующими пневмотораксами. Альвеолярный протеиноз характеризуется накоплением в альвеолах белковолипидного вещества, что и определяет клиническую картину. Для легочного гемосидероза характерно кровохарканье. У больных некротизирующими васкулитами кровохаркание обычно сочетается с лихорадкой и присоединением вторичной инфекции. Для синдрома Гудпасчера основными признаками являются кровохарканье в сочетании с признаками гломерулонефрита.
Благодаря морфофункциональным особенностям легких, патологические состояния практически любой локализации находят свое отражение в респираторной системе, выраженность и обратимость которого зависит от особенностей основного патологического процесса. Ниже приведены заболевания, при которых нередко развивается ДЗЛ, с прогрессированием и формированием диффузного легочного фиброза с дыхательной недостаточностью и другими признаками ДЗЛ.
Системные заболевания, при которых возникают ДЗЛ:
• Ревматические болезни – ревматоидный полиартрит, системная красная волчанка, дерматомиозит, синдром Шегрена
• Болезни печени – хронический активный гепатит, первичный билиарный цирроз
• Болезни крови – аутоиммунная гемолитическая анемия, идиопатическая тромбоцитопеническая пурпура, хронический лимфолейкоз, эссенциальная криоглобулинемия
• Болезни кишечника – болезнь Уиппла, язвенный колит, болезнь Крона, болезнь Вебера–Кристиана.
• Хронические болезни сердца – с левожелудочковой недостаточностью, с шунтированием слева направо
• Хроническая почечная недостаточность
Дифференциальная диагностика ДЗЛ
Итак, основными компонентами дифференциальной диагностики ДЗЛ являются изучение анамнеза, оценка клинической симптоматики, рентгенологическое, функциональное и лабораторное исследование и, наконец, биопсийное исследование. Каждый из этих основных компонентов вносит свой вклад в диагностический процесс, при этом не следует игнорировать или гипертрофировать значимость каждого из них.
Ниже приведен перечень основных вопросов, изучение которых имеет диагностическое значение:
• Факторы экологической агрессии
• Употребление лекарств в связи с сопутствующими болезнями
• Оценка последовательности, скорости появления и развития симптомов
• Установление времени начала болезни – архивные рентгенограммы
• Ответ на начальную терапию ДЗЛ.
Изучение влияния факторов экологической агрессии позволяет облегчить диагностику пневмокониозов, экзогенных аллергических альвеолитов и радиационных поражений легких. Особое внимание следует уделять фактору курения. Более 90% больных гистиоцитозом Х (Лангергансо–клеточным гистиоцитозом) – курильщики. С другой стороны, курение, как главный этиологический фактор хронического обструктивного бронхита, может изменять классическую симптоматику ДЗЛ при сочетании двух болезней.
Оценка последовательности, скорости появления и развития признаков заболевания может иметь решающее значение в диагностике. Так, первым признаком ИФА чаще всего является быстро нарастающая одышка без признаков обструкции. У больных саркоидозом – напротив, одышка развивается в поздних стадиях болезни. У больных экзогенным альвеолитом одышка носит смешанный характер (сочетание обструкции с рестрикцией) и нередко зависит от контакта с этиологическим фактором (легкое фермера, птицевода и пр.). Важным в диагностике является анализ архивных рентгенограмм, позволяющий объективно установить истинное начало заболевания и определить характер его прогрессирования, а также проведение клинико–рентгенологических параллелей.
Поскольку подавляющее большинство больных еще до верификации диагноза подвергаются медикаментозной терапии, важным является оценка ответа на антибактериальные средства и кортикостероиды. Очень демонстративным в этом отношении является экзогенный аллергический альвеолит, особенно его пневмоническая форма. Назначение таким больным антибиотиков обычно не дает выраженного лечебного эффекта, а некоторое смягчение симптоматики, связанное с прекращением контакта с бытовыми или профессиональными аллергенами в связи с госпитализацией, расценивается врачом, как недостаточная эффективность антибиотиков. Происходит наращивание интенсивности антибактериальной терапии, что непременно должно усугубить состояние больного. Подобные ситуации наблюдаются и при ошибочном назначении глюкокортикостероидов в виде монотерапии больным диссеминированным туберкулезом, который был принят за саркоидоз легких. Напротив, эффективность глюкокортикоидов обычно предполагает иммунопатологический патогенез заболевания.
Набор основных клинических симптомов ДЗЛ весьма ограничен: одышка, кашель, кровохаркание, поражение плевры и внелегочные симптомы. В связи с этим диагностическое значение имеют не только наличие или отсутствие признака, но и его выраженность, изменчивость, а также сочетание с другими, в том числе и внелегочными симптомами.
Одышка – главный симптом ДЗЛ. При ИФА появляется рано (нередко еще до возникновения рентгенологических признаков болезни), носит инспираторный характер и неуклонно прогрессирует. У больных саркоидозом одышка – поздний признак. Нередко у больных саркоидозом наблюдается несоответствие выраженности рентгенологической диссеминации полному отсутствию одышки. У больных ЭАА одышка обычно носит смешанный характер, возникает в связи с причинным фактором (аллергеном) и протекает волнообразно.
Кашель наблюдается при многих ДЗЛ. Однако изолированное поражение альвеол не сопровождается кашлем из–за отсутствия в них соответствующих нервных окончаний, и поэтому кашель в большинстве случаев является признаком раздражения воздухоносных путей. При ЭАА и саркоидозе кашель – проявление бронхоцентрического процесса. При ИФА кашель – поздний признак, он может быть результатом инфицирования (бактерии, грибы, вирусы), либо формирования тракционных бронхоэктазов.
Кровохарканье – признак деструкции легочной ткани. Наиболее характерно кровохарканье для туберкулеза легких, гранулематоза Вегенера, синдрома Гудпасчера, легочного гемосидероза, фиброзирующих альвеолитов при ревматических болезнях. При ИФА – поздний признак, проявляющийся в 13% случаев.
Плевральный выпот наиболее часто наблюдается при ревматических болезнях, лекарственном поражении легких, асбестозе, лейомиоматозе. Пневмоторакс характерен для гистиоцитоза X и лейомиоматоза.
Обзорная рентгенограмма – основная методика при подозрении на заболевание органов дыхания – дает до 50% ошибок при ДЗЛ. Компьютерная томография (КТ) высокого разрешения – главная рентгенологическая методика при ДЗЛ, которая позволяет оценить не только распространенность процесса, но и проследить за его динамикой. В зависимости от диагностических возможностей КТ все ДЗЛ делятся на 3 категории (табл. 1). Приведенные данные характеризуют разрешающие возможности КТ и подчеркивают значимость интегрального подхода в диагностике ДЗЛ с привлечением клинических, морфологических и других данных.
Функциональное исследование легких вносит свой вклад в диагностический процесс в основном путем оценки стадии болезни и характера ее прогрессирования.
Функциональное исследование легких вносит свой вклад в диагностический процесс в основном путем оценки стадии болезни и характера ее прогрессирования.
Основные функциональные признаки ДЗЛ:
• Уменьшение статических легочных объемов
• Снижение растяжимости легких
• Увеличение частоты дыхания
• Нарушение вентиляционно–перфузионных отношений
• Снижение диффузионной способности легких
• Гипоксемия, нарастающая при физической нагрузке.
Иммунологические методы диагностики ДЗЛ способствуют установлению этиологии при определении циркулирующих антигенов или антител к ним, позволяют качественно и количественно характеризовать иммунодефицит. Наконец, они полезны для выявления активности иммунопатологического процесса путем определения маркеров активации на иммунокомпетентных клетках, а также для определения циркулирующих иммуноглобулинов и иммунных комплексов.
Микробиологические методы способствуют установлению этиологического диагноза инфекционных ДЗЛ путем культуральных исследований и в полимеразно–цепной реакции. Помимо этого возможна оценка микробной колонизации респираторной системы и определение характера вторичной флоры в стадии сотового легкого.
Бронхологические методы позволяют провести осмотр бронхиального дерева, произвести лаваж с подсчетом клеточных элементов, а также различные виды биопсий, в том числе и трансбронхиальную биопсию легких. Исследование клеточного состава бронхоальвеолярного содержимого дает возможность оценить активность альвеолита при относительно свежем патологическом процессе без грубых фиброзных изменений, искажающих результаты исследования. То же относится к трансбронхиальной биопсии, которая наиболее информативна при отсутствии выраженного фиброза.
Исследования биопсийного материала
Ранняя и точная диагностика большинства ДЗЛ невозможна без исследования биопсийного материала. Из 4 наиболее распространенных методов получения биопсийного материала (трансбронхиальная биопсия, трансторакальная, видеоторакоскопическая и открытая биопсия легкого) выбор метода биопсии должен быть мультидисциплинарным: с участием пульмонолога, рентгенолога, патолога и торакального хирурга для того, чтобы при минимальной травматизации больного получить максимальную информацию о процессе в легких. На этом этапе диагностики возникает много вопросов деонтологического характера, касающихся оправданности применения инвазивного метода исследования. В этом случае всегда надо сравнивать размер ущерба, наносимого больному методом исследования, и ущерба, вследствие неточности диагностики и ошибок в лечении.
Показаниями к инвазивным методам исследования являются:
• невозможность установления диагноза без инвазивных методов,
• необходимость выбора терапии,
• отсутствие признаков сотового легкого – конечной фазы большинства ДЗЛ.
Так, в США диагностическим стандартом для больных ДЗЛ является клиновидная резекция легких. Выбор оптимальных размеров биоптатов и числа долей легких, подлежащих биопсии, проводится при участии пульмонолога, рентгенолога, патолога и хирурга.
Таким образом, дифференциальная диагностика ДЗЛ является ответственным этапом работы пульмонолога, от эффективности которой зависит жизнь больного.
При проведении диагностики ДЗЛ целесообразно придерживаться следующих принципов:
- Ранняя диагностика повышает эффективность лечения и предохраняет от большого числа ятрогенных болезней.
- Диагностика ДЗЛ должна проводиться до получения доказательства принадлежности болезни к определенной нозологической форме.
- Диагностика ДЗЛ должна проводиться в специализированных центрах, располагающих соответствующими техническими возможностями.
- Мультидисциплинарный подход к верификации диагноза ДЗЛ с участием пульмонолога, рентгенолога, патолога, торакального хирурга – оптимальный способ повысить эффективность инвазивных методов диагностики.
Диагностический алгоритм при работе с больными ДЗЛ должен состоять из 3 обязательных компонентов:
1. Тщательное исследование анамнеза и клинической симптоматики заболевания.
2. Проведение КТ.
3. Исследование биопсийного материала.
Все остальные методы исследования вносят свой определенный вклад в диагностический процесс и должны использоваться в качестве дополнительных для более детальной, индивидуальной характеристики каждого больного.
Литература:
Рекомендуемая литература
1. М.М. Илькович. Интерстициальные болезни легких. В кн. Заболевания органов дыхания. С.–Петербург,1998, с.109–318.
2. Interstitial lung diseases. Ed. D.Oliveri, R.M.du Bois. Eur.Resp.Monograph., vol.5, Mon.14, august 2000.
3. Idiopathic pulmonary fibrosis: diagnosis and treatment. International Consensus Statement.// Am J Respir Crit Care Med, 2000; 161: 646–64.
Проблема ВИЧ-инфекции более 25 лет остается актуальной для мирового сообщества, масштабы распространения иммунодефицита человека приобрели глобальный характер и стали реальной угрозой для социально-экономического развития большинства стран мира. Всемирная организация здравоохранения указывает, что в мире более 34 млн человек страдают этой инфекцией и уже более 2,5 млн умерло от ВИЧ-ассоциированных заболеваний [7]. В России в настоящее время эпидемическая ситуация по ВИЧ-инфекции остается напряженной – продолжается распространение данной инфекции среди населения России: 463 случая на 100 тыс. населения; получается, что один из 216 жителей является носителем вируса иммунодефицита [5]. На начало января 2016 г. в Алтайском крае зарегистрировано 22 349 случаев ВИЧ-инфекции. Проживает на территории края – 17 480 чел., пораженность на 100 тыс. населения – 728,7, что на 17% ниже, чем в Сибирском федеральном округе (828,4 на 100 тыс. населения). По уровню пораженности ВИЧ-инфекцией, из 12 территорий СФО, Алтайский край занимает 4-е рейтинговое место [1].
При этом растет и количество смертей от ВИЧ-инфекции и ассоциированных с ней заболеваний [9]. ВИЧ-инфекция на стадии вторичных заболеваний 4 (А, Б, В) резко увеличивает риск развития туберкулезного процесса. Активный туберкулез может развиться на любой из стадий ВИЧ-инфекции и имеет множество клинико-рентгенологических, морфологических особенностей, которые зависят от выраженности иммунодефицита. Значительная распространенность ВИЧ-инфекции в сочетании с туберкулезом, частота развития и тяжесть осложнений при двойной инфекции определили ее как социально значимое заболевание, приводящее к инвалидизации, снижению качества жизни и высокой смертности, что требует мультифакторного анализа и подхода в контексте этой проблемы. Остаются мало изученными причины смерти и особенности морфологических изменений в органах при туберкулезе на фоне ВИЧ-инфекции с учетом медико-социальных параметров [7].
Одной из основной причиной смерти ВИЧ-инфицированных лиц остается туберкулез, осложняющий течение ВИЧ-инфекции [7; 9], диагностика которого при таком сочетании до сих пор остается затрудненной [2; 6]. ВИЧ-инфекция на стадии вторичных заболеваний в IV стадию (А, Б, В) значительно увеличивает количество форм активного туберкулеза у таких пациентов. По данным российских и зарубежных авторов, доля больных туберкулезом среди ВИЧ-инфицированных достигает 75% [7; 10].
Следует отметить, что наряду с количественными изменениями в структуре аутопсий умерших от туберкулеза произошли и качественные изменения. Стали преобладать генерализованные формы заболевания с нетипичной микроскопической картиной и преимущественно альтеративным характером воспаления в туберкулезных очагах, отсутствием эпителиоидных и гигантских клеток, сомнительными, а зачастую отрицательными результатами окрашивания по Циль-Нильсену при выявлении кислотоустойчивых бактерий на срезах. Появление и доминирование данных атипичных форм туберкулеза связывают с увеличением числа больных с иммунодефицитными состояниями на фоне наркомании и ВИЧ-инфекции, которые сопровождаются резким снижением уровня СD4+-лимфоцитов, играющих важную роль в механизме противотуберкулезной защиты [8].
Все это позволяет нам вынести туберкулез, ассоциированный с ВИЧ-инфекцией, в группу довольно значимых социальных заболеваний, которые, несмотря на довольно обширное освещение в научных трудах как в отечественной, так и в зарубежной литературе, требуют более комплексного анализа и подхода для правильного понимания истинных причин смертности в данной группе пациентов.
Цель исследования – изучить особенности морфологической картины ВИЧ-ассоциированного туберкулеза у пациентов, не получающих противовирусную терапию, с определением основных причин смерти у данной категории лиц.
Материалы и методы исследования. Было изучено 20 случаев протоколов вскрытия ВИЧ-инфицированных с клиникой туберкулеза, по той или иной причине не получающих противовирусную терапию (в большинстве случае отказ самих больных), и 20 больных с туберкулезом без ВИЧ-инфекции. Критериями включения в исследование были: ВИЧ-инфекция с положительным иммуноблотом и подтвержденный туберкулез методами морфологического и гистологического исследования. В I группу вошли больные ВИЧ-ассоциированные с туберкулезом, среди которых мужчины составили 12 (60%) человек, а женщины 8 (40%) человек. Средний возраст среди мужчин – 32±5 лет, среди женщин 36±4 года. Все умершие были жители города. Среди них 15 (0,75%) умерших последние несколько месяцев не употребляли наркотики, оставшиеся утверждали, что не принимали наркотики в течение 1-2 лет. В группу II вошли больные с туберкулезом без ВИЧ-инфекции (ограниченные формы). Средний возраст в этой группе составил 51±6 лет, мужчин было 11 (55%) человек, женщин – 9 (45%).
При анализе клинико-морфологических особенностей в исследовании учитывали возраст, пол умерших и количество клеток CD4+/мкл. При этом все умершие имели IV Б – IV В и V стадию ВИЧ-инфекции, согласно классификации, утвержденной Приказом МЗ СР РФ № 166 от 17 марта 2006 года, с количеством клеток CD4+ 100-200/мкл и менее 100 клеток/мкл. У всех умерших в анамнезе имелся факт употребления инъекционных наркотических средств.
При изучении микроскопической картины стеклопрепаратов, окрашенных гематоксилином и эозином и методом по Циль-Нильсену, для морфометрического анализа применяли программу UTHSCSA Image Tool 3.0 (разработанную в University of the Texas Health Science Center of San Antonio, Tеxas, USA, 2007 и свободно доступную в Интернете). С каждого случая делали по 10 снимков. Определяли площадь казеозного некроза в туберкулезных очагах, а также толщину лимфоцитарно-макрофагального вала клеток.
Результаты исследования и их обсуждение.
В I группе встречался генерализованный туберкулез с поражением головного мозга, лимфатических узлов, легких, почек, селезенки, печени, а также диссеминированные и милиарные формы туберкулеза, казеозная пневмония 1 (5%). В патологический процесс при туберкулезе были вовлечены следующие органы: двусторонние поражения легких – 20 (100%), печень – 9 (45%), селезенка – 12 (60%), мозг – 7 (35%), позвоночник – 2 (10%), миокард – 7 (35%). Генерализованные формы туберкулеза сопровождались выраженной интоксикацией, что нашло отражение в увеличении печени и селезенки. Масса печени была зафиксирована в пределах средних цифр – 3200±140 г, желтого цвета с поверхности с субкапсулярными бугорками серо-белого цвета по 2 мм. На разрезе гладкая, имеет сальный блеск, при микроскопировании отмечена диффузная крупнокапельная жировая дистрофия гепатоцитов. Масса селезенки достигала 720 г, среднее значение составило – 520±50 г, дрябловатой консистенции, капсула слабой напряженности. Субкапсулярно и на разрезе определяются мелкие очаги (бугорки) белесого цвета по 1-2 мм, в 5 (10%) случаях отмечено их слияние до 1 см. При гистологическом исследовании отмечена атрофия лимфоидных фолликулов, гемосидероз, утолщение и склероз синусов.
Во II группе у 11 (55%) человек были выявлены милиарные и диссеминированные формы туберкулеза, у 9 (45%) человек процесс был локализован только в легких с одной стороны, не затрагивая другие органы. Селезенка в процесс не вовлекалась, а печень в 12 (60%) случаях была увеличена – 2500±85 г. Морфологическая картина туберкулеза во II группе была классической, с типичными формами течения туберкулезной инфекции. В туберкулезных очагах выявлены типичное продуктивное воспаление и типичные клеточные реакции. Площадь казеозного некроза в определяемых туберкулезных очагах составила 210,4±12,2 мкм2, толщина вала клеточной популяции на периферии казеозного некроза составила 67,1±11,2 мкм, среди клеток определялись в большом количестве эпителиоидные клетки и классические клетки Пирогова-Лангханса.
В морфологической картине I группы преобладали распространенные формы туберкулеза легких, миллиарные и диссеминированные формы, с поражением других внутренних органов. Отмечены обширные очаги казеозного некроза, не отграниченные коллагеном, размером до 1 см, со снижением количества эпителиодных клеток и клеток Пирогова-Лангханса, экссудативными компонентом, диссеминацией процесса и генерализованными формами. Площадь казеозного некроза широко варьировала от 257 до 410 мкм2, средняя площадь составила – 350±36,7 мкм2, вал клеток был меньше и составил 32-49 мкм в среднем – 41,5±5,3 мкм. Во многих очагах (легкие, печень, селезенка) преобладали экссудативные реакции с лейкоцитарной инфильтрацией в центре казеозного некроза, что свойственно ВИЧ-ассоциированному туберкулезу при многих других исследованиях [8]. Гигантские клетки были единичные, мелких размеров и с наименьшим количеством ядер в клетке, их малым диаметром. Эпителиоидные клетки были также единичными, в очагах выявлено большое количество микобактерий туберкулеза, что совпадает с данными ряда других исследователей [9]. Корреляционной анализ выявил взаимосвязь между клетками СD4+ и толщиной клеточного вала в туберкулезных очагах в группе I – r=0,58, р=0,0000. Корреляция CD4+ клеток с площадью некроза казеозного – r=-0,7, р=0,0000 (рисунок). На течение заболевания неблагоприятное влияние оказывает нерегулярное лечение, а порой и полный отказ от противовирусной терапии, а при сочетании с туберкулезом прием до 5 препаратов приводит к более тяжелому токсическому повреждению печени, что неблагоприятно сказывается на течении ВИЧ-ассоциированного туберкулеза [3].
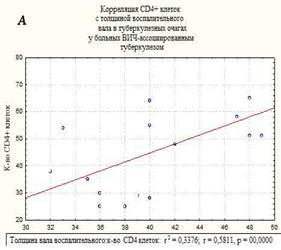
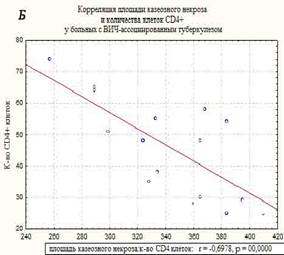
Корреляционные взаимосвязи CD4+-клеток и толщины воспалительного вала в очагах казеозного некроза (А), и с площадью казеозного некроза (Б) у больных ВИЧ-ассоциированным туберкулезом
В терминальной стадии также отмечены диссеминированные и генерализованные формы туберкулеза. Встречаются очаги различных размеров, от милиарных до 1 см. Поражения легких носят двусторонний характер, плевра тусклая, иногда с фибрином, спайки между листками междолевой плевры, висцеральной и костальной плевры. Микроскопически отмечена многочисленность фокусов казеозного некроза с поражением мелких бронхов и бронхиол.
По мере прогрессирования иммунодефицита на стадиях IVБ-В преобладают альтеративно-экссудативные изменения над продуктивными. В терминальной стадии - только альтерация с экссудацией, нередко с экссудацией по типу гнойного воспаления в центре некротических очагов.
Теоретическое обоснование содержания лимфоцитов и их участия в дифференцировке клеток в туберкулезных очагах и выраженность продуктивных реакций, возможно, связано с тотальной иммунной анергией и дисбалансом между Th1 и Th2 лимфоцитами, которые не способны активировать клетки моноцитарного ряда в очаге воспаления и обеспечить нужную продуктивную тканевую реакцию с формированием гранулем и фиброза. Все эти клеточные реакции рассматриваются как проявление гиперчувствительности немедленного типа с потерей биологического смысла реакции гиперчувствительности замедленного типа, что связано с иммунносупрессией и лимфогенной диссеминацией микобактерий туберкулеза по типу туберкулезного сепсиса Ландузи [4].
В большинстве наших наблюдений диагностика ВИЧ-инфекции была только посмертной со скудным анамнезом болезни и жизни, что не позволяло в полной и должной мере оценить и выявить основные и непосредственные причины смерти с большой долей вероятности. Эти трудности свойственны многим другим специалистам, занимающимся проблемой ВИЧ-инфекции, ассоциированной с туберкулезом. Причины смерти в I группе – это, как правило, туберкулез генерализованный или диссеминированный с его интоксикационными проявлениями в виде глубоких дистрофических изменений во внутренних органах, отеком легких. В некоторых случаях доминировали признаки сердечной и легочно-сердечной недостаточности, отека мозга (при менингоэнцефалите). Непосредственная причина смерти у ВИЧ-инфицированных с туберкулезом в стадии IV Б-В и V – это генерализованные и диссеминированные формы туберкулеза, основная причина смерти – ВИЧ-инфекция, подвергающаяся кодированию по МКБ-10. При определении основной и непосредственной причины смерти при стадии менее IVА – это, как правило, туберкулез, кодируемый по МКБ-10. У всех умерших этой группы было диагностировано второе конкурирующее заболевание – гепатит C, а у 9 (45%) была диагностирована двусторонняя бактериальная полисегментарная пневмония.
Заключение. ВИЧ-ассоциированный туберкулез характеризуется атипичной морфологической картиной с преобладанием альтеративно-экссудативных тканевых реакций над продуктивными, склонностью к генерализации и диссеминации туберкулезного процесса с преобладанием его среди мужчин трудоспособного возраста. На данный процесс оказывают влияние отсутствие, отказ или нерегулярный прием противовирусных препаратов, а также наличие конкурирующего заболевания в виде гепатита С. Снижение содержания количества СD4+ клеток находит свое отражение в полном отсутствии и снижении степени выраженности продуктивных тканевых реакций.
Читайте также:


