Цинковые пальцы в лечении вич

Китайские врачи опробовали CRISPR-отредактированные клетки на пациенте с ВИЧ-инфекцией и Т-клеточной лейкемией. После облучения больному ввели его собственные кроветворные клетки, в которых разрушили ген CCR5. Отредактированные клетки прижились в организме и образовали разные типы клеток крови. Серьезных побочных эффектов не возникло. Правда, защитить пациента от вируса они не смогли — из-за низкой эффективности редактирования. Статья опубликована в журнале New England Journal of Medicine.
В 2017 году Лей Сюй (Lei Xu) из Центра исследований стволовых клеток пекинского университета и его коллеги запустили небольшое клиническое исследование, чтобы попробовать создать устойчивость к ВИЧ в клетках крови с помощью CRISPR/Cas9. В своей статье ученые отчитываются о первом пациенте, который прошел их новую терапию. Кроме технологии редактирования, которую использовали китайские ученые, есть и еще одна деталь, которая отличает их эксперимент от исследования Sangamo Therapeutics. Китайцы забирали у пациента не Т-клетки, а стволовые клетки крови. Расчет был на то, что кроветворные клетки приживутся в красном костном мозге и будут постоянно поставлять в организм пациента устойчивые к ВИЧ Т-лимфоциты.
Ученые работали с 27-летним пациентом, у которого кроме ВИЧ-инфекции диагностировали еще и Т-клеточную лейкемию. Его планировали лечить лучевой терапией, которая убивает существенную часть клеток крови, и пересадка кроветворных клеток ему понадобилась бы в любом случае. Ученые решили совместить лечение с экспериментальной процедурой: после облучения ввели больному уже отредактированные собственные клетки. В этот момент антиретровирусную терапию пришлось прервать, чтобы можно было оценить результат эксперимента.
CRISPR-модифицированные клетки прижились в организме и не вызвали острого отторжения. С начала эксперимента прошло уже 19 месяцев, и клетки с разрушенным геном CCR5 все еще можно найти в крови пациента — причем не только Т-лимфоциты, но и другие клетки крови. Это значит, что отредактированные кроветворные клетки работают полноценно и производят разные типы клеток, у которых мутация сохраняется.
Тем не менее, полностью отредактировать кроветворение пациента не удалось. Среди всех клеток, которые ученые у него забрали для редактирования, внести изменения в геном получилось лишь у 17,8 процентов. После возвращения в организм новые клетки начали конкурировать со старыми за заселение красного костного мозга. И в течение всего времени наблюдения они составляли лишь 5-8 процентов от общей кроветворной популяции.
Однако сделать пациента устойчивым к вирусу не удалось: после отмены ретровирусной терапии количество вирусной РНК в крови начало расти, и ему пришлось снова назначить лечение, чтобы инфекция не прогрессировала. В этом смысле китайский эксперимент, равно как и испытание Sangamo Therapeutics, не достиг заявленной цели. Причиной тому стала низкая эффективность редактирования. В китайском эксперименте она была ниже 20 процентов, в исследовании Sangamo Therapeutics — 11-28 процентов, и этого количества клеток недостаточно, чтобы справиться с инфекцией. Для того, чтобы ввести технологию редактирования генов в клиническую практику борьбы с ВИЧ, исследователям придется сначала повысить эффективность метода.
Тем не менее, авторы работы отмечают, что у их исследования есть и позитивный результат. Этот эксперимент — самое долгое на сегодняшний день наблюдение за CRISPR-отредактированными клетками в организме человека, и оно показывает, что такие клетки могут быть безопасны. Исследователи не обнаружили в клетках никаких незапланированных изменений (то есть следов нецелевого редактирования генома). Клетки также не превратились в опухолевые — о чем предупреждали некоторые ученые в 2018 году. Таким образом, китайская работа стала демонстрацией принципа: CRISPR-модифицированные клетки можно использовать в терапевтических целях без риска для пациента.

Цинковые ингибиторы пальцев , или эжекторы цинка, представляют собой вещества или соединения , которые взаимодействуют отрицательно с пальцами цинка и вызывают их , чтобы освободить их цинка из его сайта связывания, нарушая конформации полипептидной цепи и рендеринга цинковые пальцы неэффективным, тем самым предотвращая их от выполнения своих связанные клеточные функции. Это , как правило , осуществляется через хелятацию сайта связывания цинка. Как известно, участвует в регуляции м-РНК - цинковые пальцы, обратной транскрипции, защита синтезированного вирусной ДНК, ингибирование транскрипции, и начальных интеграционных процессов, предотвращение функции пальца цинка может иметь серьезные последствия для функции клетки или вируса.
Ингибиторы цинковых пальцев , как правило , используются для борьбы с ВИЧ . Лечения ВИЧ - инфекции , как правило , полагаются на нацеливание обратные транскриптазы и протеазы. Однако, эти методы оказываются неэффективными вследствие развития резистентных штаммов вируса или из - за прекращение лечения. Этот метод использования ингибиторов цинка пальцев цели и дестабилизировать пальцы цинка представляет собой новый метод борьбы с ВИЧ. Другие вирусы , такие как атипичный пневмония, полиомиелит, Эбола, кори, человеческий Коксаки, денге, бешенство, гепатит человека, человеческий парагриппа и респираторный syncytical человека имеют сходные мотивы цинковых пальцев и потенциально могут извлечь выгоду из технологии ингибиторной цинкового пальца.
эжекторы цинка были запатентованы в 2008 году, и некоторые из них вошли Фазы I / II испытания в качестве лекарства ВИЧ.
содержание
Цинковый палец Ингибитор Цель: белок нуклеокапсиды
ВИЧ-1 белки нуклеокапсиды 7 (NCP7) представляют собой белка мишень эжекторов цинка. NCP7 первоначально сформирована как часть полипептида рвотного и следует затычка-кулак цинкового палец конформации. В своей жизни, NCP7 облегчает раскручивание тРНК, действует в качестве праймера для обратной транскрипции, шапероны нуклеиновых кислот в капсида ВИЧ-1, помогает интегрировать вирусной РНК в многообещающий вирионов , и тесно вовлечены в репликацию ВИЧ-1 как в ранней фазе и поздней фазе. Эти процессы играют важную роль в репликации ВИЧ-1 , таким образом , делая NCP7 главной мишенью для лекарств , стремящихся противоречащими процесс репликации.

NCP7 представляет собой белка 55-аминокислоты, который является весьма основнымами и состоит из двух затычки-шарнирных мотивов. Эти мотивы содержат две пептидных единица Cys-Х2-Х4-Cys-His-Х4-Cys (ККА), где Х представляет собой замещенную аминокислоту, которые составляют связывание цинка иона (II), сайтов. Связывания цинка (II) в сайте связывания ККА необходимо для домена, чтобы быть функциональным и для стабилизации конформации структуры, позволяя NCP7 осуществлять процессы, необходимые для репликации ВИЧ. Поскольку сайт связывания ККА устойчива и участвуют в репликации ВИЧ-1 мутация, она делает главный кандидат для профилактики ВИЧ-инфекций через эжекторы цинка. Запрещая функцию NCP7, вирусная репликация влияет и нефункциональные вирус, который не способен инфицировать своего хозяина производится.
Цинк Эжектор Соединения
Азодикарбонамид (ADA) был первый цинковый эжектором идти в клинические испытания для лечения ВИЧ - инфекции. ААР ингибирует ВИЧ, electophilically нападают на атомы серы цинка скоординированы цистеина. Это взаимодействие электрофильного дестабилизирует сайт связывания цинка , что делает его более легким для ионов цинка должны быть выведены за счет нового размещения облигаций. Сайт связывания затем выполняет обмен дисульфида, образуя новые межмолекулярные дисульфидные связи, и происходит перегруппировка размещения цинка пальца в конформации , который ингибирует свою функцию.
3-nitrosobenzamide (NOBA) и 6-нитрозо-1,2-benzopyrone (NOBP) были первое соединением, чтобы продемонстрировать способность ингибировать инфекцию ВИЧ путем выбрасывания цинка из NCP7. Такое же способ, как ADA, соединения взаимодействуют с 18-остатком полипептидом на N полюса цинка шарнирной области белка нуклеокапсиды ВИЧ, который вызывает выброс цинка из региона путем ковалентной модификации остатков цистеина. Исследования показывают, что NOBA и NOBP были способны подавлять инфекции ВИЧ-1 путем ингибирования обратной транскрипции без явного ухудшения обратной транскриптазы. Это подтверждает роль NCP7 в обратной транскрипции.
Dibas действовать аналогично ADA, Noba и NOBP. Они вступают в реакцию с остатками цистеина на цинковый палец NCP7 и вызывают ковалентное изменение конформации , которые выбрасывают цинк из домена цинкового пальца. Хотя Dibas первоначально казалась перспективной противовирусными кандидатами, были клинические проблемы с их стабильностью. Dibas , как правило , циклизация в benzisothiazolones , которые не имеют такую же активность , когда используются для борьбы с ретровирусов в качестве исходного соединения. Кроме того, глутатион может уменьшить дисульфидных связей в DIBA тем самым ограничивая свою функцию в пробирке .
Mercaptobenzamide пролекарства передачи ацильной группы 36-й цистеин остаток NCP7 и ацильная группа затем мигрирует в соседнем остатке лизина, который вызывает выброс Zn. Mercaptobenzamide и его соответствующее пролекарство дали аддитивность синергии в сочетании с известными препаратами против ВИЧ. Кроме того, они не показали цитотоксичность.
N- [2- (5-pyridiniovaleroylthio) бензоил] сульфацетамид бромид (далее как соединение 45) представляет собой pyridinioalkanoyl тиолэстер, которые могут функционировать в качестве цинкового эжектора. После активации с серебром, соединение 45 использует свои pyridinioalkanoyl группы ковалентно модифицировать NCP7, в частности, изменение остатка цистеина, 36 и 49 на карбоксильном конце цинковый палец. Он выталкивает цинка из цинка связывания сайтов в два этапа. Цинк в карбоксильном-концевой цинковый пальце высвобождается первым, с последующим выбросом цинка из амина-концевых цинкового пальца.
Бис-Thiadizolbenzene-1,2-диамина (NV038) является одним из новых эжекторов цинка. NV038 найден, чтобы осуществить функцию цинкового пальца после того, как вирус вошел в клетку, но перед обратной транскрипцией завершается. NV038, как и других цинк эжекторных соединений, хелаты цинка, чтобы удалить его из сайта связывания. Однако, как полагают, действует через другой механизм, чем многие другие эжекторы цинка из-за его конструктивных особенностей. Его структура не будет легко позволить тиолдисульфидной пересадочной или ацил передачи в цистеин. Вместо этого, NV038, как полагают, вступает в реакцию с цинком, используя свои две карбонильные атома кислорода, найденные в сложных эфирах.
Соображения безопасности
Была озабоченность по поводу того, были безопасны для использования в связи с неопределенностью относительно того, были ли цинковые эжекторы достаточной селективности предназначаться только сайты связывания ККА цинкового пальца в NCP7 эти цинковые эжекторов. Цинковый палец домены не являются уникальными для ВИЧ, а повсеместно распространены в клеточной биологии, а также играют важную роль во многих процессах, таких как клеточной репликации, белок-белковых взаимодействий и репликации ДНК. Если эти цинковые эжекторы непреднамеренно связываются с неправильными доменами цинковых пальцев у них есть потенциал, чтобы отрицательно повлиять на другие клеточные функции, которые могут быть необходимы для собственных функций организма.
Экспериментирование и моделирование избирательности DiBa-1, ADA и других эжекторов цинка обнаружили, что это беспокойство безопасности было по существу необоснованным. Обнаружено, что все эжекторы цинка для эффективной борьбы с репликацию ВИЧ в концентрациях, которые не обладают цитотоксическим действием, обозначающие, что они специально предназначены NCP7 и не предназначаться других цинковых пальцев. Считаются, что такие факторы, как лиганд аффинность связывания лиганда, реактивная близость и общая saddleshape, необходимой для соединения, чтобы вписаться в связывающем карман все играют определенную роль в селективности, показанных эжекторами цинка.
Появление методов манипулирования генетическим материалом ознаменовало собой настоящую революцию в биологии, биотехнологии и медицине. Направленное вмешательство в геном живых организмов позволило решать широкий спектр задач, начиная от создания модифицированных видов бактерий, растений и животных, обладающих новыми ценными свойствами, и клеточных моделей, необходимых для создания новых лекарств, до разработки методов генотерапии, открывающей перспективы исправления врожденных генетических нарушений.

Валентин Викторович Власов — академик РАН, доктор химических наук, профессор, директор Института химической биологии и фундаментальной медицины СО РАН. Лауреат Государственной премии РФ (1999). Автор и соавтор более 200 научных работ и девяти патентов.

Сергей Петрович Медведев — кандидат биологических наук, старший научный сотрудник Института цитологии и генетики СО РАН (Новосибирск) и Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), ведущий научный сотрудник Сибирского федерального биомедицинского исследовательского центра им. акад. Е. Н. Мешалкина (Новосибирск). Автор и соавтор 25 научных работ, 5 патентов и 3 монографий.

Закиян Сурен Минасович — доктор биологических наук, профессор, заведующий лабораторией эпигенетики развития Института цитологии и генетики СО РАН (Новосибирск), лабораторией молекулярной и клеточной медицины Сибирского федерального биомедицинского исследовательского центра им. акад. Е. Н. Мешалкина (Новосибирск), лабораторией стволовой клетки Института химической биологии и фундаментальной медицины СО РАН (Новосибирск). Автор и соавтор 215 научных работ, 5 патентов и 3 монографий.
Открытие ферментов рестрикции и ДНК-лигаз в 1960–1970-х гг. стало толчком к появлению генетической инженерии: с помощью этих ферментов оказалось возможным расщеплять ДНК на заданные фрагменты и вновь соединять их, формируя новые генетические конструкции. Так получали (и получают сейчас) различные варианты бактериальных и вирусных геномов.
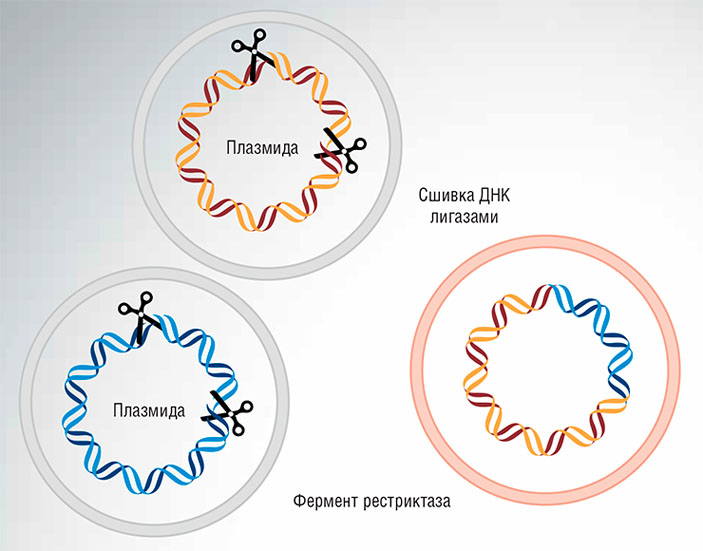
Но специфичности рестриктаз совершенно недостаточно для работы с геномами растений и животных. Такие геномы содержат множество коротких последовательностей нуклеотидов, которые узнаются рестриктазами, поэтому направленное воздействие на один определенный участок становится невозможным. Между тем для решения большого числа важнейших задач биотехнологии и фундаментальной медицины требовались эффективные и точные инструменты для осуществления точечного воздействия на определенные участки ДНК в составах геномов высших организмов, в том числе человека.
К важнейшим задачам современной биотехнологии и биомедицины, нуждающихся в развитии технологий редактирования геномов, относятся:
- создание растений и животных, обладающих новыми, ценными свойствами и признаками (урожайность, устойчивость к неблагоприятным условиям среды, вредителям и патогенам);
- получение мутантных модельных животных для исследования заболеваний человека;
- разработка методов генотерапии, исправления генетических мутаций в культивируемых стволовых клетках человека;
- создание клеточных моделей для поиска и доклинического исследования новых лекарств.
Сначала были химеры


Бактериальное ноу-хау
Однако в 2012–2013 гг. в этой области произошел поистине революционный прорыв: был разработан новый метод генетической инженерии CRISPR/Cas, открывший принципиально новые возможности для манипуляций на уровне генома высших организмов (Cong et al., 2013). Этот метод чрезвычайно прост, обеспечивает точное воздействие на заданные участки ДНК и может быть использован практически в любой современной молекулярно-биологической лаборатории.


Природная защитная система CRISPR/Cas типа II-А бактерии Streptococcus pyogenes, состоит из трех генов (вверху). Созданная на ее основе упрощенная искусственная генетическая конструкция состоит всего из двух генов, в том числе гена, кодирующего одну направляющую РНК, способную опознавать целевой участок ДНК (внизу). В конструкцию также встроен ген NLS, кодирующий сигнал ядерной локализации — белок, обеспечивающий поступление конструкции в ядро клетки
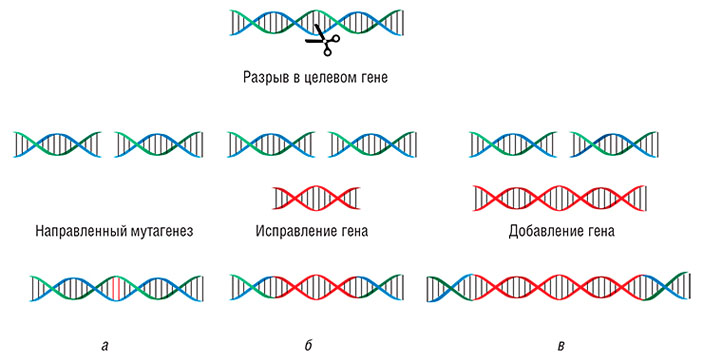
С помощью системы CRISPR/Cas можно осуществлять все виды модификаций генома: вносить точечные мутации, встраивать в определенные места новые гены либо, наоборот, удалять крупные участки нуклеотидных последовательностей, исправлять или заменять отдельные генетические элементы и фрагменты генов.
Технологически стратегия геномной инженерии с помощью системы CRISPR/Cas включает в себя следующие этапы: выбор целевой последовательности и определение вида необходимого воздействия; создание ген-направленной конструкции и доставка ее в клеточное ядро; анализ участка генома, подвергнутого воздействию.
Настоящее и будущее
Благодаря своей простоте, эффективности и широким возможностям система CRISPR/Cas за короткое время уже нашла применение в самых различных областях фундаментальной и прикладной биологии, биотехнологии и медицины.
Внося модификации в различные элементы генома клеток животных и растений и изучая последствия, ученые получают возможность исследовать роль отдельных генов в функционировании отдельных клеток и всего организма в целом. С помощью системы CRISPR/Cas уже получен ряд мутантных лабораторных животных (мышей, крыс, лягушек, рыб). Все эти модельные организмы открывают новые перспективы для исследований в области биологии развития, иммунологии и изучения заболеваний человека и животных.
Уникальная способность комплекса системы CRISPR/Cas избирательно связываться с определенными участками ДНК позволила разработать на ее основе регуляторы активности генов. Для этого в систему включают каталитически неактивный мутантный белок Cas9, к которому могут быть присоединены белки, активирующие или подавляющие функции промоторов, управляющих работой генов. При связывании такого комплекса с целевой ДНК может подавляться либо стимулироваться работа целевого гена.
Более того, при использовании системы CRISPR/Cas возможно одновременно вводить в клетки несколько генетических конструкций, направленных на разные участки генома. Это позволяет воздействовать на работу одновременно нескольких генов, чтобы исследовать взаимоотношения между ними и их участие в нормальных и патологических процессах жизнедеятельности. Таким способом можно, например, определить мутации в генах, ответственные за развитие устойчивости раковых опухолей к химиотерапии.
Применение метода CRISPR/Cas в комбинации с клеточными технологиями открывает принципиальную возможность радикального избавления людей от генетических заболеваний, таких как сахарный диабет, хорея Хантингтона, мышечные дистрофии и др. Генетическое вмешательство может быть осуществлено на уровне эмбрионов, получаемых при проведении экстракорпорального оплодотворения, из которых можно вырастить организм, все клетки которого будут иметь модифицированный геном. Препятствием на пути развития таких технологий являются только этические проблемы: вся необходимая техника уже существует и опробована на лабораторных животных. Например, удалось вырастить здоровых мышей из эмбриональных клеток, в которых был скорректирован дефектный ген, ответственный за развитие катаракты. Эти особи дали здоровое потомство (Wu et al., 2013).
Одной из важнейших задач современной биотехнологии является создание новых пород скота, а также сельскохозяйственных культур растений, высокоурожайных и устойчивых к неблагоприятным условиям. Главной целью применения метода CRISPR/Cas в биотехнологии является создание генетически модифицированных животных и посевных растений, которые бы обладали новыми ценными свойствами. С помощью этой системы уже внесены точные модификации в геном пшеницы и табака, получены сорта риса, устойчивые к бактериям Xanthomonas, вызывающие бактериальную гниль, которая наносит большой экономический ущерб сельскому хозяйству (Chen, Gao, 2013).
Еще одним интересным биотехнологическим направлением применения системы CRISPR/Cas является получение линий животных или растений, способных синтезировать белки человека, например, инсулин, необходимый больным сахарным диабетом, или альбумин, использующийся при лечении геморрагического шока, ожогов и цирроза печени. Сейчас альбумин получают из плазмы крови человека — весьма ограниченного источника, однако мировая потребность в этом препарате постоянно растет и сегодня составляет 500 т в год. С помощью методов геномной инженерии ген альбумина человека уже введен в геном риса и крупного рогатого скота (He et al., 2011; Moghaddassi et al., 2014). Такой белок может быть выделен из растительных и животных тканей, где он синтезировался, и после очищения использован для медицинских целей.
Несомненно, в ближайшее время система CRISPR/Cas будет усовершенствована: можно ожидать упрощения белкового каталитического компонента, повышения избирательности действия системы, создания более эффективных средств доставки в разные типы клеток и целые организмы. Уже получены данные, указывающие на то, что на основе системы CRISPR можно создать средства направленного воздействия не только на ДНК, но и на РНК, что откроет новые возможности для регуляции активности генов и борьбы с вирусными инфекциями.
Хотя система редактирования геномов CRISPR/Cas была создана лишь в 2012 г., она уже применяется во многих лабораториях и компаниях развитых стран. Опубликованы сотни результатов исследований с применением этой технологии, описаны десятки успешных экспериментов по редактированию геномов дрожжей, грызунов, насекомых, растений и человеческих клеток.
Компоненты системы в виде готовых наборов производятся компанией Life Technologies, недавно слившейся с компанией Thermo Fisher (США), и доступны для исследователей. Крупнейшие фармацевтические фирмы, такие как Takeda, формируют с помощью технологии CRISPR банки генетически модифицированных стволовых клеток — клеточных моделей заболеваний.
Несмотря на активное применение этой технологии в крупных мировых научных центрах, в России CRISPR/Cas используют лишь в нескольких исследовательских центрах, в том числе в Новосибирском Академгородке. Сегодня технологии TALENs и CRISPR/Cas используют в лаборатории эпигенетики развития Института цитологии и генетики СО РАН, лаборатории молекулярной и клеточной медицины Института патологии кровообращения им. академика Е. Н. Мешалкина и в лаборатории стволовых клеток Института химической биологии и фундаментальной медицины СО РАН в работах, связанных с внесением мутаций в стволовые клетки человека, в частности, для создания клеточных моделей бокового амиотрофического склероза, болезни Альцгеймера, Паркинсона и синдрома удлиненного интервала QT.
Однако для проведения полномасштабных исследовательских работ с использованием TALENs и CRISPR/Cas необходимо создание консорциума по клеточным технологиям с привлечением ведущих специалистов на базе профильных НИИ РАМН: кардиологии, иммунологии, неврологии, онкологии и др. Создание в Новосибирском Академгородке Центра клеточных технологий может стать инфраструктурной основой для развития новых биомедицинских технологий и высокотехнологичной фармацевтической промышленности — приоритетных направлений развития научно-технического потенциала страны.
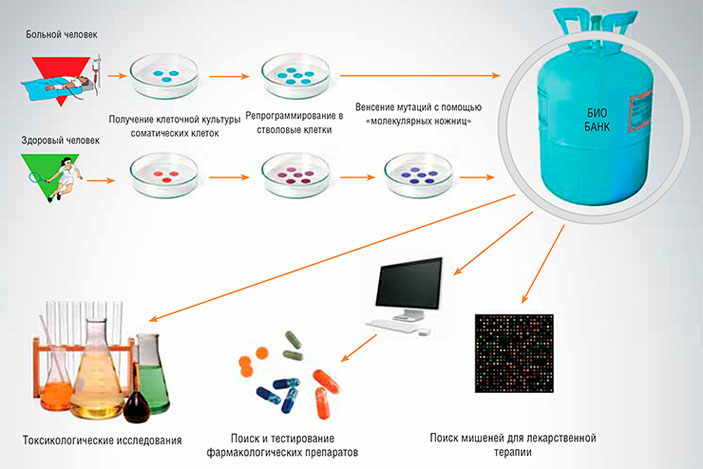
В настоящее время в разработке находится проект Биобанка клеточных моделей заболеваний человека, основой которого станут линии индуцированных плюрипотентных стволовых клеток, полученных из обычных соматических клеток людей, страдающих различными наследственными и приобретенными заболеваниями. Кроме того, в Биобанк войдут клеточные модели наследственных заболеваний человека — клеточные линии, полученные с помощью методов геномной инженерии TALENs и CRISPR/Cas.
Литература
1. Власов В. В. и др. Комплементарные здоровью. Прошлое, настоящее и будущее антисмысловых технологий // Наука из первых рук. 2014. № 1 (55). С. 38–50.
2. Кнорре Д. Г., Власов В. В. // Успехи химии. 1985. Т. 54. № 9. С. 1420–1447.
3. Медведев С. П. Как отредактировать наследственность // Наука из первых рук. 2014, № 1 (55). С. 10–14.
4. Cong L., Ran F. A., Cox D. et al. Multiplex genome engineering using CRISPR/Cas systems // Science. 2013, V. 339. P. 819–823.
5. Kim Y. G., Cha J., Chandrasegaran, S. (1996). Hybrid restriction enzymes: zinc finger fusions to Fok I cleavage domain // Proc. Natl. Acad. Sci. USA, 93, 1156–1160.
6. Moghaddassi S., Eyestone W., Bishop C. E. (2014). TALEN-mediated modification of the bovine genome for large-scale production of human serum albumin // PLoS One, 9, e89631.
7. Schwank, G., Koo, B. K., Sasselli, V. et al. (2013). Functional repair of CFTR by CRISPR/Cas9 in intestinal stem cell organoids of cystic fibrosis patients // Cell Stem Cell, 13, 653–658.
8. Wu, Y., Liang, D., Wang, Y., Bai, M. et al. Correction of a genetic disease in mouse via use of CRISPR-Cas9 // Cell Stem Cell, 13, 659–662.
Поскольку антиретровирусная терапия требует пожизненного режима лечения, исследование , чтобы найти более постоянное лечение для ВИЧ - инфекция в настоящее время. Можно синтезировать нуклеотиды цинковых пальцев с компонентами цинка пальца , который избирательно (селективно) почти связываются со специфическими участками ДНК . Концептуально, ориентация и редактирование могло бы сосредоточиться на хозяин клеточных корецепторы на ВИЧ или на провирусной ДНК ВИЧ.
содержание
Хост клеточных корецепторов для ВИЧ
Кроме того , было отмечено , что 20% кавказского населения обладают мутацию, которая называется CCR5-Δ32 (частота 0.0808 для гомозиготной аллели), который предотвращает CCR5 хемокинов рецепторный белок, который является основным средством вирусного доступа в клетку, из выражается на поверхности их CD4 + Т-клеток . Лица , которые гомозиготные по этой мутации имеют иммунитет к штаммам ВИЧ , которые используют рецептор CCR5 для доступа к ячейке, в то время как те , которые являются гетерозиготными по этой мутации были найдены для снижения вирусной нагрузки в плазме и замедлить прогрессирование СПИДА. Объединив эти факты, исследователи предложили новый метод лечения для ВИЧ . Этот метод пытается лечить инфекцию путем разрушения гена CCR5, такие , как введение CCR5-Δ32 мутации с использованием рекомбинантного аденовирусного вектора или принуждением репарации ДНК с помощью негомологичного конца соединения, который склонен к ошибкам и приводит к нефункциональному геном. Как следствие, в результате чего в выражении нефункциональных CCR5 ко-рецепторов на CD4 + Т - клеток, обеспечивающих иммунитет против инфекции.
В цинковых пальцах нуклеазы , которые были синтезированы для этого лечения производится путем комбинирования FokI рестрикции типа II эндонуклеаз с конструированными цинковыми пальцами. Количество цинка пальцев , прикрепленных к эндонуклеазе контролирует специфичность ZFN , так как они разработаны , чтобы предпочтительно связывается со специфическими последовательностями оснований в ДНК . Каждый ZFN состоит из нескольких цинковых пальцев и один нуклеазы фермента .
ДНК ВИЧ провирусных
цинковый палец связывания
Каталитический домен FokI должен димеризоваться расщеплять ДНК на целевом сайте, и требует, чтобы было два соседних цинковых пальцев нуклеаз (смотри рисунок), которые независимо друг от друга связываются с конкретной кодона в правильной ориентации и расстояния. В результате, два связывающие событие из двух цинковых пальца нуклеазы обеспечивает специфическое нацеливание ДНК. Специфика редактирования генома имеет важное значение для цинковых пальцев нуклеазы, чтобы быть успешным приложением. Следствие офф-таргетинга расщепления может привести к снижению эффективности модификации на-мишени в дополнение к другим нежелательным изменениям.
Точная конституция ZFNs, которые должны быть использованы для лечения ВИЧ до сих пор неизвестно. Связывание ZFNs для переделки Zif268 GeneLink, однако, было хорошо изучены и описано ниже , чтобы проиллюстрировать механизм , с помощью которого цинкового пальца домена ZFNs связывается с ДНК.
Амин - конец альфа - спираль части цинковых пальцев цели основных канавок ДНК спираль и связывает рядом с CCR5 , позиционированием гена FokI в подходящем месте для расщепления ДНК.
Цинковые пальцы повторяют структурные белковые мотивы с функцией распознавания ДНК , которые соответствуют в основных канавках ДНК. Три цинковые пальцы расположены в полукруглой или С-образное расположение. Каждый цинковый палец состоит из антипараллельных бета - листов и с альфа - спирали , удерживаемых вместе с помощью иона цинка и гидрофобных остатков.
Атом цинка ограничен в тетраэдрической конформации путем координации Cys3, Cys6, His19, и His23 и цинка - сера расстояние 2,30 +/- 0,05 ангстрем и цинка - расстояния Азота облигаций 2,0 +/- 0,05 ангстрем.
Каждый цинковый палец имеет аргинин (Arg) , аминокислоты , выступающие из альфа - спирали , которая образует водородную связь с азотом 7 и кислородом 6 гуанина (гуа) , который расположен в 3' - конце сайта связывания. Arg-гуа связь стабилизирована аспарагиновой кислотой из 2 - го остатка, который позиционирует длинную цепь аргинина через водородную связь соли мост взаимодействие.
В остатке-2 (то есть, средний палец) цинка, гистидин 49 образует водородные связи с копланарным гуанином в паре оснований 6. штабелирование гистидина против тимина в паре оснований 5 ограничивает конформационную способность гистидина 49 , ведущую к увеличена специфичность к гистидин-гуанин водородной связи .
На 6 - остатке, пальцы 1 и 3 имеют аргинин жертвуя пару заряженных водородных связей с азотом 7 и кислородом 6 гуанина на 5' - конце усиливающего последовательность распознавания сайта из цинковых пальцев.
Гистидин , координированный с атомом цинка, который также является седьмым остаток в альфа - спирали из цинковых пальцев, координирует ион цинка через его N & epsi и водородные связи с фосфодиэфирным кислородом через Nδ на цепи первичной ДНК.
В дополнении к гистидину , законсервированный аргинин на вторых бета - цепи цинка пальцев вступает в контакт с фосфодиэфирным кислородом на цепи ДНК .
Кроме того, серин 75 на третьи палец водородных связей в фосфат между парами оснований 7 и 8, в качестве единственного контакта с магистральным вторичной цепью ДНК.
Nuclease димеризации и расщепление
Было обнаружено , что FokI не имеет никакой собственной специфичности в его расщеплении ДНК и что домен распознавания цинкового пальца дает избирательность цинку нуклеаз пальцев.
Специфичность обеспечивается димеризацией , что уменьшает вероятность расщепления за пределы участка. Каждый набор из цинковых пальцев специфично к нуклеотидной последовательности по обе стороны от гена - мишени 5-7 разделения между п.н. нуклеазы компонентами.
Димеризации двух ZFNs требуются , чтобы произвести необходимый двухцепочечный разрыв в пределах CCR5 гена , так как взаимодействие между FokI ферментом и ДНК является слабым. Этот разрыв ремонтируются естественными механизмами репарации клетки, в частности , не гомологичной конец соединения .
Вводя мутации CCR5
Введение в геном изменений зависит от любого из двух естественно ремонта механизмов ячейки: негомологичная конец присоединения (NHEJ) и гомологии направленного ремонта (HDR). Ремонт через NHEJ идет о путем лигирования конца разбитых нитей и, при возникновении ошибки, может производить небольшие вставки и делеции. HDR, с другой стороны, использует гомологичной цепи ДНК , чтобы восстановить ген-и делает использование этого механизма ремонта и обеспечения желаемой нуклеотидной последовательности позволяет для вставки гена или модификации.
При отсутствии гомологичной нуклеотидной последовательности оснований , которые могут быть использованы с помощью гомологичной рекомбинации механизма, основной DSB ремонта путь у млекопитающих через негомологичный конец соединительный (NHEJ). NHEJ , хотя способен восстанавливать поврежденный ген, является подверженным ошибкам. ДЖД являются, таким образом, введены в ген , пока ошибка в его ремонте не происходит , при которой точке ZFNs больше не способен связывать и димеризацию и мутация завершена. Для того, чтобы ускорить этот процесс, экзонуклеаза может быть введена , чтобы переварить концы нитей , образующихся на DSBs.
Ограничения
Увеличение количества цинковых пальцев повышает специфичность за счет увеличения числа пар оснований, что ZFN могут связываться с. Однако слишком много цинка пальцев могут привести к офф-мишени связывания и, таким образом, за пределами площадки расщепления. Это связанно с повышенной вероятностью цинковых пальцев связывания с частями генома за пределами интересующего гена.
Современные методы лечения ZFn сосредоточиться на CCR5 гена, никаких известных побочных эффектов в результате изменения CCR5 . Есть штаммы ВИЧ, которые способны использовать CXCR4 проникать в клетку - хозяина, минуя CCR5 вообще. Та же самая технология редактирования гена была применена к CXCR4 отдельно и в сочетании с CCR5
Несколько вопросов существуют с этим экспериментальным лечением. Одна из проблем заключается в обеспечении того , чтобы желаемая механизм восстановления является тот , который используется для восстановления DSB после добавления гена. Еще одна проблема с срыву CCR5 гена является то , что CXCR4 штаммы -специфический или двойной тропик все еще в состоянии получить доступ к ячейке. Этот метод может предотвратить прогрессирование ВИЧ - инфекции.
Для того, чтобы использовать в ZFNs в клинических условиях следующие критерии должны быть выполнены:
я) Высокая специфичность ДНК-связывающий - коррелирует с более высокой производительности и меньшей токсичности ZFNs. Engineered ZFNs принимать во внимание позиционные и контекстно-зависимых эффекты цинковых пальцев для увеличения специфичности.
б) Включить аллостерическую активацию из Foki однажды связанной с ДНК, для того , чтобы произвести только необходимый DSB.
III) Для того, чтобы обеспечить два разных цинковые пальцы нуклеазных субъединиц и ДНК донора к клетке, векторы, которые используются должны быть улучшены, чтобы уменьшить риск мутагенеза. К ним относятся вирусные векторы аденосателлитные, интегразы с дефицитом лентивирусов векторов и аденовируса типа 5 векторов.
v) В ходе гена нацеливания, генотоксичность , связанная с высокой экспрессией ZFNs может привести к клеточному апоптозу и , таким образом , должно быть тщательно проверено в лабораторном и в естественных условиях анализов трансформации.
Администрация лечения
Клетки , в которых мутации индуцированные экс виво отфильтровывается из лимфоцитов с помощью афереза , чтобы произвести аналогичные лентивирусы сконструированных лимфоцитов CD4 + Т-клетки . Они вновь вливаются в тело в виде разовой дозы 1 × 10 10 гена модифицированные аналогичные CD4 + Т-клеток. Вирусный вектор используется для доставки ZFNs , которые вызывают желаемую мутацию в клетки. Условия , которые способствуют этому процессу тщательно контролируют обеспечение производства CCR5 - штамм ВИЧ - резистентные Т - клетки .
Тимоти Рэй Браун , который перенес пересадку костного мозга в 2007 году для лечения лейкемии , был ВИЧ одновременно. Вскоре после операции ВИЧ снизился до неопределяемых уровней. Это результат костного мозга донора будучи гомозиготным по CCR5-Δ32 мутации. Эта новая мутация присвоила устойчивость к ВИЧ у реципиента, в конечном счете , приводит к почти полному исчезновению частиц ВИЧ в его организме. После почти 2 лет без антиретровирусной медикаментозной терапии, ВИЧ все еще может быть не обнаружен ни в одном из его тканей. Хотя этот метод был эффективен при снижении уровня инфекции, риски , связанные с костным мозгом трансплантатами перевешивают его потенциальную ценность как средства для лечения ВИЧ - инфекции.
Читайте также:


