Анализ на вич метод real-time что это
Высокотехнологичные лабораторные методы диагностики дают возможность выявить множество заболеваний на самых ранних стадиях. Метод полимеразной цепной реакции (ПЦР) — один из самых новых и точных способов диагностики. За его разработку ученый Кэри Муллис получил в 1993 году Нобелевскую премию. Сегодня этот метод хотя и считается экспериментальным, но уже широко и успешно применяется в медицине.
ПЦР-диагностика: суть подхода
Метод ПЦР использует принципы молекулярной биологии. Его суть заключается в применении особых ферментов, которые многократно копируют фрагменты РНК и ДНК возбудителей болезни, которые находятся в пробах биоматериала, например в крови.
После этого работники лаборатории сверяют полученные фрагменты с базой данных, выявляют тип возбудителя болезни и его концентрацию.
ПЦР проводят в амплификаторе — приборе, охлаждающем и нагревающем пробирки с пробами биоматериала. Нагрев и охлаждение необходимы для проведения репликации. Точность температурного режима влияет на точность результата.
Диагностические возможности метода ПЦР огромны, с его помощью можно выявить самые разные инфекции. Чаще всего ПЦР-метод применяют для диагностики:
- ВИЧ;
- герпеса;
- различных половых инфекций, в частности хламидиоза, уреаплазмоза, гарднереллеза, микоплазмоза и трихомониаза;
- кандидоза;
- гепатитов;
- мононуклеоза;
- листериоза;
- цитомегаловируса;
- туберкулеза;
- вируса папилломы человека;
- клещевого энцефалита.
Это далеко не полный список, метод ПЦР-анализа используется в разных областях медицины.
У диагностики методом ПЦР много плюсов:
Высокая чувствительность. Метод позволяет выявить возбудителя болезни даже при наличии нескольких молекул его ДНК, то есть на очень ранних стадиях, при хронической форме заболевания, а так же в случаях, когда болезнь никак себя не проявляет, протекая латентно.
Универсальность. Для проведения ПЦР анализа подходит почти любой биоматериал — от крови и слюны до клеток кожи.
Широкий охват. Исследование одного образца может выявить сразу нескольких возбудителей болезни.
Оперативность. Результат, как правило, готов через 5–7 часов, то есть получить заключение можно уже на следующий день после забора биоматериала.
Точность. Метод ПЦР практически никогда не дает ложноположительных или ложноотрицательных результатов, если была соблюдена технология проведения этого анализа.
Невысокая стоимость. По цене ПЦР-анализ сравним с любыми другими лабораторными анализами крови.
Однако следует понимать, что совершенных методов анализа не бывает. У ПЦР есть и минус — высокие требования к соблюдению технологии и к профессионализму лаборантов. Если образец был загрязнен, анализ может дать ложный результат. Поэтому проводить ПЦР-диагностику лучше только в самых лучших лабораториях, где внедрены системы контроля качества работы.
Для ПЦР-диагностики заболеваний на анализ берут разные виды биоматериала. Выбор зависит от типа инфекции. При анализе на ЗППП методом ПЦР берут соскоб или мазок из шейки матки или уретры, а также мочу. Для выявления герпеса, цитомегаловируса, гепатита, токсоплазмоза и ВИЧ на анализ берут кровь. При анализе на мононуклеоз и цитомегаловирус берут мазок из зева. Спинномозговая жидкость используется для анализа при поражениях нервной системы, для диагностики внутриутробных инфекций исследуются ткани плаценты, для выявления легочных инфекций — мокрота или плевральная жидкость.
Подготовка к ПЦР-диагностике напрямую зависит от типа биоматериала. Кровь сдается натощак утром. Моча также сдается утром, в лабораторных условиях, в стерильный контейнер. Перед сдачей мазка или соскоба из урогенитальной области нельзя вступать в половые контакты за несколько дней до исследования, не следует проводить спринцевания. Мазок или соскоб нельзя сдавать во время менструации и в течение 2-х дней после ее окончания.
Существует немало различных методик ПЦР-диагностики: ПЦР в реальном времени, секвенирование, пиросеквенирование, микрофлюидные технологии. Сейчас наиболее распространенным способом проведения анализа является ПЦР в реальном времени — этот метод практически не допускает ложноположительных результатов, к тому же срок обработки образцов при исследовании таким способом сокращается — результат можно получить уже через час.
Для пациента результат ПЦР-анализа может быть либо положительным, либо отрицательным. Отрицательный означает, что следов враждебной ДНК не обнаружено и человек здоров. Положительный подразумевает наличие фрагментов ДНК возбудителя болезни — это значит, что человек заражен и ему требуется лечение.
Нередко ПЦР-диагностика дает положительный результат, но пациент не чувствует никакого недомогания, а признаки болезни отсутствуют. Однако это означает не ошибку, а очень раннюю стадию заболевания. В этом случае необходимы дополнительные исследования и лечение. Если заболевание было диагностировано на столь ранней стадии, следует начинать терапию как можно скорее, ведь чем дальше зайдет болезнь, тем сложнее будет ее вылечить.
ПЦР-диагностика инфекций невероятно точна — она позволяет обнаружить возбудителя болезни, даже если в пробе находится всего одна-единственная молекула его ДНК. Именно это качество сделало ПЦР-анализ одним из эффективнейших диагностических инструментов как для определения наличия инфекции, так и для контроля за ходом лечения.
Екимов А.Н., Шипулин Г.А., Бочкарев Е.Г. Рюмин Д.В.
ЦНИИ Эпидемиологии РФ
Принципиальной особенностью полимеразной цепной реакции в реальном времени является возможность детекции накопления продуктов амплификации непосредственно во время проведения амплификации. Так как кинетика накопления ампликонов напрямую зависит от числа копий исследуемой матрицы, это позволяет проводить количественные измерения ДНК и РНК инфекционных агентов. Полученная информация может быть использована для проведения мониторинга эффективности проводимой терапии, оценки клинического прогноза. В отличие от других методов количественного определения ДНК матрицы в пробе, ПЦР в реальном времени не требует дополнительных манипуляций, связанных с раститровкой ДНК исследуемой пробы или полученных в ходе ПЦР ампликонов, которые усложняют постановку анализа и могут приводить к появлению ложноположительных результатов. Подобный подход позволяет отказаться от стадии электрофореза, что ведет к резкому уменьшению вероятности контаминации исследуемых проб продуктами амплификации, а также позволяет снизить требования, предъявляемые к ПЦР лаборатории.
Широкое внедрение в область практического здравоохранения полимеразной цепной реакции (ПЦР) обусловлено простотой ее выполнения, низкой себестоимостью и надежностью. Вместе с тем, сегодня уже очевидно, что дальнейшее развитие ПЦР получит в области количественного определения нуклеиновых кислот (ДНК и РНК) инфекционных агентов.
Количественное определение ДНК инфекционных агентов в ходе лечения позволяет получать информацию о правильности или безрезультатности проводимой терапии, помогает предсказывать периоды обострения заболевания и принимать адекватные меры для скорейшего излечения больного без нанесения ущерба для его здоровья, связанного с неэффективной терапией.
Существует большое количество способов получить данные о концентрации нуклеиновых кислот в пробе методом ПЦР, но все они требуют дополнительных трудоемких этапов работы, связанных с предварительной раститровкой выделенной из анализируемой пробы ДНК, или полученных в ходе ПЦР ампликонов, что приводит к увеличению времени, необходимого для постановки анализа и сложности интерпретации полученных результатов [2,5]. Также, наличие дополнительных этапов работы увеличивает вероятность ошибки и получения недостоверного результата.
ПЦР в реальном времени.
На сегодня существует метод, лишенный вышеперечисленных недостатков - это метод ПЦР в реальном времени (Real-Time PCR) [4]. Сущность метода заключается в исследовании накопления продуктов амплификации с помощью специального прибора без последующего электрофореза. Так как кинетика накопления продуктов амплификации связана с исходным количеством матрицы, это дает возможность точно оценить её количество [3].
Отличительными чертами данного метода, в отличие от классической ПЦР, является возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале, отсутствие стадии электрофореза, менее строгие требования к организации ПЦР-лаборатории и автоматическая регистрация и интерпретация полученных результатов.
Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и таким образом резко уменьшить число ложноположительных результатов. Поскольку регистрация результатов проводится непосредственно в процессе ПЦР, весь анализ можно проводить в одной-двух комнатах лаборатории и нет необходимости в отдельном помещении для детекции продуктов реакции.
Данная методика в течение последних пяти лет успешно применяется в крупнейших диагностических и научно-исследовательских центрах развитых стран мира и в ближайшее время станет так же широко распространена, как и ПЦР в ее сегодняшнем формате, благодаря экономии производственных площадей, уменьшению количества персонала и востребованности количественного определения ДНК/РНК.
Использование математических методов анализа позволяет проводить автоматическую интерпретацию полученных результатов и снимает проблему субъективной оценки электрофореграмм.
Для постановки ПЦР в реальном времени необходим специальный амплификатор, отличительной особенностью которого является возможность возбуждать и детектировать флуоресценцию, отражающую накопление ампликонов, на каждом цикле амплификации.
Детекция продуктов амплификации.
Для выявления продуктов амплификации в режиме реального времени используют следующие наиболее распространенные подходы:
1. Выщепление 5' концевой метки (TaqMan Assay).
Данная методика основана на использовании 5'-экзонуклеазной активности полимеразы. В реакционную смесь добавляют ДНК-зонды, в состав которых входит флуоресцентная метка в 5'-положении и гаситель флуоресценции в 3'-положении, а также фосфатная группа в 3'-положении. Эти зонды имеют места посадки внутри амплифицируемой области. Гаситель поглощает испускаемое флуоресцентной меткой излучение, а фосфатная группа в 3'-положении блокирует полимеразу.

В ходе ПЦР во время стадии отжига праймеров происходит присоединение ДНК-зонда к комплементарной цепи ДНК, причем чем больше продуктов амплификации образуется в ходе ПЦР, тем больше молекул зондов свяжется с соответствующими ампликонами. Во время стадии элонгации полимераза синтезирует комплементарную цепь ДНК и при достижении зонда начинает его расщеплять благодаря наличию 5'-экзонуклеазной активности. Таким образом происходит разъединение флуоресцентной метки и гасителя, что приводит к увеличению детектируемого свечения [3]. Очевидно, что чем больше ампликонов было наработано в ходе ПЦР на данный момент времени, тем интенсивнее будет свечение.
2. Использование зондов с комплементарными концевыми последовательностями (molecular beacons).
Данная методика отличается от описанной выше тем, что концевые последовательности зонда представляют собой взаимно комплементарные области, поэтому при температуре отжига праймеров они схлопываются и образуют шпильки [6]. Внутренняя область зондов содержит нуклеотидную последовательность, комплементарную амплифицируемой области. При отжиге праймеров зонды, не присоединившиеся к ДНК матрице, остаются в "схлопнутом" состоянии, так что происходит тушение флуоресценции.

Те же зонды, которые отжигаются на матрицу, разворачиваются, и флуоресцентная метка и гаситель расходятся в разные стороны. Таким образом, увеличивается интенсивность свечения.
3. Применение 2-х зондов с резонансным переносом энергии (LightCycler assay).
Данный способ детекции накопления продуктов амплификации отличается повышенной специфичностью, так как увеличение флуоресценции происходит при комплементарном связывании с ампликонами сразу 2-х ДНК зондов [1]. Принцип метода заключается в переносе энергии от одного флуорофора, находящегося на 3` конце первого зонда, ко второму флуорофору, находящемуся на 5` конце второго зонда, причем расстояние между флуорофорами составляет 1-3 нуклеотида.

При одновременном связывании обоих зондов с ДНК матрицей испускаемое первым флуорофором излучение передается на второй флуорофор, а его излучение детектируется прибором. Таким образом, возрастает специфичность анализа.
4. Использование интеркалирующих агентов.
Этот способ детекции основан на том факте, что флуоресценция бромистого этидия и SYBR Green I значительно возрастает при их внедрении в двухцепочечные молекулы ДНК [4]. Таким образом, можно наблюдать за накоплением продуктов амплификации.

Очень важно отметить то, что увеличение флуоресценции может быть связано как с накоплением специфического продукта, так и неспецифического (праймеры-димеры, шмер). Для получения корректных результатов необходимо дополнительное изучение полученных ампликонов с помощью построения так называемых "кривых плавления" (melting curves).
Для этого после окончания ПЦР реакционную смесь нагревают и непрерывно измеряют флуоресценцию. По достижении температуры плавления продукта амплификации флуоресценция резко снижается.

Каждое резкое уменьшение флуоресценции на графике соответствует числу полосок, получаемых на электрофорезе, то есть числу разных типов ампликонов. Для облегчения работы с полученной информацией проводят дифференциальный анализ кривой плавления. Такой способ визуализации полученных данных гораздо удобнее для понимания и анализа.
Применение кривых плавления не ограничивается только детекцией продуктов амплификации с помощью бромистого этидия и SYBR Green I. При использовании кривых плавления в системах с ДНК-зондами (Taq-man assay, beacons) возможно различать точечные мутации, расположенные внутри областей связывания ДНК-матрицы и зонда. Наличие таких мутаций способно привести к изменению температуры плавления зонда и к изменениям в графике кривой плавления [1]. Использование кривых плавления не требует от оператора амплификатора никаких дополнительных манипуляций с пробирками, а интерпретация полученных данных автоматизирована и формализована.
Подводя итоги стоит отметить следующее: использование ДНК-зондов в том или ином варианте является наиболее предпочтительным в свете повышения специфичности анализа. Однако к недостаткам зондов относится высокая стоимость, что делает работу по подбору зондов, праймеров и условий амплификации дорогостоящей. Вместе с тем, использование интеркалирующих агентов является очень простым и дешевым. Отпадает необходимость подбора специальных праймеров, зондов, так как можно пользоваться уже используемыми праймерами, эффективность работы которых уже проверена. Эти обстоятельства делают применение интеркалирующих агентов весьма привлекательным.
В настоящее время создана научная и материально-техническая база для широкого внедрения в клиническую лабораторную диагностику новой генодиагностической технологии - количественного определения ДНК/РНК инфекционных агентов - ПЦР в реальном времени (Real-Time PCR). В ближайшие годы данная технология будет применяться в гепатологии (вирусные гепатиты В и С), в клинике ВИЧ и ВИЧ-ассоциированных инфекций (в первую очередь герпетическая и цитомегаловирусная инфекции), в дерматовенерологии, фтизиатрии, гастроэнтерологии, пульмонологии. С помощью ПЦР в реальном времени будет оцениваться эффективность проводимой терапии и клинический прогноз заболевания.



Система для проведения ПЦР-реакции Abbott RealTime mSystems – это универсальная платформа для консолидации различных ПЦР исследований, а также для роста объема тестирований в вашей лаборатории.
Системы Abbott RealTime разработаны так, чтобы получать одинаково точные результаты как при больших, так и при малых объемах исследований. Во всех системах Abbott используются одинаковые реагенты для экстракции, амплификации и детекции. В результате, при увеличении объемов тестирования, вы можете ожидать получение высокоточных результатов вне зависимости от того, какую систему вы используете.
m2000rt
Полная автоматизация амплификации и детекции ДНК, РНК или общих НК.
m2000sp
Полная автоматизация пробоподготовки для больших объемов исследований, включая смешивание мастер-микса и раскапывание в планшет для ПЦР.
m24
Автоматизация пробоподготовки для небольших объемов исследований. Полная автоматизация процесса выделения НК
Экстракция вручную
Пробоподготовка вручную для лабораторий с небольшими объемами. Обеспечивает экстракцию на таком же высоком уровне, как и на системах семейства Abbott mSystems.
| Артикул | Название | Кол-во определений |
|---|---|---|
| нет | Набор реагентов для определения вируса папилломы высокого риска методом ПЦР в режиме реального времени Abbott Real Time High Risk HPV | 96 опр |
| нет | Набор реагентов in vitro для качественного определения 1 типа (ВИЧ-1) методом ПЦР в режиме реального времени RealTime HIV-1 Qualitative | 96 опр |
| нет | Наборы реагентов in vitro для определения ДНК цитомегаловируса методом ПЦР в режиме реального времени Abbott RealTime CMV | 96 опр |
| нет | Набор реагентов in vitro для определения вирусной нагрузки ВИЧ методом ПЦР в режиме реального времени | 96 опр |
| нет | Реагенты in vitro для определения генотипа вируса гепатита C методом ПЦР в режиме реального времени | 96 опр |
| нет | Реагенты in vitro и расходные материалы для определения вирусной нагрузки гепатита В методом ПЦР в режиме реального времени | 96 опр |
| нет | Набор реагентов in vitro для определения вирусной нагрузки гепатита C методом ПЦР в режиме реального времени | 96 опр |
| нет | Набор реагентов для генотипирования вируса иммунодефицита человека ViroSeq HIV-1 с целью выявления мутаций лекарственной устойчивости | 96 опр |

Abbott - международная компания, деятельность которой направлена на улучшение жизни людей за счет разработки продукции и технологий в сфере здравоохранения. Являясь мировым лидером в области диагностики invitro, Abbott предлагает широкий спектр инновационного лабораторного диагностического оборудования и тест-систем для ЛПУ различного профиля, референс-лабораторий, банков крови, поликлиник и клинических лабораторий. Диагностическая продукция Abbott играет огромную роль в развитии медицинской лабораторной диагностики за счет внедрения в практику новейших научных исследований и новейших технологических решений, позволяющие повысить качество медицинского обслуживания пациентов.
🔊 Прослушать пост
ПЦР (полимеразная цепная реакция) представляет собой метод молекулярной генетики, который позволяет анализировать любую короткую последовательность ДНК (или РНК) даже в образцах, содержащих только мельчайшие количества ДНК или РНК, тем самым определив наличие/отсутствие патогенного возбудителя (определить, например есть ли в человеке вирус ВИЧ или гепатита Б или микобактерии туберкулёза). ПЦР используется для воспроизведения/умножения/клонирования (амплификации) выбранных участков ДНК или РНК для анализа.
Метод ПЦР настолько прост, что его может поставить даже школьник)
Раньше амплификация ДНК включала клонирование сегментов, представляющих интерес, в векторы для экспрессии в бактериях и занимала недели. Но теперь, когда ПЦР делается в пробирках, требуется всего несколько часов. ПЦР является высокоэффективной, так что из ДНК может быть сделано огромное количество копий.

Последовательность ДНК и соответствие нуклеотидов.
Более того, ПЦР использует те же молекулы, которые природа использует для копирования ДНК:
То есть ПЦР — это такая техника при которой частицы ДНК (иногда РНК) умножаются в определенном растворе или на специальной поверхности, где они могут быть депонированы.
ПЦР — это метод, с помощью которого учёные могут находить иглу в стоге сена и затем строить стог из этих игл.
Ключом к пониманию ПЦР является знание о том, что каждый человек, животное, растение, паразит, бактерия или вирус содержит генетический материал — ДНК (или РНК) последовательности (нуклеотидные последовательности или кусочки ДНК (или РНК)), которые уникальны для каждого индивидуума. То есть, если образец содержит сегменты ДНК или РНК,
задача ПЦР как метода — умножить (амплифицировать), сделать как можно больше их копий, чтобы можно было идентифицировать кому они могут принадлежать (определенному человеку, животному или патогенному организму), даже если есть только следы наличия ДНК/РНК.
Однако ПЦР-амплификация является лишь частью диагностического теста. После проведения амплификации амплифицированные сегменты необходимо сравнить с другими нуклеотидными сегментами, но уже из известного источника (например, конкретного человека, животного или патогенного организма). Это сравнение уникальных сегментов часто выполняется путем размещения нуклеотидных последовательностей, сгенерированных ПЦР, рядом с известными нуклеотидными последовательностями от людей, патогенов или других источников в специальном геле.
В 1983 году Кари Муллис разработал основные этапы по амплификации ДНК-последовательностей. Он и Майкл Смит были удостоены Нобелевской премии за создание ПЦР в 1993 году.

ПЦР проводится в одной пробирке с соответствующими химическими веществами и при определенной температуре нагревания.
Необходимы следующие реагенты или химикаты:
- Образец, содержащий нуклеотидную последовательность (из крови, волос, гноя, кожи и т. д.).
- ДНК-праймеры: короткая одноцепочечная ДНК, которая присоединена к нуклеотидным последовательностям, которая способствует синтезу комплементарной цепи нуклеотидов.
- ДНК-полимераза: фермент, который, когда ДНК связывается с праймером, спускается по фрагменту ДНК с добавлением структурных блоков ДНК для образования комплементарных пар оснований и, таким образом, синтезирует комплементарную нуклеотидную цепь ДНК (введение термостойкой ДНК-полимеразы, Taq-полимеразы , полученной из термостойких бактерий, заметно улучшает способность к ПЦР).
- Большой избыток структурных блоков ДНК, называемых нуклеотидами (аденин, тимидин, цитозин и гуанин, сокращенные как: A, T, C и G соответственно) в растворе. Когда эти блоки соединены вместе, они образуют нуклеотидную последовательность или одну нить ДНК. Когда эти строительные блоки связывают свой комплементарный строительный блок слабыми водородными связями (например, A будет связываться только с T и G только с C) образуется комплементарная нуклеотидная последовательность ДНК, которая связана с исходной одноцепочечной ДНК. Когда связывание завершается, комплементарная ДНК с двойной цепью образуется в определенной последовательности.
Он верит в астрологию, но не верит, что ВИЧ вызывает СПИД.)
Затем полимеразно-цепная реакция начинается с сегмента ДНК из образца, который помещается в пробирку с указанными выше реагентами. Раствор нагревают до 94°С. Нагревание разрушает водородные связи, которые позволяют образовывать комплементарные цепи ДНК, поэтому в смеси существуют только одиночные нити (это называется денатурацией двухцепочечной ДНК).
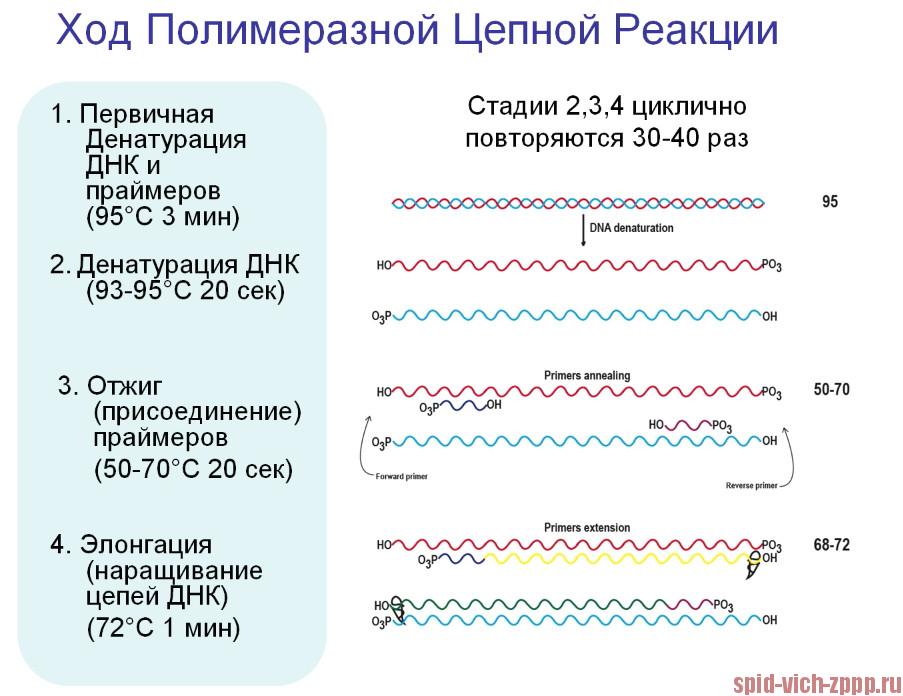
Этапы ПЦР
Смеси дают остыть до 54°C. При этой температуре ДНК-праймеры и ДНК-полимераза связываются с отдельной одноцепочечной ДНК (это называется отжигом ДНК). Поскольку строительных блоки в избытке (высокая концентрация) в смеси, полимераза использует их для создания новых комплементарных нитей ДНК (называемых расширением ДНК), и этот процесс происходит быстрее при 72°C. Этот процесс создает новую двухцепочечную молекулу ДНК из каждой из одиночных нитей исходной молекулы.
Этот цикл повторяется примерно 40 раз в машине, называемой термическим циклером (термосайклером), который автоматически повторяет циклы нагрева-охлаждения, при этом количество каждой последовательности ДНК удваивается каждый раз, когда цикл нагрева-охлаждения завершается. То, что изначально было одним коротким сегментом ДНК, можно было увеличить до примерно 100 миллиардов копий после 40 циклов удвоения.
Тест на ПЦР является основой для ряда тестов, которые могут отвечать на многие различные медицинские вопросы, которые помогают врачам диагностировать и лечить пациентов. Например, тесты ПЦР могут обнаруживать и идентифицировать патогенные организмы у пациентов, особенно тех, которые трудно культивировать (например, ВИЧ и другие вирусы и некоторые грибы).
Одни врачи назначают ПЦР-тесты, чтобы помочь диагностировать генетические заболевания, в то время как другие врачи используют ПЦР для обнаружения биологических родственных отношений, таких как идентификация родителей детей. ПЦР-тесты также используются для идентификации и характеристики генетических мутаций и перегруппировок, обнаруженных при определенных раковых заболеваниях.
Тем не менее, ПЦР-тесты были модифицированы и внедрены во многие аспекты научных исследований, включая эволюционную биологию, генетическую отпечатку пальцев, судебно-медицинские исследования и многие другие.
Обратно-транскриптазный ПЦР (RT-PCR) — это тест на ПЦР, который предназначен для обнаружения и измерения количества РНК. Хотя первоначальные тесты ПЦР амплифицировали ДНК, многие вирусы и другие биологические компоненты (например, митохондрии) используют РНК в качестве своего генетического материала. RT-PCR отличается от обычной ПЦР сначала взятием РНК и превращением нити РНК в нить ДНК. Это делается по существу тем же самым методом для ПЦР, описанным выше, за исключением использования фермента, называемого обратной транскриптазой, вместо ДНК-полимеразы.
Обратная транскриптаза позволяет перевести одну нить РНК в комплементарную цепь ДНК. Как только эта реакция происходит, рутинный метод ПЦР можно затем использовать для амплификации ДНК. RT-PCR используется для обнаружения и изучения многих РНК-вирусов. RT-PCR не следует путать с другим вариантом ПЦР, называемым ПЦР в реальном времени (реал-тайм).
ПЦР в реальном времени представляет собой вариацию ПЦР, которая позволяет анализировать амплифицированную ДНК в течение обычных 40 циклов процедуры. Хотя процедура аналогична обычной ПЦР с циклированием, ПЦР реального времени использует флуоресцентные красители, прикрепленные к некоторым из строительных блоков или небольших нуклеотидных нитей. В зависимости от используемого метода флуоресценция возникает, когда образуются амплифицированные нити ДНК. Количество флуоресценции можно измерить на протяжении 40 циклов и позволяет исследователям измерять определенные продукты и их количества во время циклов амплификации.
Это часто позволяет исследователям или техническим специалистам пропускать гель-электрофорез или другие вторичные процедуры, необходимые для анализа продуктов ПЦР, тем самым обеспечивая более быстрые результаты. ПЦР в реальном времени и RT-PCR являются вариациями или модификациями исходного теста ПЦР. Тем не менее, существует еще много вариантов (не менее 25), которые существуют и используются для решения конкретных проблем. Все они имеют разные названия, такие как сборка ПЦР, ПЦР с горячим началом, мультиплексная ПЦР, твердотельная ПЦР и многие другие.
ПЦР будет развиваться и дальше, чтобы помочь ответить на многие другие вопросы в медицине, биологии и других областях науки.
ПЦР (полимеразная цепная реакция) — метод умножения генетического материала вируса, анализ, который определяет генетический материал вируса — РНК или ДНК ВИЧ.
Если вирус содержится в минимальном значении, то в результате реакции это количество многократно увеличивается. Поэтому ПЦР имеет высокое диагностическое значение.
Обычно этот тест используется для определения ВИЧ в донорской крови или для раннего определения наличия ВИЧ в организме до выработки специфических антител к ВИЧ. Специфические антитела определяют обычные тесты на ВИЧ (ИФА), но только через 1-3, редко 12 месяцев после заражения. А с помощью ПЦР можно дать достаточно точный ответ через 14 дней с достоверностью 98% и даже через 5 дней, но тогда достоверность будет 80%. ПЦР на ВИЧ — это дорогой и более трудоемкий анализ, чем ИФА, поэтому его используют не всем подряд, а только по особым показаниям (доноры, пострадавшие от медицинской аварии с ВИЧ-инфицированным) или платно.
Это метод определения комплиментарного участка ДНК в геноме клетки лимфоцита пораженного ВИЧ. Т.е. определяется не сам вирус, а материал, который вирус встраивает в клетку. В ядре клетки уже будет храниться его ДНК из которой он потом будет считываться и размножаться (копировать самого себя).
Количественный ПЦР анализ на РНК ВИЧ — определяет количество копий РНК вируса в крови (для определения вируса в клетках используют ПЦР ДНК, например у детей). Делается только у ВИЧ-инфицированных, для контроля лечения, определения выраженности процесса развития болезни, эффективности лечения.
ВИЧ с помощью ПЦР можно обнаружить через 4-14 дней после заражения. Отрицательный результат ПЦР на ВИЧ достоверен после 14 дней после рискованного контакта, но по действующим нормативам всё равно требуется обследование с помощью ИФА.
РНК обычно используется в количественных тестах для оценки вирусной нагрузки у диагностированных лиц, например, для оценки эффективности терапии.
ДНК — в мононуклеарных клетках, например, для диагностики у детей, там, где антитела к ВИЧ матерей мешает использовать метод ИФА.
И тот и другой тест могут быть и количественными, и качественными.
И тот, и другой можно в особых случаях применить диагностики, но с учетом конкретных ограничений, которые накладывают технические параметры системы, т.е. по назначению врача.
Но если были допущены ошибки со стороны персонала медицинского учреждения , ТО ПЦР может быть ложноположительным, более чем в 2% случаев.
Для исследования на ВИЧ методом ПЦР сдаётся кровь из вены, желательно (но необязательно) утром натощак.
-
Москва: ЦМД (2450 руб.), ИАКИ (2300 руб.). Санкт-Петербург: СПб СПИД-центр. Екатеринбург: КДЛ (2480 руб.). Самара: СитиЛаб (1400 руб.). Краснодар: КДЛ (3000 руб.). Минск: Республиканский центр гигиены, эпидемиологии и общественного здоровья. Киев: Первая Независимая Лаборатория.
Около 1,5-3 тыс. руб. в зависимости от региона.
Через 14 дней после заражения достоверность ПЦР на ВИЧ составляет 100%, с 4-5 дня — достоверность 80%.
Технически 4-6 часов, но в реальности зависит от организации работы лаборатории и обычно результат выдается через 2-3 дня.
Так как у ребёнка до 1,5 лет рожденного от ВИЧ+ матери сохраняются её антитела против ВИЧ, то определить заражен ВИЧ ребенок или нет с помощью ИФА невозможно. В такой ситуации используется ПЦР:
- Если у ребенка возрастом 1 мес с помощью ПЦР обнаружили вирус, значит он заразился.
- Если у ребенка в 1-2 месяца и 4-6 месяцев ПЦР отрицательная, то при условии, что мать не кормила его своим грудным молоком — ребёнок здоров.
ПЦР определяет сам вирус, а ИФА реакцию (в виде антител) организма на вирус.
ПЦР быстрее определяет наличие вируса, чем ИФА.
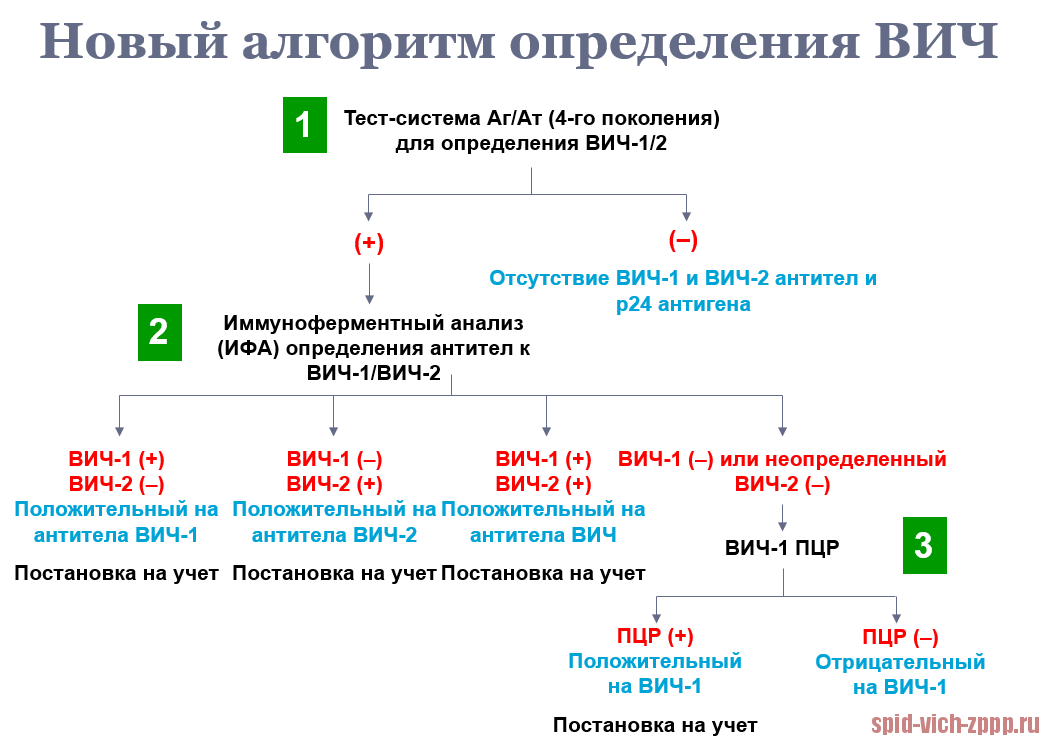
Новый алгоритм определения ВИЧ.
Читайте также:


