Сепсис при черепно-мозговой травме




Статьи → Септический шок у пациента с тяжелой черепно-мозговой травмой
Снижение артериального давления (АД) является ведущим фактором вторичного повреждения головного мозга у пациентов с тяжелой черепно-мозговой травмой (тЧМТ). Артериальная гипотензия (АГ) у пациентов с повышенным внутричерепным давлением (ВЧД) приводит к снижению церебрального перфузионного давления (ЦПД), что может привести к вторичной ишемии мозга. АГ требует незамедлительной коррекции, с учетом механизма её развития [1, 2,3]. В представленном клиническом наблюдении, у пациента с тЧМТ, осложнившейся септическим шоком, иллюстрируется роль расширенного гемодинамического мониторинга и скрининга маркеров воспаления в оптимизации интенсивной терапии (ИТ).
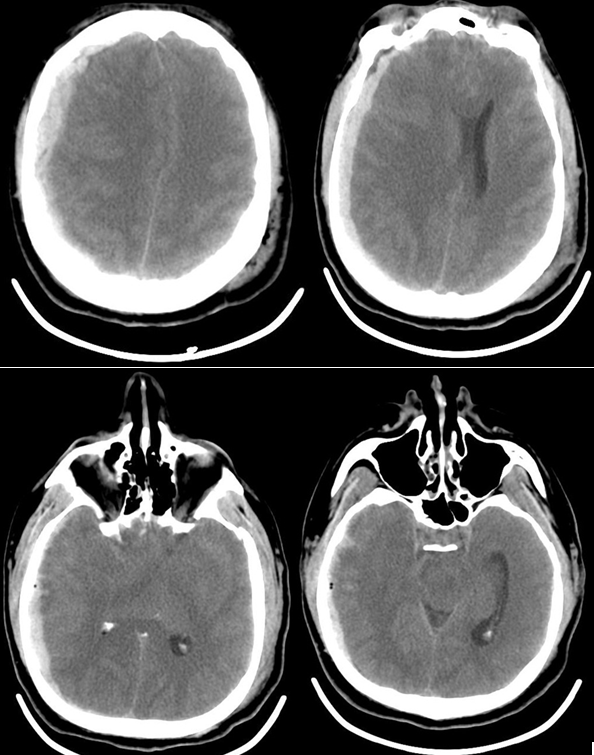
Рис. 1 КТ головного мозга пациента К., 42 года
Катетеризирована лучевая артерия, начат инвазивный мониторинг АД (монитор - Philips IntelliVue MP60). Системное АД без вазопрессорной и инотропной поддержки состовляло: АД – 145/88-160/90 мм рт.ст., ЧСС- 69-85 уд/мин. Дыхание аппаратное в режиме SIMV+PS, с параметрами вентиляции: tV- 0.7 l, RR-14, PS- 14 mbar, PEEP- 7 mbar, FiO2- 0.6, обеспечивающими нормовентиляцию по данным КОС артериальной крови. При фибробронхоскопии - признаки перенесенной аспирации.
С первых суток пребывания в Институте у пострадавшего отмечались гипертермия до 39,0º С, повышение С реактивного белка до 125 мг/л, лейкоцитоз- 22.89 х 10 000000000/л (норма- 6000 пг/мл и 2805 Е/мл (норма: 0.0-5.9 пг/мл и 158-623 Е/мл соответственно), что можно было расценивать как начальные проявления системной воспалительной реакции.
В результате состояние пациента было расценено как септическое. Была расширена антибактериальная терапия, начата продленная вено-венозная гемофильтрация (ПВВФ). Взяты биологические среды на микробиологический анализ (на вторые сутки культивирования был выявлен рост Грамм (-) возбудителя в посевах крови).
На фоне проводимой терапии состояние пациента стабилизировалось: удалось корректировать артериальную гипотензию, добиться необходимого ЦПД, что привело к нормализации ВЧД. В течение последующих двух суток, температура тела нормализовалась до 36,0º С, удалось уменьшить дозы симпатомиметиков в 2-3 раза, снизить FiO2 c 1.0 до 0.6, у пациента восстановилось сознание в виде открывания глаз, выполнения простых инструкций. На момент перевода пациента из Институте в реабилитационный центр оценка по ШИГ – 4 балла.
В представленном клиническом наблюдении иллюстрируется роль скрининга маркеров воспаления и расширенного гемодинамического мониторинга в оптимизации ИТ пациента в остром периоде т ЧМТ. Бактериальные инфекции и сепсис являются основной причиной заболеваемости и смертности в ОРИТ [4, 5]. Не вызывает сомнений тот факт, что высокая смертность от сепсиса во многом обусловлена его поздней диагностикой и неэффективным мониторингом проводимого лечения. Клинические и лабораторные признаки системной воспалительной реакции, такие как лихорадка, тахикардия, тахипноэ и лейкоцитоз, могут быть результатом неинфекционных причин. С этих позиций особый интерес представляет поиск надежных и ранних маркеров системной воспалительной реакции. Если сравнивать чувствительность таких маркеров септической реакции как CRP (Ц-реактивный протеин), PCT (прокальцитонин) и IL-6 (интерлейкин-6), то по данным мировой литературы большинство авторов ставят на первое место прокальцитонин, далее интерлейкины и затем С-реактивный белок [6, 7]. Но, необходимо понимать, что в каждом конкретном случае нужно комплексно оценивать степень выраженности инфекционного процесса и его локализацию. В литературе описаны случаи, когда концентрация прокальцитонина не возрастала или возрастала в малой степени при тяжелых вирусных инфекциях или воспалительной реакции неинфекционной природы. [8, 9]. Также, доказано, что прокальцитонин не определяется или его уровень очень низок при изолированной пневмонии, но чрезвычайно высок при пневмонии и сепсисе. Что касается IL-6 – большинство авторов ставят его на второе место после прокальцитонина по чувствительности и специфичности в диагностике сепсиса. В приведенном клиническом наблюдении на 10-е сутки состояние больного резко ухудшилось, развилась сердечно-сосудистая недостаточность, артериальная гипотензия, резистентная к стандартным дозам симпатомиметических препаратов, в сочетании с выраженной устойчивой гипертемией. Артериальная гипотензия, снижение ЦПД, сочетались с эпизодами подъема ВЧД до 40 ммрт ст. В этой клинической ситуации была необходима экстренная дифференцировка между сепсисом, формированием диэнцефального синдрома, вторичной надпочечниковой недостаточностью, и первичным повреждением миокарда.
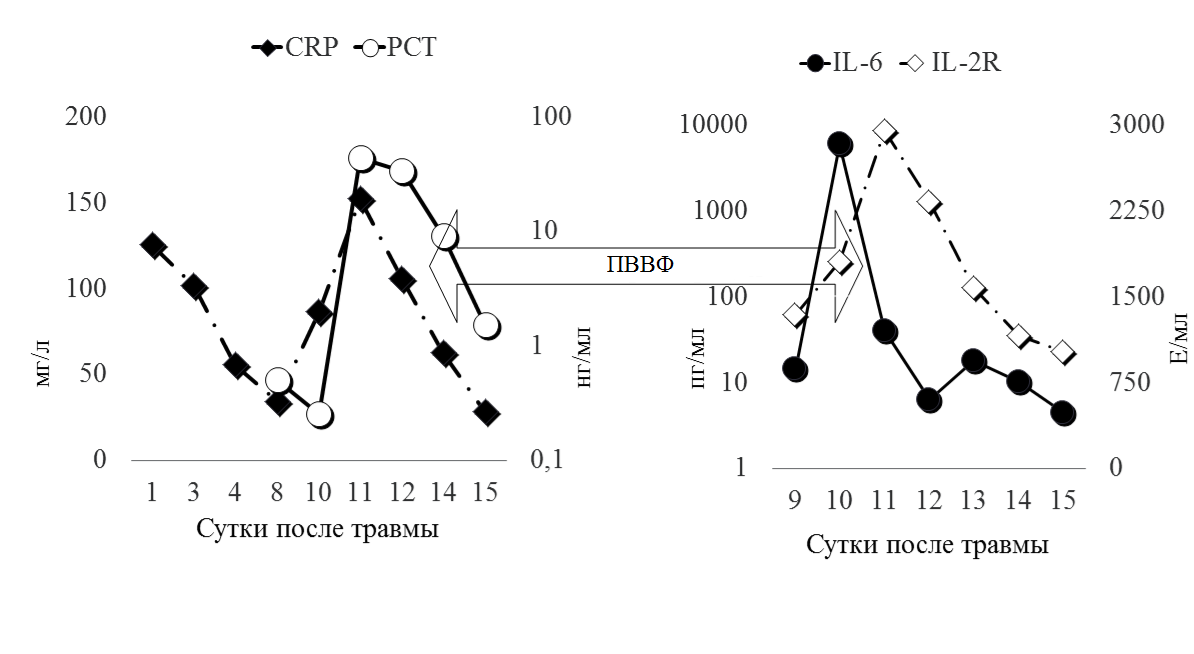
Рис. 3 Динамика маркеров воспаления
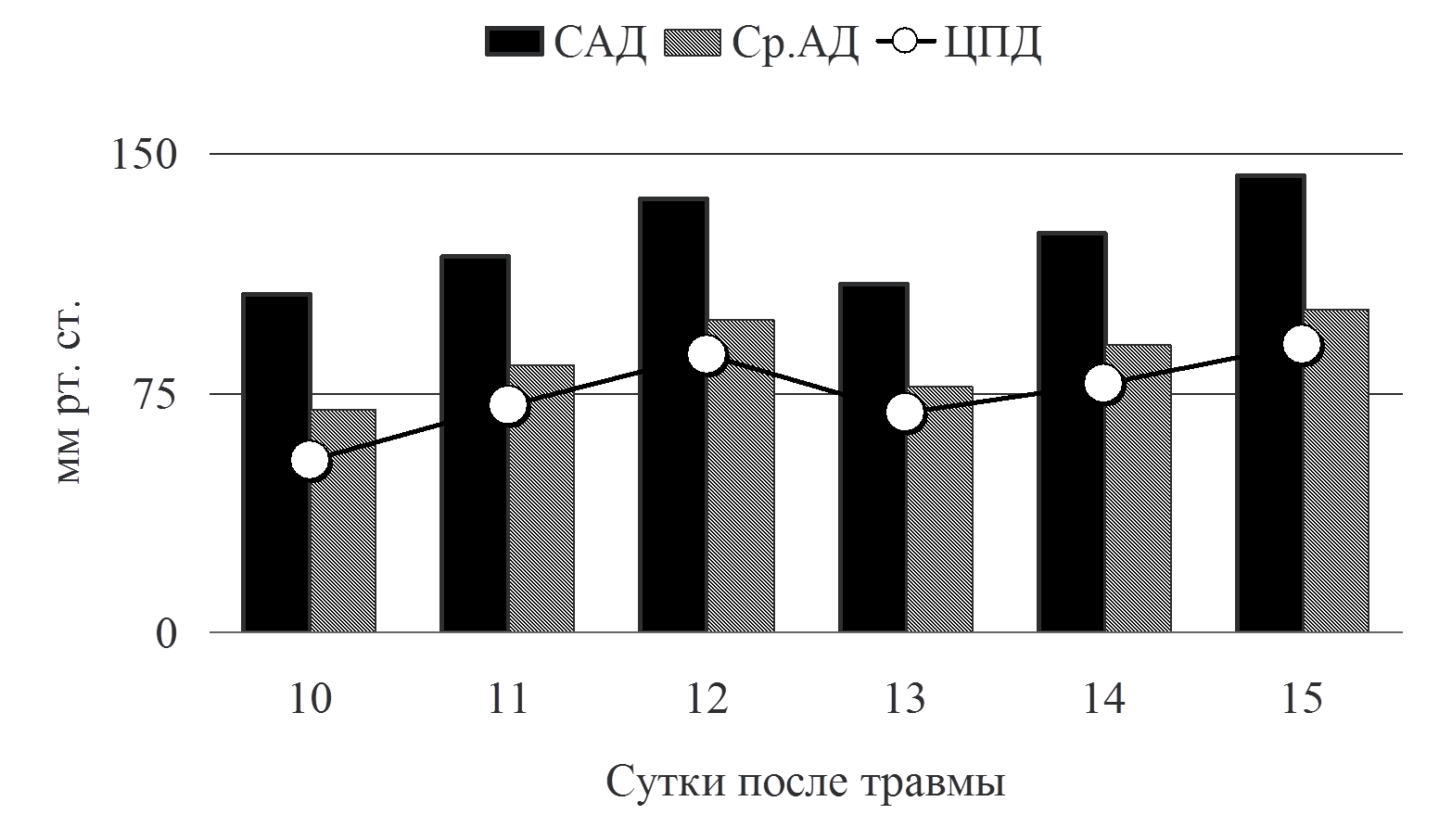
Рис.4 Динамика давления
Как видно из графика на рис. 4, мы поддерживали систолическое и среднее АД на достаточно высоких цифрах, что противоречит современным рекомендациям по терапии сепсиса. Тому есть свое объяснение. Последние международные рекомендации по ведению пациентов с тЧМТ подчеркивают необходимость мониторинга АД и предупреждения артериальной гипотензии. При этом артериальной гипотензией считается снижение систолического артериального давления ниже 90 мм рт. ст. (рекомендации второго уровня). Там же приводятся данные демонстрирующие ухудшение результатов лечения при снижении Ср. АД ниже 80 мм рт ст [10]. Высокие цифры среднего АД, обеспечивали ЦПД выше 60 мм рт. ст., что было необходимо для поддержания адекватного объемного мозгового кровотока, у пациента в остром периоде тЧМТ, осложненной отеком мозга. Как же поддерживались необходимые параметры системной гемодинамики в анализируемом клиническом наблюдении? Адекватность терапии, направленной на поддержание необходимого артериального давления, обеспечивалась расширенным гемодинамическим мониторингом PiCCO (транспульмонарная термодилюция).
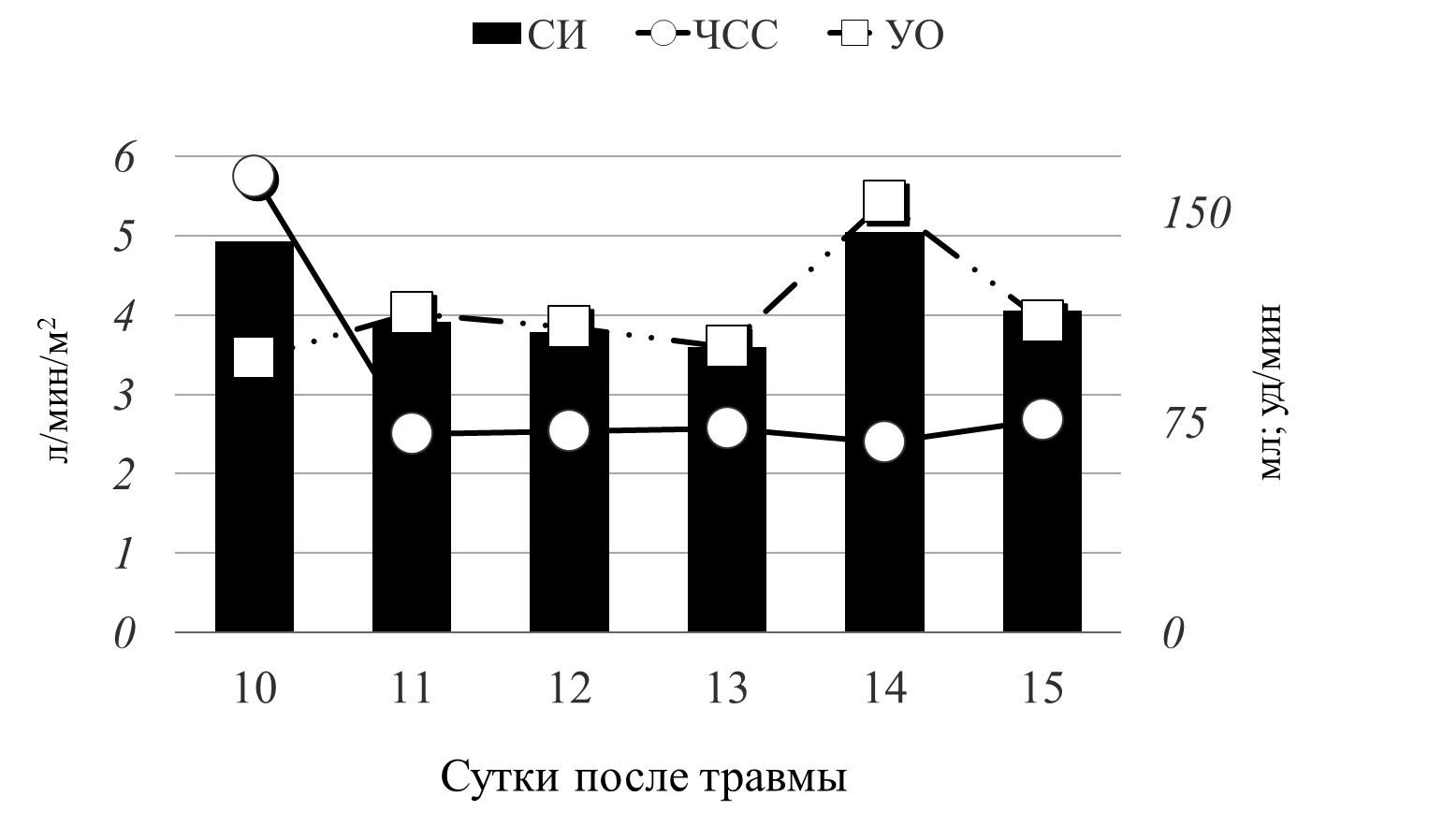
Рис 5 динамика СИ
График демонстрирует динамику сердечного индекса (рис.5). В течение первых суток септического шока нормальный уровень СИ поддерживался за счет выраженной тахикардии (ЧСС до 167 уд/мин) при низком ударном объеме - 87,6 мл. На фоне проводимой терапии мы добились нормализации сердечного ритма 80-83 уд/мин, при этом СИ поддерживался уже за счет адекватного УО – 160 мл.
Одним из методов поддержания необходимого среднего АД было применение симпатомиметиков (рис. 6).
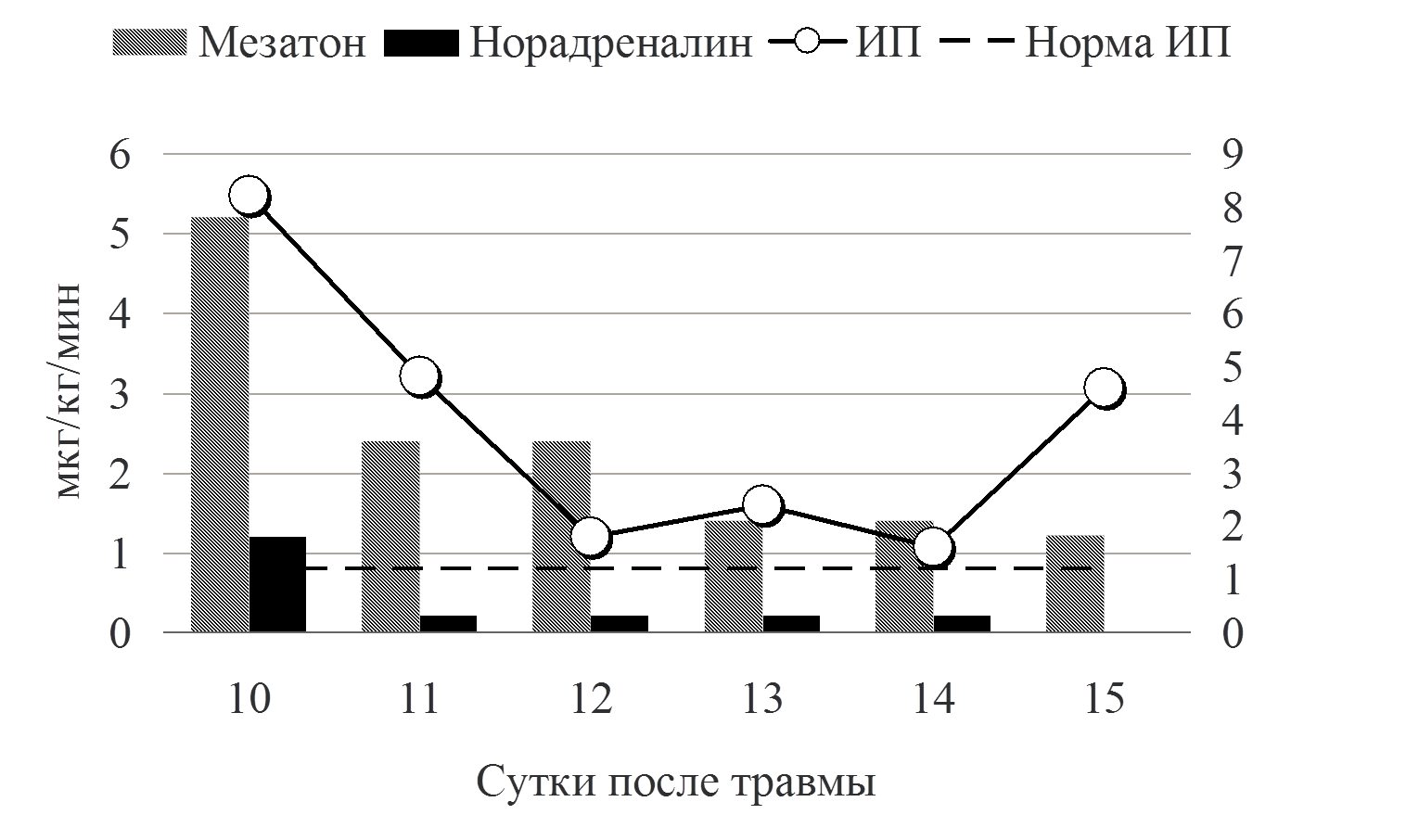
Рис. 6 Применение симпатомиметиков
В приводимом клиническом наблюдении требовалось сочетание двух препаратов мезатон (фенилэфрин) и норадреналин в высоких дозировках. Безопасность применения вазопрессоров контролировалась двумя показателями гемодинамики ОПСС и индексом перфузии (ИП). Из графика видно, что применение высоких доз симпатомиметоков не приводило к нарушению периферической циркуляции крови. Так, на начальном этапе при применении мезатона и норадреналина в дозировке 5,7 мкг/кг/мин и 1,4 мкг/кг/мин, соответственно, выявлялись относительно низкие цифры ОПСС (830 DSм2/см5) и высокий показатель ИП - 8. В дальнейшем в процессе терапии комбинацией симпатомиметиков ИОПСС не превышал физиологической границы (2000 DSм2/см5), а индекс перфузии не был ниже 1,2. Другим важным компонентом поддержания адекватных показателей системной гемодинамики является инфузионная терапия. При выборе тактики увеличения либо снижения темпа инфузионной терапии мы ориентировались на статические (ЦВД, ИВГОК) и динамические (ВУО) показатели волемии (рис.7).
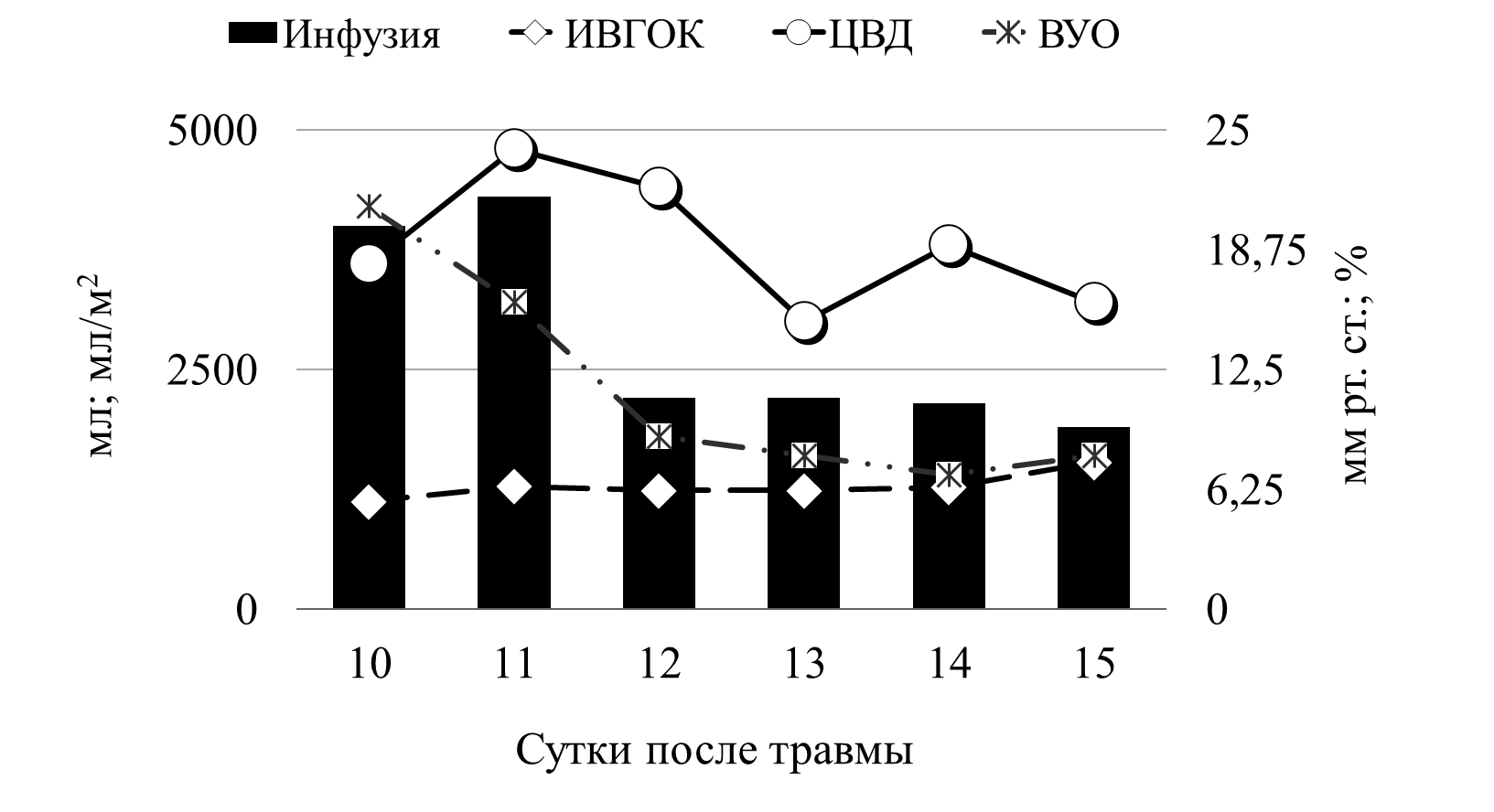
Рис. 7 Инфузионная терапия
Дополненный исследованием интерлейкинов стандартный скрининг маркеров воспаления в сочетании с расширенным гемодинамическим мониторингом способствовали своевременному проведению патогенетической терапии с учетом индивидуальных характеристик гемодинамического профиля у пациента с тяжелой черепно-мозговой травмой, осложненной септическим шоком. Проведенная терапия обеспечила адекватную церебральную перфузию, без ущерба для микроциркуляции во внутренних органах, что позволило добиться регресса неврологической симптоматики и избежать развития полиорганной недостаточности.
Клиническое руководство по черепно-мозговой травме
С пониманием того, что воспаление может начинаться с причин, не являющихся инфекцией, то, что прежде оставалось неясным в определении сепсиса и септицемии, было выделено в термин «Синдром Системного Воспалительного Ответа
Рис. 28-1. Взаимоотношение инфекции, сепсиса, и синдрома системной воспалительной реакции (ССВО)
Создание нового термина ССВО подчеркнуло фундаментальные наблюдения, сделанные относительно воспалительного процесса. Первое — то, что нарушение функций воспалительного характера является реакцией на основной стимул (таких как инфекция или травма) и что поиск этой причины является частью оценки пациента. Второе наблюдение — то, что воспалительная реакция является системной, и воздействует почти на каждый орган опосредовано через сосудистый эндотелий, лейкоциты и моноциты. И наконец, воспалительная реакция стимулирует выработку медиаторов с широким спектром специфических биологических эффектов, заканчивающихся клиническими признаками синдрома [6] различной степени выраженности и тяжести.
Инфекция Микробный феномен, характеризующийся воспалительным ответом на присутствие микроорганизмов или ивазию стерильной в норме ткани этими микроорганизмами.
Бактериемия Наличие живых микроорганизмов в крови. Наличие вирусов, грибов, паразитов и др. в крови следует описывать в подобном же стиле (виремия, фунгемия, паразитемия и т.д.)
Синдром системного Обширная воспалительная реакция с разнообразием клинических ответов. воспалительного ответа Признаки: (ССВО) Температура >38е С или 90 ударов/мин Частота дыхания = 20 в мин Лейкоцитоз = 12,000 клеток/ттЗ; 10 % band forms.
Сепсис Системный ответ на инфекцию. Присутствуют все клинические признаки ССВО при условии наличия инфекции.
Тяжёлый сепсис Сепсис в сочетании с органной недостаточностью, гиполерфузией в результате лактоацидоза, олигоурии, или острые ментальные нарушения, или сепсис -индуцированная гипотензия, и др.
Септический шок Сепсис-индуцированная гипотензия, рефрактерная к инфузионной терапии в сочетании с гипоперфузионными нарушениями или дисфункцией органов.
Сепсис-индуцированная Систолическое АД 40 mm Hg от нормального гипотензия уровня, при условии отсутствия других причин снижения АД.
Клиническое руководство по черепно-мозговой травме
жание гомеостаза становилось невозможным. Также были включены первичное и вторичное подо-пределения для дифференцировки, вызвана ли дисфункция органа прямым результатом четко определённых первичных повреждающих факторов (типа пневмонии) или следствием реакции организма — вторичных повреждающих факторов (например, острого респираторного дистресс-синдрома в результате перитонита (см. табл. 28-2).
Таблица 28-2 Определение полиорганной недостаточости
Полиорганная Наличие изменения функции органе достаточ ость на у остро заболевшего пациента, до такой степени, что поддержание гомеостаза невозможно без постороннего вмешательства. Синдром полиорганной недостаточности также классифицируется на первичный и вторичный:
• Первичный СПОН является результатом травмы того органа, нарушение функции которого возникает в первую очередь, и может быть напрямую с ней связано.
• Вторичный СПОН — нарушение функции органа не в результате самого повреждения, а как следствие ответа макроорганизма.
Было достаточно сложно определить реальную встречаемость сепсиса и его осложнений. Трудность заключалась в недостатке ясных и точных определений данного процесса, а также форм и способов сообщения об этом. В 1990 г. Центр по Контролю за Болезнями Соединенных Штатов (CDC) сообщил о встречаемости сепсиса в стационарах за период с 1979 по 1987 годы. Распространенность патологий за этот период, увеличилась с 73.6 до 175.9 на 100,000 человек, что составило прирост на 139 %. Однако, в результате неточности определения, использованного в этом сообщении, истинная встречаемость сепсиса была недооценена, так как в исследование не были учтены пациенты с клинической картиной сепсиса и отрицательными результатами посевов. По оценкам, в Соединенных Штатах, количество случаев сепсиса составляет приблизительно от 450,000 до 500,000
Факторы, которые, возможна, лежали в основе увеличения встречаемости сепсиса в течение этого периода, были отнесены к следующим группам: 1) возросшее использование агрессивной химиотерапии у онкологических пациентов вместе с более частым применением иммуносупрессивных препаратов в трансплантологии, ревматологии (системная красная волчанка, ревматоидный артрит) и в лечении сосудистых заболеваний (гранулема-тоз Вегенера, синдром Гудпастур, полиартрит); 2) увеличение продолжительности жизни иммуносупрессивных пациентов, составляющих группу риска по инфекции; 3) неадекватная антибиотикотера-пия и антибиотикопрофилактика; 4) возросшее использование хронических внутрисосудистых устройств и протезов; 5) повышение квалификации врачей и их способности диагностировать сепсис.
Патогенез сепсиса сложен, однако, наше понимание воспалительного каскада резко возросло за последние 2 десятилетия из-за беспрецедентного увеличения количества исследований на животных и у человека, направленных на изучение патофизиологии этого синдрома [11J. Важно помнить, что воспалительная реакция организма при инфекции не уникальна и может встречаться при других состояниях, таких как травма, панкреатит и ожоги.
28.3.1. Пусковые механизмы
Пусковым механизмом сепсиса является высвобождение грамм отрицательными бактериями эндотоксина, или ему подобного вещества (см. рис. 28-2) типа энтеротоксина, токсина-1 токсического шока, липоотеихоевои кислоты и пептидогликанов грамм положительных бактерий, вирусных частиц и грибковых антигенов. Наиболее исследованным пусковым фактором являлся эндотоксин — липополи-сахарид (LPS) который находится во внешней мембране всех грамм-отрицательных бактерий. Он
Рис. 28-2. Пути гуморальной активации при сепсисе
состоит из двух ядер — липидного (липид А) и полисахаридного, которые связаны с О-полисаха-ридной цепью. Эта О-полисахаридная цепь состоит из повторяющихся молекул сахара (разные у разных грамм-отрицательных бактерий).
Эндотоксин при попадании в кровь вызывает выброс эндогенных веществ, типа интерлейкинов и других полипептидов и пепидов факторов роста, как локально, так и на системном уровне. Эти эндогенные продукты вырабатываются лейкоцитами, эндотелиальными клетками, В-лимфоцитами, моноцитами/макрофагами, клетками-киллерами, фибробластами, клетками гладкой мускулатуры, эпителиальными клетками, гепатоцитами, керати-ноцитами и глиальными клетками. Эти клетки упомянуты в связи с важной ролью цитокинов в воспалении.
Цитокины присоединяются к определенным рецепторам на поверхности клеток-мишеней. Эти рецепторы связаны с внутриклеточным проведением сигнала и путями вторичных мессенджеров. Например, липополисахарид активирует митоген-
Клиническое руководство по черепно-мозговой травме
активную протеинкиназу (МАПК) и ядерный фактор регуляции транскрипции кВ фактора (ЯФРТкВ). Это, в свою очередь, активирует специфические гены для выработки цитокинов или других медиаторов воспаления.
Данный баланс необходим в попытке сдержать токсическую защитную реакцию макроорганизма на участке инфекции, таким образом ограничивая повреждение здоровых тканей. Бесконтрольная активация воспалительного каскада может кончится повреждением ткани и, возможно, даже гибелью макроорганизма. Поэтому, цитокины могут также классифицироваться на провоспалительные, противовоспалительный и двуэффектные. Примером подобной регуляции может служить Фактор стимулирующий гранулоциты (G-CSF), который, с одной стороны, является провоспалительным ци-токином (увеличивает производство нейтрофилов), а с другой — противовоспалительным цитокином (он уменьшает дальнейшее производство фактора некроза опухоли (TNF-a), главного провоспали-тельного цитокина). Другим примером может служить — простагландин Е2 (PGE2), который является про-воспалительным медиатором. Однако он также ингибирует выработку провоспалительных цитокинов TNF-A и IL-1 макрофагами и моноцитами.
Цитокины вырабатываются и накапливаются клетками несколькими способами. Их высвобождение зависит от типа и силы полученных стимулов. Синтез, накопление и хранение цитокинов в клетках осуществляется следующими способами: 1) синтезируется как часть комплекса, необходимого для поддержания гематопоэза (M-CSF, G-CSF, S-CF, IL-6, ЕРО); 2) пресинтезируется и запасется в эндоплазматических гранулах (GM-CSF, TGF-B, PF4, PDGF) для высвобождения только в случае соответствующего индуцирования клетки; 3) синтезируется и транспортируется к мем-
бране клетки для самостоятельного образования поверхности или включения в сложный комплекс её обязательной белковой системы (TNF-a, IL-1/3, EGF, TGF-a); 4) формируют часть внеклеточного матрикса (TGF-/3, MIP-1B, IL-8); или, 5) синтезируются как ответ-реакция на инфекционные агенты, антигены, тромбоцит активирующие факторы или комплемент ( IL -1, TNF, INF-y).
В результате высвобождения бактерией, липопо-лисахарид или другое активное пусковое вещество, становятся наиболее доступным моноцитам и макрофагам, клеткам, ответственным за пуск воспалительного каскада. Липополисахарид связывается с лип о полисахарид-комплиментарным протеином, синтезированным в печени. Этот липополисахарид-но-ЛПСК-белковый комплекс связывается в свою очередь с CD14 мембранным рецептором, глюко-зилфосфо-инозитольным ( Gpi ) рецептором лейкоцитов макроорганизма 112]. Это соединение усиливает эффект на клетки-мишени (моноциты или макрофаги), посредством триггерного пуска систем вторичных мессенджеров, которые, в свою очередь, стимулирует выработку цитокинов TNF-a, IL-1 и IL -6. Альтернативный путь: липополисахаридно-ЛПСК-белковый комплекс может связываться с растворимыми CD-14 молекулами, что выражается в активации систем комплемента. В дополнение к выработке этих цитокинов, данное взаимодействие также ведет к производству метаболитов арахидо-новой кислоты, увеличению экспресси интегринов, активации кининовой системы и выработке оксида азота (см. ниже).
Двумя важными цитокинами в процессе запуска и поддержания воспаления являются TNF-a и IL-1. TN F-a в первую очередь вырабатывается моноцитами и макрофагами в ответ на воздействие ЛПС, или других цитокинов. TNF-a получается в результате распада под воздействием фермента металло-протеазы, высвобождающей более мелкий растворимый белок, из промолекулы — npo-TNF-a, которая находится в мембранах лейкоцитов [13]. Однако, биологическая активность TNF-a зависит от формирования гомотриметричных комплексов из 3 мономеров зрелых TNF-a молекул. Эти гомотри-метричные комплексы могут связыватся с одним из двух типов рецепторов на мембранах клетки (тип I-TN F или тип I1-TNF рецепторы (TN FR)). Тип I TNFR ответственен за модуляцию большинства из ЛПС-индуцированной активности TNF-a's. В результате активации этого рецептора, возникает усиление клинической картины сепсиса. Тип II TNFR играет важную роль в опосредованной TNF-a цитотоксич-ности [14][15].
TNF-a также ответственен за стимуляцию выработки других цитокинов раннего ответа, таких как IL-1, мощного фактора хемотаксиса нейтро-филов — цитокина IL-8, IL-6, который стимулирует реактивные белки острой стадии (С реактивный белок, ферритин), и активизирует индуцируемую NO-синтазу (iNOS), для выработки оксида азота (см. ниже). Другие эффекты TNF-a включают в себя активацию метаболизма арахидоновой кислоты с выработкой простагландинов и лейкотрие-нов, и увеличивают образование микротромбов в результате триггерного воздействия на свёртывающую систему, что приводит к диссеминированно-му внутрисосудистому свёртыванию (ДВС-синд-ром) в результате активации тканевого фактора (TF) и фактора XII. TNF-a также является эндогенным пирогеном и ответственен за катаболичес-кую фазу сепсиса.
Как и TNF-a, IL-1Б является мощным индуктором вторичных медиаторов сепсиса. Однако в течение воспалительного процесса он стимулирует не только их выработку, но свою собственную. IL-1Б
также стимулирует выработку других важных веществ, таких как IL-8 и хемотактического протеина-1 моноцитов (МСР-1), которые являются мощным хемоаттрактантами нейтрофилов и моноцитов (табл. 28-3). Про-воспалительная деятельность продолжает вести процесс воспаления посредством: 1) увеличения выработки и секреции IL-2, который стимулирует быстрое увеличение количества Т-лимфоцитов; 2) увеличения выработки IL-6; и, 3) стимулирования выработки факторов формирования гранулоцитов и активирования свертывающего каскада внешними путями.
Таблица 28-3 Хемотаксические факторы воспаления
Источник: Bcllingan, G. Inflammatory cell activation in sepsis. British Medical Bulletin (1999) vol 55 (1): 21.
Коллаген 1 типа и фибронектин протеолиттические фрагменты являются специфическими хемоатрактанта-ми макрофагов
Подобно TNF-a, IL-1 также стимулирует выработку метаболитов арахидоновой кислоты и опосредует экспрессию интегринов на лейкоциты и паренхиматозные клетки, что является важным шагом в цикле полиморфноядерных лекоцитов. IL-1 также стимулирует выработку окисида азота. Другие известные эффекты IL-1 включают в себя: индукцию гипертермии, сна, анорексии и выброс нейропептидов в мозге.
28.3.2. Эффекты на сосудистый эндотелий и кровь
Перед тем, как пытаться понять какое влияние оказывается на сосудистый эндотелий и кровь, и какое участие они принимают в сепсисе, сначала
Клиническое руководство по черепно-мозговой травме
необходимо представить то, что происходит в мик-роциркуляторном русле в зоне ограниченного очага инфекции. Воспалительная реакция макроорганизма на инфекцию является нормальной. В попытке борьбы и локализации инфекции, первично моноциты и макрофаги высвобождают цитокины (TNF-a, IL-1) приводя в готовность окружающие клетки, включая сосудистый эндотелий на участке развивающейся инфекции. Хемотаксическая передача сигналов (IL-8, С-5а, лейкотриен LTB2, и бактериально выработанные факторы, такие как М-формил-Ь-метионил-фенилаланин) активизирует лейкоциты в окружающих тканях и в крови, привлекая их к участку инфекции.
Абсцесс головного мозга — ограниченное гнойное расплавление вещества мозга т. е. очаговое скопление гноя в веществе мозга.
Причина — попадание стрептококков, стафилококков, пневмококков, реже других микробов в мозговое вещество из гнойных очагов, расположенных в среднем или внутреннем ухе (отогенные абсцессы), придаточных пазухах (риногенные абсцессы), из остеомиелитического очага в костях черепа, флегмоны мягких тканей головы. Т. е. необходим источник инфекции. Главным источником инфекции служат отиты, чаще хронические (около 70% всех абсцессов мозга). У новорожденных могут быть инфекции верхних дыхательных путей матери, обусловлены сепсисом новорожденных, пупочной инфекцией, пневмонией.
Инфекция распространяется из среднего и внутреннего уха двумя путями: по контакту через твердую и мягкую мозговые оболочки или через лимфатические и кровеносные пути. В 16-24% случаев абсцесс возникает в результате бактериальной микроэмболии по кровеносным сосудам (метастатические абсцессы). Основным источником метастазирования являются легкие (абсцедирующие пневмонии, эмпиема, бронхо-эктатическая болезнь, абсцесс легких), реже язвенный бактериальный эндокардит. Бактериальные эмболы могут также попасть через капиллярную сеть легких при пиодермии, флегмонах, остеомиелите трубчатых костей, актиномикозе. Определенную роль играет черепно-мозговая травма, особенно сопровождающаяся переломами или трещинами костей основания черепа, открывая входные ворота для инфекции. Абсцесс головного мозга является частым осложнением сквозного или слепого огнестрельного ранения. Мальчики болеют в 2 раза чаще, чем девочки.
- Начальный период — реакция организма на внедрение в мозговую ткань инфекции — общее недомогание, вялость, снижение аппетита, повышается температура (от субфибрильных цифр — 37.2 — 37.4 и выше), интенсивная головная боль, рвота, высокая температура, менингеальные знаки (боли в шейно- затылочном отделе позвоночника, не возможность достать подбородком до грудной клетки).
Изменения в анализе крови — полинуклеарный лейкоцитоз, повышенная СОЭ, умеренный плеоцитоз в цереброспинальной жидкости. - Латентный период — при высокой вирулентности возбудителя происходит расплавление мозговой ткани и вокруг образовавшейся полости, наполненной гноем, постепенно формируется капсула абсцесса, ограничивая гнойный процесс (через 4-6 нед), состояние больного улучшается, ребенок становится более активным, исчезают жалобы.
- Манифестная стадия — клинически явная стадия, к выходу в нее способствуют ряд факторов: легкая травма, например головы, различные острые заболевания, например ОРЗ, ОРВИ и т. д.
- Крайняя стадия — терминальный период — летальность около 1/3 больных. Особенно при множественных абсцессах мозга, когда идет распространение на ликворную систему и оболочки мозга (дети 3 – 4 лет).
Клинически, можно выделить несколько групп симптомов при абсцессе головного мозга:
1. Воспалительные, что описаны выше.
2. Симптомы повышения внутричерепного давления у детей, особенно 5-7 лет — быстрое увеличение размеров черепа, за счет чего длительно отсутствуют головные боли. На рентгене черепа видно расхождение швов (коронарного, сагиттального, более выраженные пальцевые вдавления), в итоге, сильные головные боли и рвота, частая и многократная.
3. Очаговые симптомы, зависят от локализации абсцесса. Например, он располагается в больших полушариях — возникают двигательные расстройства и судорожные припадки. Иногда судорожные припадки могут быть одним из первых проявлений данного заболевания, особенно у мальньких детей.
Для диагностики используют: компьютерную, магнитно-резонансную томографию, церебральную ангиографию.
Дифференцированная диагностика абсцесса мозга с очаговым менингоэнцефалитом или менингитом, при этом решающую роль играют данные эхоэнцефалографии (смещение срединных структур мозга при супратенториальном абсцессе) и компьютерная томография. Последняя позволяет отличить абсцесс от опухоли мозга.
Существуют различные способы лечения абцесса головного мозга:
- Метод Спасокукоцкого-Бакулева заключается в повторных пункциях (от 2 до 13) с отсасыванием гноя и введением в полость абсцесса антибиотиков и дезинфицирующих веществ. Практически нет противопоказаний, нет необходимости удалять рубцово-сморщенную капсулу при выздоровлении, у меленьких детей пунктировать можно через не заращенный родничок, или разошедшийся шов. Не эффективно, лишь при многокамерных и множественных абсцессах.
- Метод Н. Н. Бурденко — удаление абсцесса вместе с хорошо сформировавшейся капсулой. Применяют у детей среднего и старшего возраста.
- Наиболее старым является метод широкого вскрытия и последующего дренирования абсцесса. Когда используют эластический катетер, через который периодически промывают и вводят в полость антибактериальные средства.
До и после операции необходимо назначать массивные дозы антибиотиков.
При одиночных абсцессах после операции выздоровление наступает в 70-80% случаев.
Полный текст:
1. Политравма: травматическая болезнь, дисфункция иммунной системы, современная стратегия лечения / под ред. Е. К. Гуманенко и В. К. Козлова. - М.: ГЭОЕФЗ-Медиа, 2008. - 608 с.
2. Полушин Ю. С., Афанасьев А. А., Пивоварова Л. П. и др. Секреторный иммуноглобулин А (sIgA) как маркёр бактериальной транслокации при тяжёлой сочетанной травме // Вестник анестезиол. и реаниматол. - 2014. - № 6. - С. 51-58.
3. Bistrian B. R. Acute phase proteins and the systemic inflammatory response // Crit. Care Med. - 1999. - Vol. 27, № 3. - P. 452-453.
4. Dandona P., Nix D., Wilson M. F. Procalcitonin increase after endotoxin injection in normal subjects // J. Clin. Endocrinol. Metab. - 1994. - Vol. 79, № 6. - P. 1605-1608.
5. Giannoudis P., Smith R. M., Evans R. T. Serum CRP and IL-6 levels after trauma: not predictive of septic complications // Acta Orthop. Scand. - 1998. - № 69. - Р. 184-188.
6. Karzai W., Oberhoffer M., Meier-Hellmann A. et al. Procalcitonin - a new indicator of systemic response to severe infection // Infection. - 1997. - Vol. 25. № 6. - P. 329-334.
7. Le J., Vilcek J. Interleukin-6: a multifunctional cytokine regulating immune reactions and the acute phase protein response // Lab. Invest. - 1989. - № 61. - Р. 588-602.
8. Meisner M., Adina H., Schmidt J. Correlation of procalcitonin and C-reactive protein to inflammation, complications and outcome during the intensive care unit course of multiple-trauma patients // Crit. Care. - 2006. - Vol. 10, № 1. - Р. 1.
9. Oberhoffer M., Bigel D., Meier-Hellmann A. Procalcitonin is immunological markers in infection inflammation // Brit. J. Anaesth. - 1996. - Vol. 76. - Р. 352.
10. Nylen E. S., Snider R. H., Thompson K. A. Pneumonitis-associated hyperprocalcitoninemia // Amer. J. Med. Sci. - 1996. - Vol. 312, № 1. - P. 12-18.
11. Pierre E., Sylvain L., Serge A. Serum PCT elevation in critically ill patients at the onset of bacteremia caused by either gram-negative or gram-positive bacteria // BMC. Infect. Dis. -2008. - Vol. 8. - P. 38-39.
12. Quenot J.-P., Luyt C.-E., Roche N. et al. Role of biomarkers in the management of antibiotic therapy: an expert panel review II: clinical use of biomarkers for initiation or discontinuation of antibiotic therapy // An. Intens. Care. - 2013. - № 3. - P. 21.
13. Russwurms S., Wiederhold W., Oberhoffer M. et al. Procalcitonin as monocyte marker for early diagnosis in septic abortus [in German] // Z. Geburtsh Neonatol. - 1999. - № 14. - P. 29-33.
14. Schuetz Р., Matthias B., Christ-Crain M. et al. Procalcitonin to guide initiation and duration of antibiotic treatment in acute respiratory infections: an individual patient data meta-analysis // Clin. Infect. Dis. - 2012. - № 55. - P. 651-662.
15. Schuetzn P., Maurer P., Punjabi V. et al. Procalcitonin decrease over 72 hours in US critical care units predicts fatal outcome in sepsis patients // Crit. Care. - 2013. - № 17. - P. 115.
16. Soni N., Samson D., Galaydick J. L. Procalcitonin-guided antibiotic therapy: a systematic review and meta-analysis // J. Hosp. Med. - 2013. - № 9. - Р. 530-540.
17. Wicher J., Bienvenu J., Monneret G. Procalcitonin as an acute phase marker // Ann. Clin. Biochem. - 2001. - Vol. 38. - P. 483-493.
18. Uzzan B., Cohen R., Nicolas P. Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma: a systematic review and meta-analysis // Crit. Care Med. - 2006. - Vol. 34, № 7.
19. Zelzer S., Aigner R. M., Khoschsorur G. et al. Comparative study of the immunological marker IL-6 and the non-immunological marker PCT in surgery patients with infections and multiple trauma // Open Pathol. J. - 2009. - № 3. - P. 124-130.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Читайте также:


