Основными элементами морфологических изменений при бруцеллезе являются
Карантинные инфекции
Карантинные инфекции: (1)
Карантинные инфекции
Лекция курса патологической анатомии профессора В.Г. Шлопова
Бруцеллез - инфекционное заболевание, передающееся от больных животных человеку и характеризующееся длительным течением, поражением нервной и сердечно-сосудистой систем, а также костно-суставного аппарата. Клинически бруцеллез может протекать остро, подостро и хронически.
Возбудителем бруцеллеза является группа Brucella , названные по имени Д. Брюса, нашедшего в 1866 г. в козьем молоке бактерии, которые были причиной мальтийской лихорадки у коз и овец (Brucella melitensis), или козье-овечий тип бруцеллы. Кроме этого типа, имеются еще два: Brucella abortus (возбудитель аборта у коров) и Brucella suis (возбудитель аборта свиней). Все три типа бруцелл патогенны для человека. Козье-овечий тип бруцелл приводит нередко к развитию эпидемий.
Бруцеллы представляют собой бактерии, которые хорошо переносят низкие температуры и замораживание, в воде сохраняются до 5 месяцев, в почве - 3 месяца и более, в коровьем молоке - до 45 дней, в брынзе - до 60 дней, в масле, сливках, простокваше, свежих сырах - в течение всего периода их пищевой ценности; в замороженном мясе - до 5 месяцев, в засоленных шкурах - 2 месяца, в шерсти - до 3 - 4 месяцев. При кипячении и пастеризации молока бруцеллы погибают. Дезинфицирующие средства убивают бактерии в течение нескольких минут.
Наиболее часто болеют домашние животные (козы, овцы, коровы, свиньи), при этом у них наблюдаются аборты и рождение мертвого плода. Бруцеллы выделяются в окружающую среду с молоком, мочой больных животных и отделяемым матки (во время аборта). Возбудители бруцеллёза содержатся также в мясе больных животных.
Человек заражается при употреблении сырого молока от больных животных и приготовленных из него продуктов (сыр, масло, творог, брынза), а также недостаточно проваренного и прожаренного мяса. Заражение может произойти и на производстве, где обрабатывают кожу и шерсть, а также при уходе за больными животными и через предметы, зараженные их выделениями. Возбудители бруцеллёза могут проникать в организм человека через верхние дыхательные пути с пылевыми частицами или через поврежденную кожу. Чаще болеют доярки, телятницы, пастухи, зоотехники.
Инкубационный период составляет обычно 1-3 недели. Бруцеллёз характеризуется многообразием клинических симптомов. Чаще начинается остро: температура повышается до 39-40њ, появляются озноб, слабость, обильное потоотделение, резкие боли в мышцах и суставах, характерно поражение нервной системы и костно-суставного аппарата, кровеносных сосудов, могут быть психические расстройства. Реже заболевание начинается постепенно: появляются недомогание, бессонница, раздражительность, головная боль, боли в мышцах и суставах, снижается аппетит, температура повышается до 37,1њ-37,3њС.
Патогенез
В месте внедрения бруцеллы существенных изменений обычно не наблюдается. Основные проявления болезни возникают лишь после лимфогенной диссеминации бруцелл. Они размножаются прежде всего в регионарных лимфатических узлах, где образуются инфекционные гранулемы, напоминающие туберкулезные. При дальнейшей генерализации инфекции возможно поражение многих лимфатических узлов, селезенки, печени, яичек, их придатков, костно-суставной системы (остеопериоститы, остеомиелиты, артриты крупных суставов). Характерно, кроме того, поражение сердечно-сосудистой системы (тромбофлебиты, энд- и периартерииты, эндокардит, перикардит). Описываются поражения почек в виде интерстициального нефрита. При длительном течении болезни возможно поражение ЦНС с образованием периваскулярных инфильтратов и гранулем. Болезнь иногда затягивается до 1-2 лет и более. Стойкие остаточные явления могут привести к инвалидности, у беременных женщин при бруцеллёзе возможен самопроизвольный аборт.
Морфология бруцеллеза
Различают три стадии течения бруцеллеза:
Острая стадия характеризуется острым началом и септическим течением от 1 до 2 месяцев. Для нее характерна гиперергическая реакция в ответ на генерализацию инфекции. Происходит увеличение селезенки, печени, лимфатических узлов в связи с гиперплазией лимфоидных и эндотелиальных элементов, пролиферативными васкулитами с тромбозом и явлениями ДВС-синдрома. Развивается геморрагический диатез. В паренхиматозных органах появляются дистрофические изменения и серозное воспаление.
При подострой стадии (3-4-й месяцы болезни) преобладают реакции гиперчувствительности замедленного типа, в различных органах появляются бруцеллезные гранулемы. Эти гранулемы сформированы макрофагами (эпителиоидными клетками), гигантскими клетками типа Пирогова-Лангханса и небольшим количеством плазматических клеток и эозинофилов. В бруцеллезной гранулеме, в отличие от туберкулезной, много сосудов, эпителиоидные клетки располагаются без определенного порядка. Гранулемы обычно не подвергаются некрозу. Помимо гранулематоза, для этой стадии характерно развитие системного продуктивно-деструктивного васкулита. Соответственно во внутренних органах возникают сосудистые повреждения. Чаще всего поражаются печень (гепатит), сердце (полипозно-язвенный эндокардит, продуктивный миокардит), головной мозг и его оболочки (энцефаломиелит, экссудативно-продуктивный менингит), почки (гломерулонефрит). В селезенке, как правило, отмечаются гиперплазия пульпы и образование гранулем.
Хроническая стадия характерна для длительного (более года) течения болезни. В основе ее лежит пролиферативное воспаление, образование гранулем, васкулиты, дистрофия, атрофия и склероз паренхиматозных органов. Хронический бруцеллез протекает как затяжной сепсис и сопровождается развитием кахексии.
Различают несколько клинико-морфологических форм хронического бруцеллеза:
- сердечно-сосудистую;
- нейробруцеллез;
- гепатолиенальную;
- урогенитальную;
- костно-суставную.
При сердечно-сосудистой форме развивается полипозно-язвен- ный эндокардит аортальных клапанов, напоминающий изменения при бактериальном (затяжном септическом) эндокардите. С клапанных наложений высевают бруцеллы. Эндокардит сочетается с продуктивным миокардитом. В строме миокарда появляются гранулемы, а в разветвлениях венечных артерий - продуктивное воспаление, тромбоз (тромбоваскулит). При длительном течении развиваются аортальный порок сердца, кардиосклероз.
Нейробруцеллез характеризуется менингоэнцефалитом, в основе которого лежит продуктивно-деструктивный васкулит с глиальной реакцией. В тех случаях, когда присоединяется тромбоз сосудов, появляются очаги размягчения мозга, кровоизлияния, кисты.
При гепатолиенальной форме преобладают изменения печени и селезенки с исходом в цирроз печени и спленомегалию, которые сопровождаются желтухой и геморрагическим диатезом.
Для урогенитальной формы характерно развитие специфического орхита и эпидидимита с исходом в атрофию яичек и их придатков (бруцеллезные оофориты наблюдаются редко).
При костно-суставной форме гранулематозный процесс преобладает в мышцах, сухожилиях, апоневрозах, в капсуле и синовиальной оболочке суставов, в костном мозге. Развиваются остеомиелит трубчатых и плоских костей, периоститы и артриты с деструкцией костей и суставов. Возможна и смешанная форма хронического бруцеллеза.
Смерть в острой стадии бруцеллеза может наступить от сепсиса. В подострой и хронической стадиях она обусловлена полиорганной недостаточностью.
Бруцеллез
Бруцеллез — хроническое инфекционное заболевание, относящееся к антропозоонозам, сопровождающееся поражением ретикуло-гистиоцитарной, сердечно-сосудистой и других систем, вовлечением в патологический процесс полового аппарата с последующим абортом у беременных коров.
Этиология. Возбудитель — Br. abortus, маленькие грамотрицательные микроорганизмы шаровидной, овоидной или палочковидной формы, являющиеся факультативными внутриклеточными паразитами, Основной источник инфекции — больное животное, которое выделяет бруцелл при аборте, во время родов с плодом, последом и плодными водами, а после аборта — с истечениями из родовых путей, с мочой, молоком.
Бруцеллы, попадая в организм алиментарным путем или через кожные и слизистые покровы, с током лимфы проникают в регионарные лимфатические узлы, обусловливая развитие в них воспалительно-гиперпластических изменений. Организм крупного рогатого скота, зараженного бруцеллами, отвечает фагоцитозом последних, образованием специфических антител и аллергической перестройкой. Через 3—4 нед. после заражения происходит генерализация патологического процесса, в пораженных органах и тканях формируются специфические бруцеллезные гранулемы. Спустя 1,5—2 мес болезнь переходит в латентную форму с локализацией бруцелл в молочной железе или в отдельных лимфатических узлах. Наиболее благоприятную среду для размножения бруцеллы находят в беременной матке, вызывая эндометрит. Воспалительно-некротические изменения в беременной матке, как частное проявление генерализованного бруцеллезного процесса, приводят к глубокому нарушению естественной связи между материнской частью последа и оболочками плода, к нарушению его питания, гибели и последующему аборту. Причем бруцеллезные аборты у крупного рогатого скота могут быть как у инфицированных во время беременности, так и у зараженных животных до ее наступления. В результате длительного воспалительного процесса в матке происходит разрастание грануляционной ткани между плодными оболочками и карункулами. Это создает более прочную, чем в норме, связь между ними и служит причиной частого задержания последа.
С первых же дней после заражения, а также после аборта и в ряде случаев во время беременности наблюдается бактериемия, бруцеллезный процесс приобретает генерализованный характер и морфологически выражается в общем инфекционном ретикуло-эндотелиозе. Постоянным является также распространенный инфекционно-аллергический васкулит. Поражение сосудов — исходный пункт органопатологии бруцеллеза, и одно из центральных мест при этом занимают нарушения проницаемости капилляров. Повышение проницаемости капиллярной стенки свидетельствует об активности процесса, протекающего в ряде случаев и при отсутствии явных клинических симптомов бруцеллеза. Основной причиной циркуляторных расстройств при бруцеллезе является отложение в стенке сосудов комплементарно связанных иммунных комплексов антиген — антитело.
Клинические признаки.
Бруцеллез как динамически развивающийся инфекционный процесс характеризуется сменой определенных фаз и стадий болезни. Проявляются они более или менее выраженными клиническими и морфологическими изменениями и зависят от ряда факторов, различных по своей природе. В основу правильного толкования клинических проявлений бруцеллеза должны быть положены современные представления об этиопатогенетических особенностях болезни с учетом комплексного влияния двух главных факторов: инфекционного (возбудитель) и аллергического. В ранней фазе заболевания отмечают повышение температуры тела, угнетение общего состояния и увеличение размеров доступных клиническому исследованию лимфатических узлов.
Первым показателем развивающегося инфекционного процесса служит появление в крови инфицированных животных агглютининов в нарастающих титрах. У отдельных животных наблюдается связанность движений, повышение болевой чувствительности в области спины и поясницы, так называемая беспричинная хромота на ту или иную конечность при отсутствии к этому каких-либо иных показаний. Хромота у больных животных может быть вследствие поражения суставов, воспаления суставных сумок и сухожильных влагалищ. У самцов часто встречаются орхиты, эпидидимиты, бурситы слизистых сумок конечностей и др. Однако основными и более частыми клиническими симптомами бруцеллеза являются аборты на 5—8-м мес беременности и осложнения после аборта. Повторные аборты у коров возможны при более ранней беременности. Клинически выраженными осложнениями после аборта являются задержание последа, катаральный или катарально-гнойный эндометриты, интерстициальный или гнойный мастит. У некоторых больных животных те или другие симптомы обнаруживают одновременно. У абортировавших коров в крови резко повышается титр агглютининов (1:3000 и выше).
Патологоанатомические изменения наиболее характерные встречаются в матке беременных животных. Первичный патологический процесс возникает в беременной матке задолго до аборта, вызывается действием специфического возбудителя и достигает максимального развития ко времени изгнания недоношенного плода из матки и в ранний период после бруцеллезного аборта. Проявляется он в форме резко выраженных воспалительно-некротических изменений и обнаруживается как в самой матке, так и в плодных оболочках. За несколько дней до аборта наружные половые органы и слизистая влагалища набухшие, гиперемированы, покрыты серовато-красноватыми тягучими наложениями. Матка увеличенная и дряблая, слизистая оболочка ее утолщена, в состоянии гнойно-катарального (нередко язвенного) воспаления. Между слизистой оболочкой матки и хорионом, как правило, скапливается серовато-грязного цвета экссудат с хлопьями фибрина или крошковатые массы. Карункулы матки сильно увеличены, пронизаны точечными и полосчатыми кровоизлияниями (цв. табл. IV—Б).

Табл. IV. Б — кровоизлияния в карункулах при бруцеллезе.
Некоторые из них срастаются с плодными оболочками. Ворсинчатая часть хориона утолщена, отечна, усеяна точечными кровоизлияниями, покрыта тягучим, грязно-желтовато-коричневого цвета налетом, ее ворсинки укорочены и утолщены за счет разрастания грануляционной ткани. В зависимости от тяжести процесса патологоанатомические изменения могут варьировать от фибринозно-гнойного до гнойно-некротического воспаления плаценты.
После аборта воспалительные изменения в матке не исчезают в течение длительного времени, что приводит к развитию склероза ее слизистой оболочки и стенок сосудов. В этот процесс вовлекаются также яичники и фаллопиевы трубы. В конечном итоге все это обусловливает бесплодие коров.
У абортированного плода отмечают изменения, свойственные септическому процессу. Подкожная и межмышечная соединительная ткань его инфильтрирована серозно-геморрагическим экссудатом, пупочный канатик утолщен, нередко содержит гноеподобную массу. Брюшина, плевра, несколько реже перикард отечны, очагово покрасневшие, усеяны точечными кровоизлияниями, покрыты фибринозным налетом. Из-за попадания инфицированных околоплодных вод в желудочно-кишечный тракт развивается катаральный гастроэнтерит. Слизистая сычуга и тонкого отдела кишечника неравномерно гиперемированы, набухшие, пронизаны множественными кровоизлияниями.
Селезенка увеличена в объеме, а лимфатические узлы отечны и с наличием геморрагии. В печени обнаруживают мелкие некротические очаги, окрашенные в желто-красный цвет. В легких многочисленные мелкие пневмонические очаги. При наличии бурситов, гигром отмечают утолщение пораженных суставов, а в полостях их серозный, серозно-фибринозный экссудат.
У быков часто встречаются гнойно-некротические орхиты и эпидидимиты. Семенники сильно увеличены в объеме, плотной консистенции, их оболочки сращены между собой и подкожной клетчаткой. Развивающиеся некротические фокусы, достигающие размера лесного ореха, содержат сухие бледно-желтого цвета крошковатые массы. Наблюдают также гиперемию и отек полового члена с образованием на его поверхности мелких бледно-серых узелков.
Патогистологические изменения. В матке ко времени изгнания недоношенного плода и сразу же после аборта на слизистой оболочке отмечают резко выраженные экссудативно-некротические изменения в сочетании с гиперпластическо-пролиферативной реакцией клеток РЭС, утолщением и гиалинозом стенок крипт в карункулах, а также разрастанием соединительнотканных элементов в хорионе. В дальнейшем воспалительный процесс приобретает более выраженный продуктивный характер, в слизистой оболочке происходит разрастание фибропластических элементов, развиваются гранулемы из мононуклеарных клеток без признаков некроза. При этом чаще наблюдают продуктивные периваскулиты, несколько реже — васкулиты и эндоваскулиты, а в отдельных случаях — тромбоваскулиты. Очаговые инфильтраты лимфоидно-гистиоцитарных клеток, утолщение и гиалиноз стенок кровеносных сосудов обнаруживают также в строме яичников. В интерстициальной ткани молочной железы развиваются очаговые и диффузные воспалительные полиморфноклеточные инфильтраты с примесью плазматических клеток, отдельных полиморфноядерных и эозинофильных лейкоцитов. При паренхиматозном и смешанном мастите проявляются зернистая, а иногда и жировая дистрофия, слущивание и некротические изменения элементов железистой ткани. При угасании иммунологических реакций интенсивность морфологических изменений в вымени снижается, патологический процесс прекращается.
В ранний период заболевания бруцеллезом в печени заметна лишь слабо выраженная реакция со стороны элементов ретикуло-гистиоцитарной системы. Затем, по мере развития патологического процесса в организме, степень выраженности морфологических изменений в печени резко возрастает. В подавляющем большинстве случаев наблюдается пролиферация звездчатых эндотелиоцитов с образованием гранулем из мононуклеарных клеток. При более тяжелых формах болезни, особенно в ранний период после аборта, происходит трансформация последних в эпителиоидные клетки. Так формируются специфические гранулемы, центр которых при обострении процесса подвергается некротическим изменениям, а при затухании — фибротизации.
Изменения в миндалинах и селезенке аналогичны таковым в лимфатических узлах, но в них реже образуются специфические эпителиоидноклеточные гранулемы.
В легких, сердце, почках и в скелетной мускулатуре в основном очаговые инфильтраты имфоидно-гистиоцитарных клеток, размеры и характер дальнейших превращений которых зависят от остроты и тяжести инфекционного процесса.
При остром течении бруцеллеза в надпочечниках и поджелудочной железе выявляют гранулемы из мононуклеарных и эпителиоидных клеток, нередко подвергающихся некробиотическим изменениям.
В головном и спинном мозге и их оболочках довольно часто находят серозный отек периваскулярной ткани, нередко с инфильтрацией их лимфоидно-гистиоцитарными клетками с примесью эозинофилов. В твердой мозговой и спинномозговой оболочках, в эпендиме, под эпендимой боковых желудочков и в корешках спинномозговых нервов выявляют также васкулиты, эндо – и тромбоваскулиты. В спинальных ганглиях, корешках и периферических нервах обнаруживают ганглиорадикулит и полиневрит с преобладанием утолщения, вакуолизации и распада части нервных волокон и аксонов нервных клеток.
Диагноз ставят на основании результатов бактериологических, серологических и аллергических исследований с учетом эпизоотологических данных, клинических признаков и патологоанатомических изменений последа и абортированного плода. Для бактериологического исследования в лабораторию направляют абортированный плод с оболочками или желудок плода с содержимым, а также кусочки печени и селезенки. Серологическая диагностика заключается в обнаружении специфических антител в сыворотке крови животного с помощью реакции агглютинации в пробирках (РА), реакции связывания комплемента (РСК), реакции длительного связывания комплемента на холоде (РДСК), пластинчатой реакции агглютинации с розбенгал антигеном (розбенгал проба — РБП) и в молоке коров — кольцевой реакции (КР).
Дифференциальная диагностика. Характерный для бруцеллеза крупного рогатого скота признак — аборт может быть при вибриозе, листериозе, трихомонозе, хламидиозах, при кормовых отравлениях и др. Изменения плодных оболочек и абортированного плода при указанных болезнях менее выражены, а при гистологическом исследовании “в них отсутствует специфическое гранулематозное воспаление, характерное для бруцеллезной инфекции.

Высокий удельный вес бруцеллезной инфекции в структуре зоонозов, частое развитие хронических рецидивирующих форм болезни, их осложнения, длительная потеря трудоспособности, а иногда и инвалидизация пациентов, социально-экономический ущерб определяют актуальность изучаемой проблемы [1]. Многообразие клинических проявлений свидетельствует о бруцеллезе как о системной патологии [6]. Несмотря на большое количество исследований, посвященных хроническому бруцеллезу (ХБ), целый ряд вопросов, касающихся клиники, патогенеза, диагностики и терапии бруцеллезной инфекции, остаётся открытым.
В патогенезе ХБ большое значение придается эндотоксикозу и системному воспалению, при этом в патологический процесс вовлекаются практически все органы и системы: костно-суставная, сердечно-сосудистая, мочеполовая, нервная, эндокринная [6]. При ХБ описаны случаи тромбоцитопенической пурпуры, узловатой эритемы, тромбоцитарной микроангиопатии, которые сопровождаются соответствующими морфологическими изменениями [9, 10]. Установлено, что нарушения в системе гемостаза являются важным звеном патогенеза многих инфекционных заболеваний. Однако сдвиги в процессах гемокоагуляции при ХБ детально не исследовались, доступные научные работы посвящены изучению общих тестов коагуляции, характеризующих плазменное звено гемостаза [5]. Вместе с тем состояние тромбоцитарного звена гемостаза с анализом агрегационной активности тромбоцитов и реологических свойств крови при ХБ остается практически не изученным.
При ХБ установлено как нарушение церебральной гемодинамики и регионарного кровообращения с повышением тонуса крупных и мелких сосудов, так и поражение центральной и периферической нервной системы с формированием аксональных блоков, протекающих на фоне умеренно выраженного процесса демиелинизации [7]. К настоящему времени в лечении больных с сочетанной патологией нервной системы с нарушениями как сосудистого, так и нейротрофического генеза рекомендуются комплексные препараты, к которым относится, в том числе и инстенон. Установлена способность инстенона восстанавливать нейротрофику, макро- и микроциркуляцию в различных регионах головного мозга и на периферии, корригировать когнитивные нарушения при различных заболеваниях: клещевом энцефалите, боррелиозе, дифтерийной полинейропатии, ювенильном ревматоидном артрите, ишемическом инсульте [4, 8]. Сочетание в одном препарате трех веществ, воздействующих на важнейшие патогенетические механизмы, обосновывает возможность исследования терапевтических эффектов инстенона в лечении больных ХБ.
Цель исследования - оптимизировать методы лечения больных ХБ на основе оценки состояния реологических свойств крови и агрегационной активности тромбоцитов.
Материал и методы исследования
Критериями исключения из исследования были: бруцеллез других клинических форм, острые инфекционные заболевания другой этиологии, обострение тяжелых соматических заболеваний, опухоли любой локализации, диффузные заболевания соединительной ткани, хронический алкоголизм, острая коронарная недостаточность, инфаркт миокарда в анамнезе, эпилепсия, психические и поведенческие расстройства в анамнезе, эрозивно-язвенные поражения желудочно-кишечного тракта, отказ больного от обследования.
Диагноз ХБ устанавливался на основании стандартных клинико-лабораторных, инструментальных и специальных методов исследования (реакция Хеддельсона, реакция Райта, РПГА с бруцеллезным диагностикумом, проба Бюрне, определение нуклеиновых кислот возбудителей бруцеллеза в полимеразной цепной реакции). Форма бруцеллезной инфекции определялась в соответствии с общеизвестными критериями и классификацией Н.Н. Островского и Ю.Ф. Щербака [2].
Результаты исследования и их обсуждение
Общее количество тромбоцитов у больных ХНБ находилось в пределах нормы и существенно не отличалось между 1-й и 2-й группами. Как видно из данных табл. 1, у больных ХНБ наблюдается статистически достоверное увеличение максимальной скорости образования наибольших тромбоцитарных агрегатов, максимальной степени агрегации и максимальной скорости агрегации по сравнению с группой контроля, а также тенденция к увеличению максимального размера образующихся тромбоцитарных агрегатов. При этом существенных различий в показателях агрегации тромбоцитов до начала терапии между 1-й и 2-й группами не было. Представленные данные свидетельствуют о том, что при ХНБ в значительной мере изменяется агрегационная активность тромбоцитов.
При анализе образцов цельной крови больных ХНБ (табл. 2) отмечалось повышение вязкости крови как при больших, так и при малых скоростях сдвига по сравнению с данными группы контроля (показатели вязкости до начала лечения между 1-й и 2-й группами существенно не отличались). Так, вязкость крови достоверно возрастала на скоростях сдвига 200 и 100 с-1, при которых моделируется кровоток в артериях крупного калибра. В наибольшей степени изменения вязкости крови были выражены при малых скоростях сдвига (20, 10 и 5 с-1), что отражало преимущественные нарушения реологических свойств крови в сосудах микроциркуляторного русла.
У больных ХНБ в динамике на фоне лечения отмечалось снижение показателей функциональной активности тромбоцитов. Так, снижались максимальный размер образующихся тромбоцитарных агрегатов и максимальная скорость образования наибольших тромбоцитарных агрегатов. Аналогичные изменения касались одного из важнейших показателей, характеризующего агрегационную активность тромбоцитов - степени агрегации кровяных пластинок. Наиболее выраженное улучшение функциональной активности тромбоцитов выявлено в 1-й группе. Хотя показатели и не достигали значений группы контроля, они были достоверно (p -1 )
Гиперчувствительность клеточного типа лежит в основе развития ряда инфекционных заболеваний (туберкулеза, бруцеллеза, сальмонеллеза, дифтерии, герпеса, кори, грибковой инфекции), трансплантационного иммунитета, противоопухолевого иммунитета, аутоиммунных заболеваний, контактного дерматита.
Антигенами-аллергенами, индуцирующими реакции клеточного типа, являются бактерии, грибы, простейшие, паразиты, вирусы, клетки собственных тканей организма с измененной антигенной структурой, антигены гистосовместимости, специфические антигены опухолей, комплексные антигены, образующиеся при участии гаптенов.
Взаимодействие антигенов-аллергенов с антигенпрезентирующими клетками обеспечивается при участии Tool-рецепторов (TLR4, TLR5, TLR6, TLR62), экспрессируемых на их мембранах.
В механизмах индукции гиперчувствительности IV типа важная роль отводится антигенпрезентирующим макрофагам, дендритным и другим клеткам, обеспечивающим фагоцитирование и комплексирование негидролизованной части антигена-аллергена с белками II класса молекул МНС, а также презентацию антигена комплементарному клону Тh0. Одновременно антигенпрезентирующие клетки продуцируют цитокины (IL-12, IL-23, IL-27), обеспечивающие пролиферацию и дифференцировку антигенчувствительных клонов Th1.
Полагают, что главным цитокином в реакциях IV типа является гамма-интерферон, продуцируемый Тh1, который вызывает активацию макрофагов, вовлечение их в иммунный ответ за счет их фагоцитарной активности и уничтожения клеток-мишеней в процессе фагоцитоза, а также за счет усиления продукции монокинов с полимодальной направленностью действия.
Интерлейкин-2, продуцируемый Тh1, обеспечивает аутокринную активацию этих клеток лимфоцитов и паракринную неспецифическую пролиферацию Т-эффекторов. Антигенстимулированные Т-лимфоциты-хелперы и Т-лимфоциты-эффекторы обеспечивают продукцию медиаторов аллергии клеточного или замедленного типа, получивших название лимфокинов (рисунок).
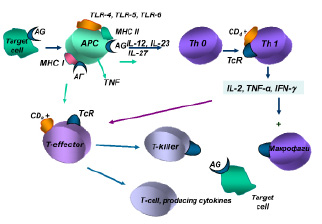
Индукция иммунного ответа при клеточно-опосредованных реакциях
В настоящее время выделено несколько десятков лимфокинов, которые в соответствии с особенностями их биологического действия могут быть разделены на следующие группы:
1. Факторы, влияющие на лимфоциты (фактор переноса Лоуренса, митогенный фактор, фактор, стимулирующий Т- и В-лимфоциты).
2. Факторы, влияющие на макрофаги (миграцию ингибирующий фактор; фактор, активирующий макрофаги; фактор, усиливающий пролиферацию макрофагов).
3. Цитотоксические факторы (лимфотоксин; фактор, тормозящий синтез ДНК; фактор, ингибирующий гемопоэтические стволовые клетки).
4. Факторы хемотаксиса макрофагов, нейтрофилов, лимфоцитов и эозинофилов.
5. Антивирусные и антимикробные факторы.
Многие лимфокины обладают дистантным биологическим эффектом.
Цитотоксические CD8-Т-лимфоциты оказывают прямое действие. CD8-Т-лимфоциты обеспечивают развитие цитолиза клетки-мишени, на мембране которой фиксирован антиген, в три стадии:
I стадия – двойного распознавания антигена в комплексе с белками МНС I класса, экспрессированными на клетке-мишени.
II стадия – летального удара возникает в процессе контакта Т-лимфоцита-эффектора с клеткой-мишенью при участии белка перфорина, лимфотоксина или индуктора апоптоза, получаемых клеткой мишенью при межклеточном контакте.
III стадия – стадия коллоидно-осмотического лизиса, возникающего вслед за перфорацией мембраны и пассивной диффузией ионов, а затем и высокомолекулярных соединений по осмотическому градиенту через поврежденную мембрану.
Описание отдельных форм аллергических реакций
Контактные дерматиты. Аллергия этого типа чаще возникает к низкомолекулярным веществам органического и неорганического происхождения: различным химическим веществам, краскам, лакам, косметическим препаратам, антибиотикам, пестицидам, соединениям мышьяка, кобальта, платины, воздействующим на кожу. Контактные дерматиты могут вызывать также вещества растительного происхождения – семена хлопка, цитрусовые. Аллергены, проникая в кожу, образуют стабильные ковалентные связи с SH- и NН2-группами протеинов кожи. Эти конъюгаты обладают сенсибилизирующими свойствами.
Сенсибилизация обычно возникает в результате длительного контакта с аллергеном. При контактных дерматитах патологические изменения наблюдаются в поверхностных слоях кожи. Отмечаются инфильтрация воспалительными клеточными элементами, дегенерация и отслойка эпидермиса, нарушение целостности базальной мембраны.
Морфологические изменения при контактных дерматитах обусловлены фазным характером инфильтрации. Через 2-3 часа после инъекции антигена-аллергена возникает инфильтрация тканей сегментоядерными нейтрофилами. Через 5-6 часов в периваскулярной области появляются моноциты. Через 8 часов инфильтрация моноцитами становится интенсивной. К 24–72 часам она уменьшается. Клеточные элементы, содержащиеся в очаге воспаления, представлены в основном лимфоцитами и макрофагами.
Инфекционная аллергия. ГЗТ развивается при хронических бактериальных, вызванных грибами и вирусами инфекциях (туберкулезе, бруцеллезе, туляремии, сифилисе, бронхиальной астме, стрептококковой, стафилококковой и пневмококковой инфекциях, аспергиллезе, бластомикозе), а также при заболеваниях, вызываемых простейшими (токсоплазмоз), при глистных инвазиях.
Сенсибилизация к микробным антигенам обычно развивается при воспалении. Не исключена возможность сенсибилизации организма некоторыми представителями нормальной микрофлоры (нейссерии, кишечная палочка) или патогенными микробами при их носительстве.
Сенсибилизация к микробным антигенам в определенных условиях благоприятствует ликвидации патологического процесса. Одним из механизмов повышения устойчивости при ГЗТ может служить повышение неспецифической резистентности (усиление метаболической активности и фагоцитарной способности макрофагов, повышение активности лизоцима).
Отторжение трансплантата. При трансплантации организм реципиента распознает чужеродные трансплантационные антигены (антигены гистосовместимости) и осуществляет иммунные реакции, ведущие к отторжению трансплантата. Антигены главного комплекса гистосовместимости I класса локусов А, В и С есть на всех ядросодержащих клетках, а локуса G – лишь на трофобласте. Эти антигены распознаются CD8-лимфоцитами.
Антигены ГКГС II класса локусов DR, DP, DQ экспрессированы на лимфоидных, макрофагальных и эндотелиальных клетках. Они распознаются CD4-лимфоцитами.
Кроме того, на эритроцитах имеются антигены системы АВО и Rh, в почках – системы АВО. Названные антигены тоже играют определенную роль в индукции отторжения трансплантата.
Виды трансплантатов. Различают сингенные, аллогенные и ксеногенные трансплантаты.
Аллогенные и ксеногенные трансплантаты без применения иммуносупрессивной терапии отторгаются. Несмотря на появление новых, более селективных в отношении трансплантационного иммунитета иммуносупрессоров – грибковых макролидных антибиотиков (циклоспорины, FK506, рапамицин) проблема иммунологического конфликта трансплантата и реципиента еще не решена.
Механизмы отторжения трансплантата. При отторжении трансплантата наблюдается как гуморальный, так и клеточный иммунный ответ, в частности, механизмы ГЗТ, цитотоксические и иммунокомплексные реакции.
В зависимости от сроков отторжение трансплантата может быть сверхострым, острым и хроническим. Сверхострое отторжение возможно при наличии предсуществующих антител, то есть при повторной пересадке тканей от одного и того же донора, и происходит в течение первых 5 дней, а иногда в первые минуты и часы.
При остром отторжении предсуществующих антител нет. Острое отторжение – это классический вариант отторжения, в основе которого лежат как гуморальные, так и клеточные механизмы. Такой вариант отторжения наблюдается при отсутствии или прекращении иммуносупрессирующей терапии. Начало острого отторжения может быть отложено на несколько недель или даже месяцы, но начавшись, процесс заканчивается за несколько дней.
Отторжение считается хроническим, если в случае погрешностей в проведении иммуносупрессирующей терапии наблюдаются повторные эпизоды начинающегося отторжения трансплантата. В основе такого отторжения также лежат реакции гуморального и клеточного иммунитета. Острое и хроническое отторжение отличаются исходом – степенью облитерации сосудов.
Наиболее активны, как стимуляторы отторжения, ФНО и γ-ИФН, которые не только угнетают жизнедеятельность клеток трансплантата и активируют эффекторы цитотоксичности, но и усиливают экспрессию трансплантационных антигенов на клетках, вовлекая цитотоксические эффекторы. При отторжении активны цитотоксические CD4-положительные лимфоциты, их роль даже более значительна, чем CD8-киллеров.
При аллотрансплантации кожи, костного мозга, почки образуются гемагглютинины, гемолизины, лейкотоксины и антитела к лейкоцитам и тромбоцитам. При реакции антиген-антитело образуются биологически активные вещества, повышающие проницаемость сосудов, что облегчает миграцию Т-киллеров в пересаженную ткань. Лизис эндотелиальных клеток в сосудах трансплантата приводит к активации процессов свертывания крови. Кроме того, происходит активация различных фракций комплемента:
• хемотаксические фракции – привлекают полиморфноядерные лейкоциты, которые разрушают трансплантат с помощью лизосомальных ферментов;
• С6 компонент комплемента – активирует свертывающую систему крови;
• С3b фракция – вызывает агрегацию тромбоцитов.
Активация гуморального ответа в виде иммунокомплексных реакций приводит к возникновению васкулита, тромбоза и ишемического некроза.
γ-ИФН привлекает макрофаги, которые также выделяют цитотоксические факторы.
При отторжении по первичному типу участвуют в основном мононуклеары и лишь немного полиморфноядерных гранулоцитов, при отторжении по вторичному типу в качестве эффекторов выступают и мононуклеары, и полиморфноядерные гранулоциты.
Аутоиммунные заболевания. Развитие аутоиммунных заболеваний обусловлено сложным взаимодействием аллергических реакций клеточного и гуморального типа с преобладанием той или иной реакции в зависимости от характера аутоиммунного заболевания.
Аутоиммунные болезни представляют собой гетерогенную группу заболеваний, развитие которых связано или с доминирующей ролью цитолитических антител в механизмах деструкции клеток, или сочетанное патогенное воздействие на клетки-мишени CD8+-Т-лимфоцитов-киллеров, продуцентов лимфокинов с цитолитическими органоспецифическими или неспецифическими антителами.
Преимущественный цитотоксический эффект комплементсвязующих органоспецифических антител имеет место при аутоиммунных гемолитических анемиях, лейкопениях, тромбоцитопениях, тиреоидите Хашимото, пернициозной анемии, болезни Аддисона и других.
Между тем, в патогенезе системной и дискоидной красной волчанки, ревматоидного артрита, дерматомиозита, склеродермии, синдрома Шегрена и других форм патологии, ранее именуемых коллагенозами, ведущая роль в развитии воспалительно-деструктивных процессов в тканях отводится клеточному иммунитету. При этом антителозависимый и комплементзависимый цитолиз, патогенное действие токсических иммунных комплексов на различные органы и ткани потенцируют клеточно-опосредованные реакции.
В индукции аутоиммунных заболеваний выделяют несколько возможных механизмов:
1. Аутоиммунные поражения могут возникать в результате срыва иммунологической толерантности к собственным неизмененным тканям. Срыв иммунологической толерантности может быть обусловлен соматическими мутациями лимфоидных клеток, что приводит либо к появлению мутантных запретных клонов Т-хелперов, обеспечивающих развитие иммунного ответа на собственные неизменные антигены. В ряде случаев возможно образование костимулирующих молекул, модифицирующих структуру МНС антигенов, воспринимаемых лимфоидной системой как генетически чужеродное образование.
2. В последние годы важная роль в развитии аутоиммунных реакций отводится Тh17, синтезирующим ряд про- и противовоспалительных цитокинов, в частности, IL-17, GCSF, TNFα, IL-6, IL-10, IL-12 и др..
3. Образование аутоантител против естественных, первичных, антигенов-аллергенов иммунологически забарьерных тканей (нервной, хрусталика, щитовидной железы, яичек, спермы). В эмбриональный период забарьерные антигены отделены от крови гистогематическими барьерами, препятствующими их контакту с иммунокомпетентными клетками. В результате к забарьерным антигенам не формируется иммунологическая толерантность. При появлении в крови забарьерных антигенов против них начинают вырабатываться аутоантитела и возникает аутоиммунное поражение.
4. Образование аутоантител против приобретенных, вторичных, антигенов, образующихся под влиянием повреждающего воздействия на органы и ткани патогенных факторов неинфекционной (тепло, холод, ионизирующее излучение) и инфекционной (микробных токсинов, вирусов, бактерий) природы.
5. Образование аутоантител против перекрестно-реагирующих или гетерогенных антигенов. Мембраны некоторых разновидностей стрептококка имеют антигенное сходство с сердечными тканевыми антигенами и антигенами базальной мембраны почечных клубочков. В связи с этим антитела к названным микроорганизмам при стрептококковых инфекциях реагируют с тканевыми антигенами сердца и почек, приводя к развитию аутоиммунного поражения.
Разделение аллергических реакций на несколько основных типов в определенной степени условно, поскольку многие антигены-аллергены, воздействующие на организм, являются комплексными и одномоментно вовлекают в иммунный ответ и В-систему лимфоцитов, и Т-лимфоциты-эффекторы.
Преобладание того или иного типа аллергических реакций в патогенезе аллергического заболевания позволяет отнести его к реакциям гуморального или клеточного типов.
Некоторые виды аутоиммунных заболеваний являются классическим примером одномоментного взаимодействия или последовательного развития аллергических реакций гуморального и клеточного типов, лежащих в основе системного или локального воспалительно-деструктивного повреждения тканей.
Читайте также:


