Методы диагностики чумы крс

(только для пользования студентами при подготовке к экзамену. )
ЧУМА КРУПНОГО РОГАТОГО СКОТА
Чума крупного рогатого скота – острая высококонтагиозная и высоколетальная вирусная инфекция домашнего крупного рогатого скота, буйволов и яков, которая характеризуется лихорадкой, прогрессирующим образованием поверхностных эрозий в ротовой полости, желудочно-кишечном тракте, что также сопровождается гнойным воспалением конъюнктивы глаз и верхних дыхательных путей.
Чума КРС вызывается вирусом из семейства Paramyxoviridae , рода Morbillivirus ,
вид - Rinderpest Virus.
Вирус RV родственен вирусам кори человека и чумы собак, также относящимся к данному роду. Близким вирусу RV является вирус чумы мелкого рогатого скота (Peste des petits ruminants - PPRV), вызывающий сходное по клинике заболевание мелкого рогатого скота, однако представляющее собой самостоятельную нозологическую единицу (. ).
Вирус болезни представлен только одним серовариантом в природе, однако генетически значительно отличается внутри вида. Детальный генетический анализ всех изолятов вируса позволили установить присутствие в природе трех генетических линий вируса .
Генетические линии 1 и 2 относится к африканским вариантам, так как изолировались только там. При этом линия 1 была распространена на юг от Египта в Судане, Эфиопии и Кении. Линия 2 имела более широкое географическое распространение с запада на восток. С 1988 года вирус обоих линий присутствовал только в восточной части Африки, а с 2001 вирус линии 1 был также искоренен и там.
Вирус в очень значительной степени меняет свою вирулентность . Так, отдельные штаммы, вызывая в дикой природе опустошительные эпизоотии, при попадании в домашний скот проявляет себя как средневирулентные штаммы. Однако при длительном присутствии в домашней популяции повышают свою вирулентность в отношении домашних животных.
Вирус обладает патогенностью в отношении многих животных порядка Artiodactyla (парнокопытные). Причем среди домашних животных вирус характеризуется наибольшей патогенностью в отношении крупного рогатого скота, а в диком – в отношении африканских буйволов. Установлено, что вирус способен длительно присутствовать в популяции этих животных на срок не более 3 лет, после чего исчезает из данной популяции.
Считается, что чума КРС впервые появлялась около 3000 лет до н.э. в Азии, после чего распространилась по всему миру. В Европе особенно опасны были эпизоотии 18 века, в частности три из них - 1709–1720, 1742–1760, и 1768–1786 гг., однако с начала 20 века практически на европейском континенте не встречалась.
Чума КРС традиционно относилась к исключительно опасным болезням , поэтому Комитет сельского хозяйства при ООН (The Food and Agriculture Organization of the United Nations - FAO) в 1992 принял специальную программу по полной ликвидации болезни
(Global Rinderpest Eradication Programme - GREP). К настоящему времени отмечаются зна-
чительные успехи в ликвидации болезни, определяемые снижением тяжести болезни и ис-
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2010)

(только для пользования студентами при подготовке к экзамену. )
коренением по крайней мере двух из трех генетических линий вируса в природе. Предполагается, что чума КРС будет признана полностью ликвидированной в 20011-2012 году.
Чума КРС клинического проявления, описанного в вышеприведенном определении, не регистрируется уже с 2001 года (Судан, Танзания), так как выявленные после этого случаи болезни в восточной Африке отличались легкой или средней тяжести течением . Предполагается, что высокопатогенный вариант вируса исчез из биосферы
Чума поражает домашний и дикий крупный рогатый скот, однако вирус также может поражать мелкий рогатый скот, отдельные породы свиней, а также многие виды диких животных порядка Artiodactyla (парнокопытные). Однако у неспецифических хозяев вирус не всегда вызывает клиническое проявление болезни.
При диагностике чумы КРС наибольшее значение имеет лабораторное исследование, так как болезнь сходна с другими болезнями, сопровождающимися изъязвлением слизистых оболочек (диарея КРЧ, ЗКГ, ИРТ, везикулярный стоматит и др.).
Для лабораторной диагностики отправляют патматериал взятый в момент лихорадки или появлении эрозий ротовой полости до момента наступления диареи, так как в этот период отмечают наивысшие концентрации вируса в организме. Предпочтительным материалом для исследования являются пробы стабилизированной крови . Также отбирают пробы тканей из эрозий и поверхностных лимфоузлов.
При проведении диагностики чумы КРС международными правилами регламентируется обязательная изоляция и идентификация вируса .
В этой связи диагностика чумы КРС может проводится по следующим направлениям:
1. Изоляция вируса на культурах клеток - B95a, лимфобластоидная культура клеток мартышки или другие. Идентификацию вируса проводят в РИД, встречным иммуноэлектрофорезом или ИФА. Традиционный метод РИД может быть использован в полевых условиях, однако не позволяет дифференцировать два близкородственных вируса – чумы КРС и чумы МРС. Непосредственно в патматериале без предварительной изоляции вирус может быть идентифицирован в гистохимическом варианте ИФА.
2. Идентификация вирусной нуклеиновой кислоты в ПЦР, позволяющем не только дифференцировать вирусы чумы КРС и чумы МРС, однако устанавливать принадлежность изолята к одной из трех генетических линий.
3. Серологическая диагностика проводится в конкурентном ИФА или РН, однако этот метод может быть использован только для мониторинга за распространением вируса в популяции животных.
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2010)
(только для пользования студентами при подготовке к экзамену. )
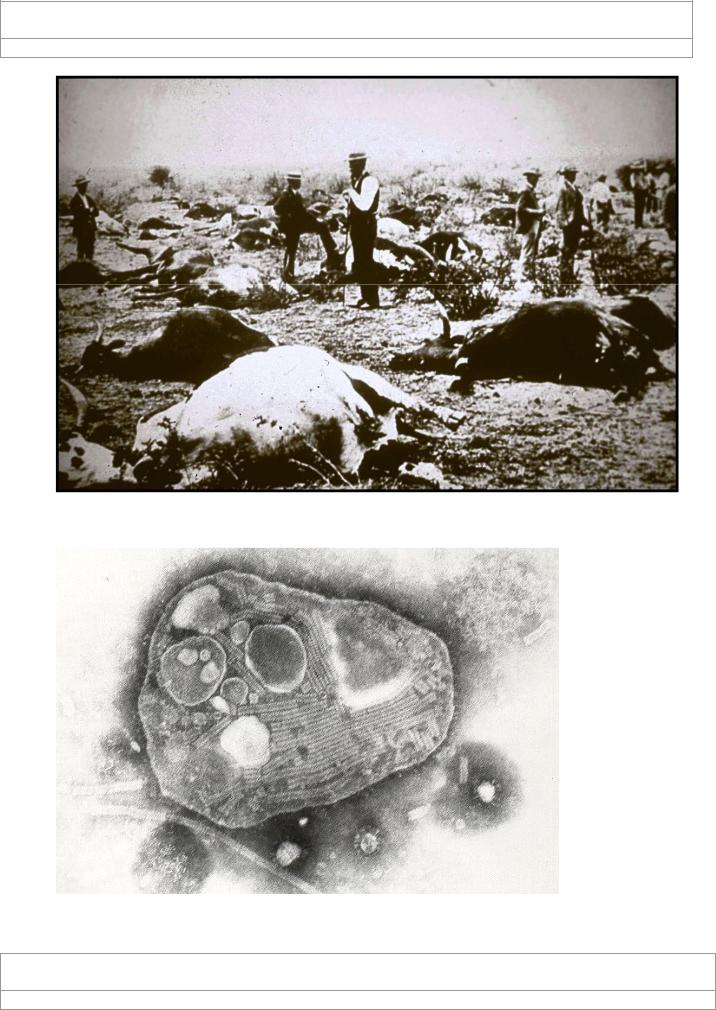
Эпизоотия чумы КРС в США 1890 года
Вирус чумы КРС. Обратите внимание на нитевидную форму нуклеокапсида,
что является характерной чертой всех парамиксовирусов (. )
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2010)
(только для пользования студентами при подготовке к экзамену. )
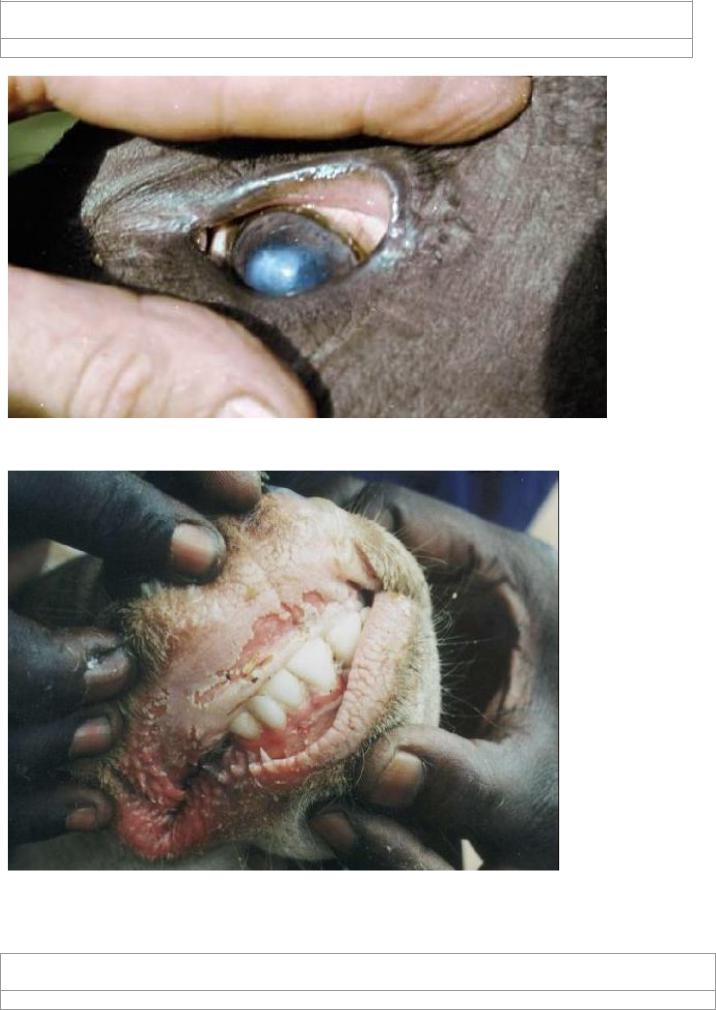
Конъюнктивит у коров при чуме
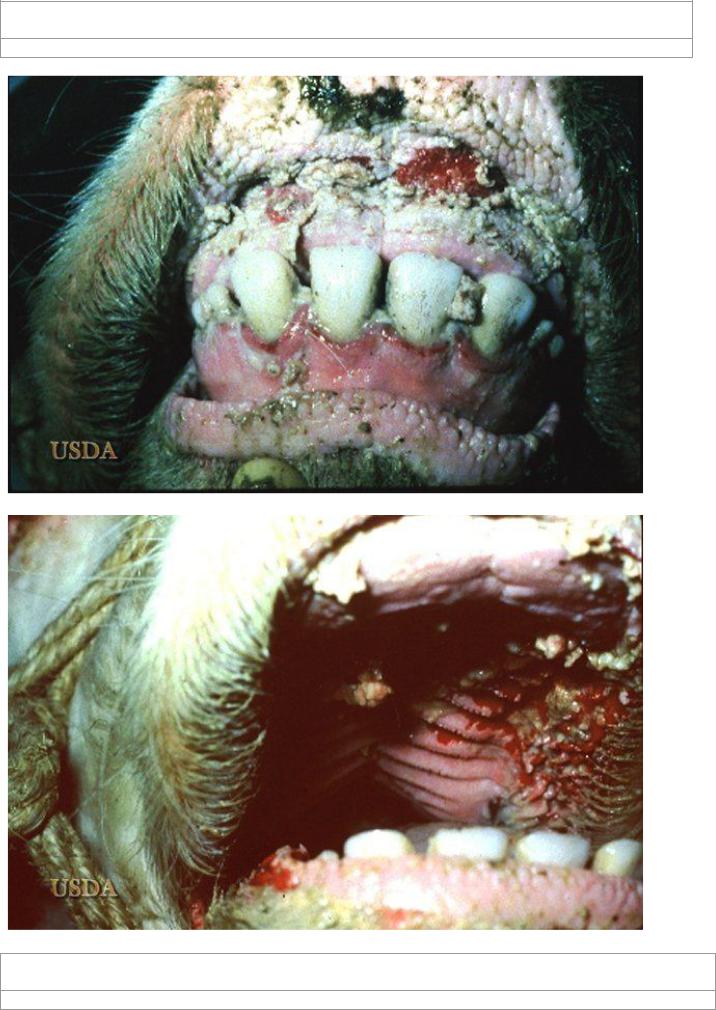
Характер эрозивного поражения ротовой полости при чуме
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2010)
(только для пользования студентами при подготовке к экзамену. )
(кафедра микробиологии и вирусологии, УО ВГАВМ, 2010)
Возбудителем чумы крупного рогатого скота является РНК-содержащий вирус из рода Morbillivirus, сем. Paramyxoviridae. Заразный характер был определен D. Rammazini в 1711 г., потом получил подтверждение М. Г. Тартаковским (1895) и Н. Ф. Гамалея (1896). Возбудитель был открыт в 1902 г. и определена его фильтруемая способность АдильБейем и Николем.
Вирус малоустойчив во внешней среде и к разнообразным физико-химическим факторам. При температуре 60°С он инактивируется в течение 20 мин, при кипячении — мгновенно; при комнатной температуре сохраняется 5—6 суток, при температуре 4°С — несколько недель, при температуре 20°С — сохраняется 7—8 суток, в лиофилизированном виде — до нескольких лет. При гниении вирус разрушается в течение 1—5 ч; щелочи, дезинфицирующие вещества, кислоты в 1—2%-ных концентрациях —за несколько минут.
Эпизоотология. Течение и симптомы. Восприимчивы к вирусу чумы крупного рогатого скота буйволы, зебу, крупный рогатый скот, менее восприимчивы верблюды, овцы, козы, дикие животные. Из лабораторных животных восприимчивы собаки и кролики и при разной аппликации вируса.
Источник возбудителя: переболевшие и больные животные.
Пути передачи: аэрогенный, алиментарный.
Факторы передачи: вода, корма, предметы ухода.
Инкубационный период: от 3 до 17 суток — у крупного рогатого скота; от 2 до 14 суток — у овец; от 5до 7 суток — у верблюдов.
Симптомы чумы крупного рогатого скота. При остром течении — лихорадка устойчивого типа, температура 41—42°С с небольшими ремиссиями, впервые сутки — возбуждение, сухой кашель, затем угнетение, взъерошенность шерсти, потеря аппетита, воспаление слизистых оболочек глаз, рта, носа, серожелтые узелки, обращающиеся после распада в кашицеобразную массу в форме пленки с ихорозным запахом, на месте узелков язвы с неровными краями. К 5-ым суткам слизистая оболочка рта обладает эрозированной, кровоточащей поверхностью, которая покрыта некротизированной тканью с фибрином; конъюнктивит, слюнотечение, гнойный вагинит.
Патолого-анатомические изменения. Истощение, геморрагический диатез, некроз слизистых лимфоидных тканей и оболочек, некроз и эрозии в ротовой полости, язвы и гнойно-фибринозный налет в кишечнике, лимфоузлы воспалены, гиперемированы, в них очаги некроза, жировое перерождение печени, желчь бурая с ихорозным запахом.
Диагностика чумы крупного рогатого скота. В ветеринарно-бактериологическую лабораторию для изучения отбирают кровь, мезентериальные и предлопаточные и лимфоузлы, селезенку. Лабораторные изыскания включают в себя биопробу, выделение возбудителя в культуре клеток, иммунофлюоресценцию, РСК, РДП.
Дифференциальная диагностика. Чуму отличают от злокачественной катаральной горячки — для нее характерно поражение глаз (скопление экссудата в передней камере глаз, кератит), характерное поражение придаточных и носовой полостей черепа.
Ящур характеризуется более значительной контагиозностью, афтозным поражением кожи, ротовой полости, вымени, области межкопытной щели. Течение болезни доброкачественное с низкой летальностью, нет поражения кроветворных органов.
Вирусная диарея выделяется меньшей контагиозностью, медленным развитием энзоотии, низкой летальностью.
Пастереллез дифференцируют отсутствию поражения слизистой оболочки рта, обнаружением пастерелл при бактериологическом исследовании. Гемоспоридозы определяют на основании микроскопического исследования мазков крови.
Профилактика и лечение чумы крупного рогатого скота. Лечение больных животных запрещается ветеринарным законодательством. Их уничтожают бескровным методом с последующим сжиганием трупов. Для активной иммунизации употребляют сухую вирус вакцину из штамма ЛТ против чумы крупного рогатого скота.
Профилактика и меры борьбы организованы на предупреждении заноса чумы крупного рогатого скота на территорию нашей страны. Животных, попадающих из неблагополучных по чуме стран, выдерживают в карантине в течение 2-х недель и прививают вакциной. Сырье животного происхождения должно быть подвергнуто термической обработке. На границах с неблагополучными по чуме КРС государствами организуются иммунные зоны.
Ветеринарно-санитарная экспертиза. Убой чумных животных на мясо воспрещен. Если болезнь диагностировали уже после убоя, то все продукты убоя уничтожают на месте и безотлагательно проводят строгие ветеринарно-санитарные мероприятия. Молоко от больных чумой коров полчаса кипятят и затем уничтожают. Помещения, где держались и производился убой больных животных, обрабатывают горячим (при температуре 70—80°С) 2%-ным раствором едкого натрия.
Чума КРС
Возбудитель: РНК содержащий вирус из рода Morbillivirus, сем. Paramyxoviridae. Заразный характер был установлен D. Rammazini в 1711 г., затем подтвержден М. Г. Тартаковским (1895) и Н. Ф. Гамалея (1896). Возбудитель открыт в 1902 г. и установлена его фильтруемая способность Николем и Адиль Бейем.
Вирус мало устойчив во внешней среде и к различным физикохимическим факторам. При температуре 60°С он инактивируется в течение 15—20 мин, при кипячении — моментально; при комнатной температуре сохраняется 4—6 сут, при температуре 4°С — несколько недель, при температуре 20°С — 6—8 сут, в лиофилизированном виде — несколько лет. При гниении вирус разрушается в течение 1—5 ч; дезинфицирующие вещества, щелочи, кислоты в 1—2%ных концентрациях — в течение нескольких минут.
Эпизоотология. Течение и симптомы. Восприимчивы крупный рогатый скот, буйволы, зебу, менее восприимчивы овцы, козы, верблюды, дикие животные. Из лабораторных животных восприимчивы кролики и собаки при различной аппликации вируса.
Источник возбудителя: больные и переболевшие животные.
Пути передачи: алиментарный, аэрогенный.
Факторы передачи: корма, вода, предметы ухода.
Инкубационный период: 3—17 сут — у крупного рогатого скота; 2— 14 сут — у овец; 5—7 сут — у верблюдов.
Симптомы. При остром течении — лихорадка постоянного типа, температура 41—42°С с незначительными ремиссиями, впервые сутки — сухой кашель, возбуждение, затем угнетение, потеря аппетита, взъерошенность шерсти, воспаление слизистых оболочек глаз, носа, рта, серожелтые узелки, превращающиеся после распада в кашицеобразную массу в форме пленки с ихорозным запахом, на месте узелков язвы с неровными краями. К 5м суткам слизистая оболочка рта имеет эрозированную, кровоточащую поверхность, покрытую некротизированной тканью с фибрином; слюнотечение, конъюнктивит, гнойный вагинит.
Патолого-анатомические изменения. Истощение, геморрагический Диатез, некроз слизистых оболочек и лимфоидных тканей, некроз и эрозии в ротовой полости, гнойно-фибринозный налет и язвы в кишечнике, жировое перерождение печени, лимфоузлы воспалены, гиперемированы, в них очаги некроза, желчь бурая с ихорозным запахом.
Диагностика. В ветеринарно-бактериологическую лабораторию для исследования отбирают кровь, предлопаточные и мезентериальные лимфоузлы, селезенку. Лабораторные исследования включают биопробу, выделение возбудителя в культуре клеток, РСК, РДП, иммунофлюоресценцию.
Дифференциальная диагностика. Чуму отличают от злокачественной катаральной горячки — для нее характерно поражение глаз (кератит, скопление экссудата в передней камере глаз), специфическое поражение носовой и придаточных полостей черепа.
Ящур характеризуется более высокой контагиозностью, афтозным поражением ротовой полости, кожи, области межкопытной щели, вымени. Течение болезни доброкачественное с низкой летальностью, отсутствует поражение кроветворных органов.
Вирусная диарея отличается меньшей контагиозностью, медленным развитием энзоотии, низкой летальностью.
Пастереллез дифференцируют по отсутствию поражения слизистой оболочки рта, обнаружением пастерелл при бактериологическом исследовании. Гемоспоридозы устанавливают на основании микроскопического исследования мазков крови.
Профилактика и лечение. Лечение больных животных запрещено ветеринарным законодательством. Их убивают бескровным методом с последующим сжиганием трупов. Для активной иммунизации применяют сухую вирус вакцину из штамма ЛТ против чумы крупного рогатого скота.
Профилактика и меры борьбы основаны на предупреждении заноса чумы крупного рогатого скота на территорию страны. Животных, поступающих из неблагополучных по чуме стран, выдерживают в карантине в течение двух недель и прививают вакциной. Сырье животного происхождения подвергают термической обработке. На границе с неблагополучными по чуме КРС странами создаются иммунные зоны.
Ветеринарно-санитарная экспертиза. Убой чумных животных на мясо запрещен. Если болезнь диагностирована после убоя, то все продукты убоя уничтожают на месте и срочно проводят строгие ветеринарно-санитарные мероприятия. Молоко от больных чумой коров кипятят 30 мин и уничтожают. Помещения, где содержались и убивались больные животные, обрабатывают горячим (70—80°С) 2%ным раствором едкого натрия.
Основные задачи:
- разработка новых и совершенствование существующих средств лабораторной диагностики вирусных и бактериальных заболеваний сельскохозяйственных животных, птиц и пушных зверей;
- разработка методов индикации вирусов особо опасных инфекционных заболеваний;
- разработка, анализ методов и способов эффективной, быстрой и современной диагностики особо опасных инфекционных заболеваний;
- изучение механизмов развития вирусных и бактериальных инфекций методами вирусологического, микробиологического и молекулярно-биологического анализов;
- диагностика вирусных и бактериальных инфекций.
Основные достижения:
— Тест-система [набор] для лабораторной диагностики ящура типа А непрямым иммуноферментным методом.
— Тест-система [набор] для лабораторной диагностики ящура типа О непрямым иммуноферментным методом.
— Тест-система [набор] для выявления антител к вирусу инфекционного ринотрахеита крупного рогатого скота методом иммуноферментного анализа.
— Тест-система [набор] для выявления антител к вирусу катаральной лихорадки овец методом иммуноферментного анализа.
— Тест-системы [набор] для лабораторной диагностики и идентификации возбудителя оспы овец методами реакции диффузионной преципитации и реакции связывания комплемента.
— тест-система [набор] для лабораторной диагностики чумы мелких жвачных животных методом иммуноферментного анализа.
— Тест-система [набор] для выявления антител к вирусу чумы мелких жвачных животных методом иммуноферментного анализа.
— Тест-система [набор] для выявления антигена вируса болезни Ауески методом иммуноферментного анализа.
— Набор препаратов для лабораторной диагностики чумы плотоядных.
Основные публикации
— Кошеметов Ж.К., Зайцев В.Л., Сансызбай А.Р., Н.Т. Сандыбаев, Матвеева В.М., Строчков В.М., Абдураимов Е.О. Грипп лошадей: биологические и физико-химические свойства, культивирование и диагностика. – Алматы, 2014. – 246 с.
— Кошеметов Ж.К. Распространение, культивирование и методы диагностики гриппа типа А. – Алматы, 2017. — 260 с.
— Кошеметов Ж.К., Нурабаев С.Ш., Кондибаева Ж.Б., Сансызбай А.Р. Чума мелких жвачных животных. – Алматы, 2018. — 272 с.
— Koshemetov Zh. K., Matveyeva V. M., Mamadaliyev S. M., Nurabayev S. Sh., Azhibayev A. Zh., Orynbayev M. B. Seromonitoring of especially dangerous diseases in small ruminants in the Republic of Tajikistan // African Journal of Agricultural Research. – 2007. — 2(4). — P. 187-190.
— Matveyeva V.M., Mamadaliyev S.M, Koshemetov Z. K., Russanova A.M., Troitskiy Y. N. Development of the scheme to prepare specimens for sheep pox virus indication in objects of environment // African Journal of Agricultural Research. – 2007. — 2(5). — P. 203-207.
— Mamadaliyev S.M., Koshemetov Z.K., Matveyeva V.M., Kydyrbayev Z.K., Zaitsev V.L., Khairullin B.M., Mambetaliyev M.A., Sandybayev N.T., Nurabayev, S.S., Azhibayev A.Z., Bulatov Y.A., Katubayeva B.S., Kozhamkulov Y.M., Tabynov K.K., Kydyrmanov A.I., Daulbayeva K.D., Shahvorostova L.I. Avian influenza virus H5N1 subtype A diagnosed in sick and dead wild and domestic birds in Pavlodar oblast, Republic of Kazakhstan // African Journal of Agricultural Research. – 2007. — 2(8). — Р. 360-365.
— Zhugunissov K., Bulatov Ye., Taranov D., Yershebulov Z., Koshemetov Zh., Abduraimov Ye., Kondibayeva Zh., Samoltyrova A., Amanova Zh., Khairullin B., Sansyzbay A. Protective immune response of oral rabies vaccine in stray dogs, corsacs and steppe wolves after a single immunization // Archives of Virology. — 2017. Р. 1-8. (Impact factor — 2,058).
— Sarsenbayeva G., Volgin Y., Kassenov M., Issagulov T., Bogdanov N., Sansyzbay A., Abitay R., Nurpeisova A., Sagymbay A., Koshemetov Zh., Stukova M., Buzitskaya Zh., Кulmagambetov I., Karabayeva D., Ismailova A., Davlyatshin T., Khairullin B. Safety and immunogenicity of the novel seasonal preservative‐ and adjuvant‐free influenza vaccine: blind, randomized and placebo‐controlled trial // Journal of Medical Virology. — 2017. (Impact factor — 1.935).
Предоставление услуг:
- Диагностические исследования сывороток крови на выявление антител к возбудителям оспы овец, контагиозной эктимы овец, чумы мелких жвачных животных, ящура типов А и О, инфекционного ринотрахеита КРС, гриппа типа А с антигенной формулой Н1-Н7, Н13.
- Диагностические исследования биоматериалов на выявление антигена возбудителей оспы овец, контагиозной эктимы овец, чумы мелких жвачных животных, ящура типов А и О, инфекционного ринотрахеита КРС, гриппа типа А с антигенной формулой Н1-Н7, Н13, бешенства, пастереллеза, чумы плотоядных, чумы КРС, болезни Ауески.
- Диагностическое исследование биоматериалов на наличие возбудителей бруцеллеза, пастереллеза, чумы мелких жвачных животных, гриппа типа А, бешенства методом ПЦР
- Постановка биологической пробы на оспу овец, контагиозную эктиму овец, чуму мелких жвачных животных, ящур типов А и О, инфекционный ринотрахеит КРС, грипп типа А, бешенство, чуму плотоядных, чуму КРС, болезнь Ауески.
- Выделение вирусов оспы овец, контагиозной эктимы овец, чумы мелких жвачных животных, ящура типов А и О, инфекционного ринотрахеита КРС, гриппа типа А, чумы плотоядных, чумы КРС, болезни Ауески в монослоях культуры клеток.
- Обучение постановке лабораторных методов для диагностики вирусных и бактериальных инфекций.
- Обучение сотрудников ветеринарных учреждений по отбору биоматериалов от больных животных, птиц и пушных зверей.
- Обучение сотрудников ветеринарных учреждений по транспортировке биоматериалов.
Н.И. САЛЬНИКОВ, С.П. ЖИВОДЕРОВ, Д.В. ЯНЖИЕВА, А.Ю. КОЛЬЦОВ, Т.Р. УСАДОВ, М.М. СУХЕР,
Ю.П. МОРГУНОВ, А.В. ЛУНИЦИН
Ключевые слова: чума мелких жвачных животных, вирус, культура клеток, обратная транскрипция, ПЦР, рекомбинантная плазмида, экспериментальная инфекция.
Чума мелких жвачных животных (ЧМЖЖ) — эндемичная во многих странах Африки, Ближнего Востока, Азии высококонтагиозная трансграничная инфекционная болезнь мелких жвачных, которая представляет серьезную угрозу для животноводства этих стран. Искоренение ЧМЖЖ рассматривают как необходимый компонент глобальной продовольственной безопасности и борьбы с нищетой (1, 2). ЧМЖЖ характеризуется лихорадкой, анорексией, истечениями из глаз и носа, эрозиями и язвами в слизистой оболочке пищеварительного тракта, диареей, а также лейкопенией с иммуносупрессией. У суягных овец и сукотных коз могут наблюдаться аборты (3, 4). Гибель больных животных возможна вследствие непосредственного поражения организма вирусом ЧМЖЖ, снижения иммунитета и размножения других патогенов (например, Pasteurella spp., Escherichia coli, Mycoplasma spp.). Показатели смертности значительно варьируют (от 10 до 90 %) в зависимости от вида инфицированных животных, породы, их возраста и распространенности вторичных инфекционных агентов (5).
Возбудитель болезни — РНК-содержащий вирус семейства Paramyxoviridae, рода Morbillivirus (6, 7), который антигенно родствен вирусу чумы крупного рогатого скота (ЧКРС), также относящемуся к роду Morbillivirus (8). Геном вируса ЧМЖЖ представлен одноцепочечной молекулой РНК негативной полярности размером 15948 нуклеотидов. Геномная РНК вируса ЧМЖЖ содержит открытые рамки считывания для шести структурных белков (нуклеокапсидный, фосфопротеин, матриксный, белок слияния и гемагглютинин) и двух неструктурных белков (V и C) (9). Штаммы и изоляты вируса ЧМЖЖ не подразделяются на серотипы, но на основе нуклеотидных последовательностей генов нуклеокапсидного белка и фосфопротеина сгруппированы в четыре генетические линии (10). Установлено, что штаммы и изоляты вируса ЧМЖЖ, относящиеся к I и II линиям, циркулируют в Западной Африке, к линии III — в Восточной Африке, Ближнем Востоке и на юге Индии, к линии IV — в Азии (11, 12).
Первоначально ЧМЖЖ отмечали в странах Западной Африки, затем инфекция проникла в страны Центральной и Восточной Африки, а с 1980 года и на Аравийский полуостров. В настоящее время это заболевание широко распространено на Африканском континенте и в Азии. Кроме того, это заболевание зарегистрировано в сопредельных с Российской Федерацией государствах — Турции, Афганистане, Казахстане, Таджикистане, Монголии, Китае и Грузии. Анализ эпизоотической ситуации по ЧМЖЖ в России показал, что существует высокий риск проникновения инфекции на территории Сибирского, Уральского, Дальневосточного, Северо-Кавказского и Южного федеральных округов (13, 14).
Согласно рекомендациям Международного эпизоотического бюро (МЭБ, Office International des Epizooties, OIE, Франция), диагноз ЧМЖЖ может быть поставлен при выявлении вирусного генома методом полимеразной цепной реакции (ОТ-ПЦР), выделении вируса с использованием пермиссивной линии клеток, а также при обнаружении антигенов вируса методами твердофазного иммуноферментного анализа (ИФА) и флуоресцирующих антител (МФА), в реакции иммунодиффузии в агарозном геле и в иммуноэлектрофорезе. Серологические методы выявления специфических антител (реакция нейтрализации вируса и конкурентный вариант ИФА) используются при проведении мониторинговых исследований и определении иммунного статуса животного после проведенной вакцинации. МЭБ отмечает, что методы ОТ-ПЦР и ИФА (для выявления вирусных антигенов) наиболее приемлемы для подтверждения клинических случаев болезни (15). Наиболее широко для диагностики ЧМЖЖ применяется ОТ-ПЦР с электрофоретической или гибридизационно-флуоресцентной детекцией продуктов амплификации (ОТ-ПЦР в реальном времени). Хорошо себя зарекомендовали и давно используются протоколы ОТ-ПЦР с электрофоретической детекцией, предложенные M.S. Shaila с соавт. в 1996 года (16) и E. Couacy-Hymann с соавт. в 2002 году (17), основанные соответственно на амплификации фрагментов генов нуклеокапсидного белка и фосфопротеина. В дальнейшем J. Bao с соавт. (18), O. Kwiatek с соавт. (19) и C.A. Batten с соавт. (20) предложили протоколы для высокопроизводительного и более чувствительного метода ОТ-ПЦР в реальном времени на основе амплификации высококонсервативных участков гена нуклеокапсидного белка. Эти тест-системы обладают аналитической чувствительностью от 30 до 10 копий РНК на реакцию и позволяют выявлять геномы штаммов вируса ЧМЖЖ, принадлежащих ко всем четырем линиям (18-20). V. Balamurugan с соавт. (21) опубликовал в 2010 году протокол ОТ-ПЦР в реальном времени, в которой амплифицируется фрагмент гена матриксного белка с чувствительностью в пределах 0,1-1,0 ТЦД50/см 3 .
Несмотря на то, что молекулярно-генетические методы широко используются в ветеринарной практике для диагностики ЧМЖЖ, необходимо наличие подтверждающих тестов, основанных на применении альтернативных генов-мишеней. Такие тесты должны быть валидированы в соответствии со стандартами МЭБ и выявлять геном вируса ЧМЖЖ в пробах биоматериала от инфицированных животных.
В настоящем сообщении мы представляем результаты разработки тест-системы для обнаружения генома вируса ЧМЖЖ, основанной на амплификации фрагмента гена гемагглютинина с использованием методом ОТ-ПЦР в реальном времени. Эта тест-система обладает чувствительностью 0,83±0,22 lg ТЦД50/см 3 и позволяет дифференцировать геном вируса ЧМЖЖ от геномов вирусов чумы крупного рогатого скота и блютанга, вызывающих у овец сходные симптомы. Экспериментально подтверждена возможность практической диагностики ЧМЖЖ с помощью предложенной тест-системы.
Нашей целью была разработка на основе ОТ-ПЦР в реальном времени тест-системы для выявления генома вируса ЧМЖЖ и ее валидация с использованием проб крови от экспериментально инфицированных овец.
Методика. Использованные штаммы вируса ЧМЖЖ (Nigeria 75/1, Эпизоотический и 45G37/35-K), чумы крупного рогатого скота (вакцинные штаммы Накамура и ЛТ 67) и блютанга (VIII серотип, штамм NET 2007), депонированы в Государственной коллекции микроорганизмов ФГБНУ ФИЦВиМ. В качестве отрицательных образцов при определении аналитической специфичности тест-системы использовали культуры клеток из коллекции культур клеток ФГБНУ ФИЦВиМ.
Для экспериментального воспроизведения ЧМЖЖ использовали трех овец романовской породы массой 45-50 кг каждая. Овец № 1 и № 2 инфицировали внутривенным введением культурального материала, содержащего вирус ЧМЖЖ (штамм Эпизоотический) в дозе 3,5 lg ТЦД50, а овцу № 3 использовали в качестве неинфицированного контроля. Все животные подвергались клиническому осмотру с ежедневной термометрией и отбором проб крови. Эксперименты с животными проводились под наблюдением Комиссии по биоэтике ФГБНУ ФИЦВиМ.
Полученные результаты подвергали статистической обработке общепринятыми методами. Достоверность статистической разницы между средними величинами определяли по разностному методу Стьюдента— Фишера, согласно которому для большинства биологических экспериментов при р > 0,05 закономерные различия между сравниваемыми величинами отсутствуют, а при р 3 .
Аналитическую специфичность тест-системы оценивали при исследовании образцов, содержащих вирусы ЧМЖЖ, ЧКРС, блютанга, образцов крови от клинически здоровых овец, а также интактных культур клеток Vero и BHK-21 (коллекция культур клеток ФГБНУ ФИЦВиМ). При этом положительный результат получили только с образцами, содержащими вирус ЧМЖЖ, чем подтверждается специфичность тест-системы.
В результате конструирования положительного контроля амплификации к тест-системе на основе клонирования фрагмента гена гемагглютинина вируса ЧМЖЖ размером 148 п.н. в составе вектора pTZ57 R/T с синтезом в ОТ-ПЦР получили препарат плазмидной ДНК, концентрация которого, определенная спектрофотометрически, составила 80 нг/мкл, что соответствует 2,4×10 10 молекул на 1 мкл. Для оптимизации количества плазмидной ДНК, используемой в качестве положительного контроля, методом ОТ-ПЦР исследовали восемь 10-кратных разведений этого препарата, начиная с 10 -3 . Диапазон концентрации плазмидной ДНК, при котором соблюдается линейность амплификации, составил от 2,4×10 7 до 24 молекул ДНК/мкл, эффективность амплификации — 100 %, достоверность аппроксимации (R 2 ) — 0,99, стандартное отклонение (s) значений Ct —0,32 (рис. 2). Рекомендуемые рабочие концентрации плазмиды в тест-системе, соответствующие диапазону аналитической чувствительности, составляют 2,4×10 7 -2,4×10 4 молекул ДНК/мкл.
При экспериментальном воспроизведении ЧМЖЖ с целью проверки эффективность разработанной тест-системы в течение 15 сут у инфицированных животных не отмечали специфических клинических признаков заболевания, однако на 6-8-е сут у овец повышалась температура тела (до 40,2-40,5 °С). При этом с использованием предложенной тест-системы методом ОТ-ПЦР в реальном времени геном вируса ЧМЖЖ выявляли в пробах крови, отобранных с 5-х по 12-е сут после заражения. (табл. 2).
Наблюдаемая длительность виремии согласуется с описанной в литературе (25, 26), отсутствие четких специфических признаков может быть объяснено низкой использованной дозой заражения — 3,5 lg ТЦД50. Так, в работе M. El Harrak с соавт. (27), опубликованной в 2012 году, для воспроизведения инфекции использовался вирус ЧМЖЖ в дозе 5,1 lg ТЦД50.
1. Показатели аналитической чувствительности ОТ-ПЦР в реальном времени при выявлении генома вируса чумы мелких жвачных животных с использованием предложенной тест-системы (n = 3)
Титр вируса,
lg ТЦД50/см 3
Читайте также:


