Клинические варианты течения микобактериозов
После открытия Р. Кохом возбудителя туберкулеза человека были предприняты активные бактериологические исследования предметов окружающей среды, животных, продуктов питания, воды и почвы с целью поиска единого источника микобактерий (МБ). Исследования завершились открытием большого числа различных видов кислотоупорных микробов, отличных от микобактерий туберкулеза (МВТ), но с медицинской точки зрения их рассматривали как курьезные находки. Только в 1954 г. Timpe и Runyon, собрав значительную коллекцию МБ, других, чем МВТ, выделенных из патологического материала от больных, сделали эпохальное научное открытие о важной этиологической роли нетуберкулезных микобактерий (НТМБ) в заболевании человека и животных. Эта работа послужила толчком к интенсивному изучению НТМБ и заболеваний, которые они вызывают, микробиологами, клиницистами и эпидемиологами.
Среди отечественных ученых, которые с энтузиазмом взялись за изучение НТМБ, необходимо отметить сотрудницу ЦНИИТ (Москва) Н.М. Макаревич, которая защитила в 1973 г. докторскую диссертацию на тему "Атипичные микобактерии: методы идентификации, источники выделения и значение в клинике туберкулеза". Профессор М.П. Зыков (Ленинград) в своей докторской диссертации "Микробиологические аспекты туберкулеза в странах тропической Африки" (1967 г.) также проводил исследования по идентификации и определению лекарственной чувствительности НТМБ. Основателем бактериологических исследований НТМБ в нашем институте является к.б.н. Т.Б. Ильина. Вот уже более 30 лет СПбНИИФ ведет работу по изучению НТМБ, разработке методов их идентификации, диагностике микобактериозов, обучению врачей-бактериологов ПТД методам идентификации МБ. За истекший период в лаборатории института идентифицировано более 3500 культур НТМБ, под наблюдением в клиниках института и городских стационарах находилось 269 больных микобактериозом легких. В последние годы институтом выпущен в свет ряд методических рекомендаций: "Бактериологическая и биохимическая идентификация микобактерий" (1994 г.), "Лечение туберкулеза и микобактериоза легких с применением беталактамных антибиотиков" (1995 г.), "Диагностика и прогнозирование клинического течения микобактериоза легких" (1997 г.).
Род микобактерий по определителю бактерий Берджи (1997 г.) насчитывает более 50 видов и подвидов микобактерий. По способности вызывать заболевания человека и животных микобактерий можно разделить на 3 группы. В одну группу входят безусловно патогенные (опасные) для человека и животных виды микобактерий М. tuberculosis и M. bovis, которые вызывают туберкулез человека и крупного рогатого скота, M. leprae - возбудитель заболевания проказы. В другую - сапрофитные микобактерии, которые свободно живут в окружающей среде и, как правило, не опасны для человека. К ним относятся M. terrae - выделенная из почвы (земли), M. phlei - найдена на траве тимофеевке, M. gordonae (M. aqual) - выделена из водопроводной воды. Промежуточное положение занимает группа условно (потенциально) патогенных микобактерий, которые при определенных условиях могут вызвать заболевания человека.
Термин "нетуберкулезные микобактерий" объединяет сапрофитные и потенциально-патогенные МБ и наиболее точно, с нашей точки зрения, характеризует ту разнообразную группу МБ, которые необходимо отделять от микобактерий туберкулезного комплекса. Заболевания человека, вызванные НТМБ, называются микобактериозами. Международная классификация болезней (десятый пересмотр) включает инфекции, вызванные НТМБ, в рубрику А 31.
В настоящее время повсеместно отмечается нарастание заболеваний микобактериозом, что, вероятно, связано с увеличением числа больных с поражением иммунной системы с хроническими неспецифическими заболеваниями легких, а также с возросшим числом исследований на НТМБ и улучшением их диагностики. Немаловажную роль в увеличении микобактериоза играет ухудшение экологической обстановки в отдельных регионах.
Фтизиатрическая служба, где лечатся и состоят на учете больные микобактериозом, уже хорошо знакома с этим заболеванием, однако врачи практического здравоохранения, как и население в целом, мало информированы об этом заболевании. В то же время трудности диагностики, высокая естественная резистентность НТМБ к антибактериальным препаратам приводит к развитию хронических деструктивных поражений легких или диссеменированным процессам. Заболевание имеет неблагоприятный прогноз, с частыми обострениями, постоянным бактериовыделением и высоким процентом летальных исходов.
НТМБ вызывают заболевания легких, лимфатических узлов, кожи, мягких и костных тканей. У нас в стране наиболее часто встречаются микобактериозы легких. Они наблюдаются главным образом у лиц старше 50 лет, имеющих предшествующие деструктивные или обструктивные поражения легких: хронические бронхиты, эмфиземы, бронхоэктазы, пневмоконеозы, силикозы, у больных, излеченных от хронических инфекций, таких как туберкулез и микоз. Лимфангоиты встречаются исключительно в детском возрасте от 1,5 до 10 лет. Поражаются подчелюстные и околоушные лимфатические узлы. Быстрорастущие микобактерии часто становятся причиной раневой инфекции, послеоперационных осложнений при трансплантации органов, перитональном диализе. В последнее время отмечается течение микобактериоза в виде диссеминированной инфекции. Заболевание развивается на фоне иммунодефицитного состояния организма, связанного с предшествующими заболеванием или применением лекарственных препаратов (иммунодепрессантов). Диссеминированные процессы развиваются также как позднее осложнение у больных с синдромом иммунодефицита.
Если главным источником МТБ является больной человек, то микобактериозы до настоящего времени расцениваются как неконтагиозные заболевания. Считается, что больной микобактериозом не представляет опасности для окружающих, так как НТМБ не передаются от человека к человеку. Эпидемиологиеское изучение источника НТМБ и путей передачи возбудителя показало высокий процент содержания НТМБ на различных объектах окружающей среды. Почва и вода являются естественным резервуаром обитания НТМБ, поэтому иногда их называют "микобактериями окружающей среды". Известно, что главным местом обитания M. avium intracellulare служат открытые водоемы. Из воды M. avium передается человеку воздушно-капельным путем, в результате естественного образования аэрозолей над поверхностью воды. Наши наблюдения показали, что часто источником заболевания микобактериозом становятся больные туберкулезом домашние птицы, выделяющие M. avium. M. kanssasii в большом количестве выделяются из водопроводной воды и от некоторых видов домашних животных. M. xenopi обнаруживаются исключительно в воде, особенно в системах горячего водоснабжения и питьевых бачках, где при оптимальной температуре роста (43-45°С) интенсивно размножаются. Быстрорастущие микобактерии - M. fortuitum и M. chelonai - выделяются из почвы и естественных водоемов. Таким образом, широкое растпространение M. avium в природе часто способствует инфицированию человека и обнаружению их при посеве патологического материала.
Выделение НТМБ из патологического материала не свидетельствует о безусловной этиологической значимости данного микроба, как это бывает в случае выявления МВТ. Выделение культуры НТМБ может происходить вследствие ряда причин:
1. Случайное загрязнение материала НТМБ из окружающей среды.
2. Носительство НТМБ, которые могут заселять (колонизировать) отдельные органы и системы человека (респираторный, желудочно-кишечный тракт, мочевыделительные пути), жить там и размножаться, не вызывая клинических проявлений.
3. Заболевание микобактериозом. Следовательно, выделение НТМБ требует от врача тщательного клинического разбора больного для определения этиологического значения выделенной культуры. НТМБ вызывают заболевания, по клиническим, рентгенологическим и патологическим признакам сходные с туберкулезом, поэтому главным критерием при постановке диагноза микобактериоза является бактериологическое исследование больного с выделением культуры микобактерии и их идентификацией.
За последние годы в Санкт-Петербурге и Ленинградской области ежегодно регистрируется от 11 до 15 случаев микобактериоза легких. В течение 1994-1998 гг. в регионе Северо-Запада как возбудители микобактериоза определяются пять видов НТМБ. M. avium-intracellulare считается основным возбудителем заболеваний человека, на их долю приходится 57% заболеваний. На втором месте по этиологической значимости новый для нашего региона возбудитель M. malmoense - 24,5%. Остальные заболевания вызваны M. xenopi, M. kanssasii и M. scrofulaceum.
Первую оценку этиологической значимости выделенной культуры НТМБ лечащий врач делает при получении результатов идентификации МБ, которая складывается из исследуемого патологического материала и вида выделенных НТМБ. Установлено, что для каждого патологического материала характерен свой видовой состав МБ, что дает возможность сделать предварительную оценку выделенных микроорганизмов и определить тактику ведения больного.
Из диагностического материала при заболевании бронхолегочной системы (мокрота, промывные воды бронхов), как правило, выделяются потенциально патогенные МБ - M. avium, M. xenopi, M. kanssasii, M. malmoense (таблица). Именно эти НТМБ являются главными этиологически значимыми микроорганизмами и вызывают почти 95% микобактериозов человека. Следовательно, при первом выделении этих НТМБ врачу следует подумать о возможности микобактериоза и провести целенаправленное многократное бактериологическое обследование больного. Однократное выделение сапрофитных МБ из респираторного тракта при заболевании легких носит случайный характер и может быть расценено как загрязнение или носительство. Исключение составляют быстрорастущие M. fortuitum и M. chelonai, которые также могут быть возбудителями микобактериозов, но в этом случае выделение носит многократный характер.
В 90% случаен из мочи выделяются сапрофитные МБ, что указывает на возможность значительного загрязнения (контаминации) материала при сборе анализов. В то же время наблюдаются случаи многократного (до 10 культур) выделения M. fortuitum из мочи, сопровождающегося массивным ростом культуры. У этих больных, как правило, отмечаются патологические изменения в почках, подтвержденные клинико-лабораторными исследованиями. Но ни в одном из клинических наблюдений диагноз микобактериоза мочевыделительной системы не был поставлен. У всех больных многократное выделение НТМБ из мочи было расценено как носительство. В операционном материале в 100% случаев выделяются потенциально патогенные МБ, что служит неоспоримым критерием для постановки диагноза микобактериоза. В некоторых случаях имеет место выделение НТМБ только в резецированной легочной ткани, что также указывает на большие трудности выделения этих видов МБ из патологического материала больных с заболеваниями легких.
Таблица. Группировка микобактерий по степени патогенности для человека (наиболее часто встречающиеся НТМБ в нашем регионе)
| Патогенные | M. tuberculosis, M. bovis, M. leprae |
| Потенциально патогенные | M. avium, M.intracellulare, M. kanssasii, M. malmoense, M. xenopi, M. fortuitum, M. chelonai |
| Сапрофиты | M. gordonae, M. terrae, M. triviale, M. phlei, M. flavescens, M. gastri |
Для постановки диагноза микобактериоза легких общепринятым критерием является многократное выделение одного и того же вида НТМБ с учетом соответствующей клинико-рентгенологической картины заболевания при условии отсутствия у больного МВТ. Безусловным диагностическим признаком считается выделение НТМБ из закрытого очага, из которого проба получена в стерильных условиях (абсцесс, биопсия, операционный материал). Однако, учитывая несовершенство бактериологических методов исследования, так же как и неудовлетворительное обследование больных, выделение НТМБ из патологического материала встречается крайне редко.
Детальный анализ историй болезни больных микобактериозом позволил сделать вывод о том, что в ряде случаев диагноз можно ставить и по однократному выделению НТМБ. За основу клинико-бактериологического критерия диагностики микобактериоза взята ОДНОВРЕМЕННОСТЬ появления клинико-рентгенолабораторных признаков заболевания, характерных для туберкулезного процесса, и выделение культуры НТМБ.
В 70% случаев заболевания микобактериозом легких выявляются в период профилактических осмотров или диспансерного наблюдения. В этих условиях симптоматика заболевания может быть стертой, но данные рентгенологического или флюорографического обследования свидетельствуют о появлении специфического процесса в легких или его активизации (свежие очаговые изменения, инфильтрат с распадом, зона деструкции и др.). Такой больной направляется для дообследования и лечения в противотуберкулезный диспансер, где он проходит первичное бактериологическое обследование методом бактериоскопии и посева на МБ. Если в диагностическом материале выделены потенциально патогенные микобактерии, то заболевание следует расценивать как микобактериоз, так как имеется тесная временная связь между выделением культуры НТМБ и наличием рентгено-флюорографических данных о патологическом процессе в легких. У 60% больных микобактериозом выделение НТМБ наблюдается в первые два месяца после обнаружения специфической патологии в легких и дает возможность правильно верифицировать заболевание.
В 30% случаев патологические изменения в легких диагностируются при обращении за медицинской помощью. Основным поводом для обращения к врачу является симптоматика острого респираторного заболевания или обострения хронического неспецифического процесса в легких, в некоторых случаях первым проявлением заболевания бывает кровохарканье. В связи с подобной патологией больных, как правило, направляют на бактериологическое обследование с посевом материала на МБ. В 64% наблюдений дата обращения за медицинской помощью и дата выделения первичной культуры НТМБ у больных микобактериозом укладывается в двухмесячный срок. Следовательно, одновременное появление клинико-рентгенолабораторных признаков заболевания и выделение культуры НТМБ является научно обоснованным критерием для постановки диагноза микобактериоза легких.
Таким образом, если появление выраженной клинико-лабораторной симптоматики (кашель с мокротой, одышка, катаральные явления в легких, повышение температуры, ускорение СОЭ) и рентгенологическое выявление картины специфического процесса в легких совпадают с датой выделения НТМБ из диагностического материала, диагноз микобактериоза легких впервые выявленным больным ставится по однократному (первичному) выделению НТМБ. Аналогичное сопоставление даты активизации процесса и даты выявления культуры НТМБ может иметь место и у больных, ранее перенесших туберкулез, которые в момент клинического прогрессирования процесса в легких на фоне интенсивной противотуберкулезной терапии выделяют культуру НТМБ. В этих случаях диагноз микобактериоза также можно ставить по однократному выделению НТМБ.
Следует еще раз подчеркнуть, что НТМБ вызывают у человека заболевания, сходные с туберкулезом, и для постановки диагноза необходимо пользоваться "Клинической классификацией туберкулеза" (приложение N8 к приказу МЗ РФ от 22.11.95 г. N324), заменив термин "туберкулез" на "микобактериоз", вместо "МБТ+" указывать вид НТМБ, выделенных у больного, как-то: M. avium, M. xenopi и др.
Во всех случаях выделения НТМБ одновременно с МБТ приоритет отдается классическим МВТ. Выделение НТМБ признается простым носительством и не требует специальной терапии в редких случаях, когда больные микобактериозом заражаются туберкулезом как вторичной инфекцией и выделяют два вида МБ, и туберкулезные и нетуберкулезные микобактерии оцениваются как этиологически значимые микроорганизмы.
Микобактериозы – заболевания человека, вызываемые потенциально патогенными (атипичными) микобактериями. Микобактерии, способные при определенных условиях вызывать заболевания человека, называются потенциально патогенными микобактериями, или атипичными, в отличие от типичных микобактерий туберкулеза (МБТ).
Частота выделения атипичных микобактерий в отдельных странах колеблется от 0,1 до 24,2% всех выделяемых культур микобактерий.
В соответствии с классификацией, предложенной Раньоном в 1959 г., атипичные микобактерии делятся на 4 группы:
I группа : фотохромогенные микобактерии – культуры приобретают желто-оранжевую окраску, если во время роста находились на свету. Представители: M. kansasii, М. marinum, М. ukerans.
II группа : скотохромогенные микобактерии – культуры окрашены в ярко-оранжевые тона независимо от того, выращивались они на свету или в темноте. Представители: M. scrofulaceum, M. aque, M. gordonae, M. flavescens.
III группа : нефотохромогенные микобактерии – культуры могут быть неокрашенными или иметь желтовато-оранжевые оттенки. Пигментация не зависит от экспозиции на свету. Представители: М. avium, M. intrаcellulare.
IV группа : быстрорастущие микобактерии – в течение 7 дней при 25 и 37 °C заканчивают рост, образуя зрелые колонии. Представитель – M. fortuitum.
Все виды рода микобактерий, в том числе сапрофиты, обладают свойствами кислотоустойчивости.
Микобактериозы не передаются от человека к человеку. Потенциально патогенные микобактерии обнаруживаются в организмах растений и животных, домашней и дикой птицы, рыб, они распространены в воде рек, озер, морей, водопроводной воде. Методы очистки воды не всегда уничтожают микобактерии. Попадая в организм человека из внешней среды, атипичные микобактерии могут не вызывать заболеваний, сохраняясь, например, в составе микрофлоры полости рта. Поэтому для подтверждения диагноза микобактериоза необходимо повторное выделение атипичных микобактерий из одного и того же патологического материала (мокрота, смывы бронхов, гистологический материал) при наличии соответствующей клинико-рентгенологической симптоматики.
Развитию микобактериоза способствуют:
• профессиональная пылевая вредность (шахтеры, литейщики, каменщики, электросварщики);
• факторы, резко снижающие общий иммунитет: алкоголизм, сахарный диабет, рак, иммуносупрессивная терапия, тяжелые оперативные вмешательства, гастрэктомия, пересадка органов, СПИД;
• нарушение местного иммунитета вследствие заболеваний легких: хронические бронхиты, бронхоэктазы, посттуберкулезные изменения, пневмонии, бронхиальная астма.
Клиника микобактериозов разнообразна. По локализации микобактериозы делятся на легочные, внелегочные, диссеминированные. Наиболее часто встречается легочная форма, напоминающая туберкулез. Из внелегочных локализаций наиболее часто встречается поражение периферических лимфатических узлов.
Клиническая картина микобактериоза зависит от конкретного вида возбудителя.
Фотохромогенные:
• M. kansasii – имеет близкое генетическое родство с M. Tuberculosis, поэтому является причиной поражения легких, сходных с туберкулезом, реже поражаются печень, селезенка, суставы, лимфоузлы.
• M. marinum – описан как паразит рыб. У людей вызывает гранулематозные заболевания кожи рук и ног. Заражение происходит через воду.
• M. ulcerans – возбудитель кожных язв у жителей тропических стран. Вызываемые M. ulcerans и M. marinum поражения близки к лепре.
Скотохромогенные:
• M. scrofulaceum – имеет наибольшее значение в патологии человека. Эти микобактерии выделены при шейных и подчелюстных лимфаденитах у детей.
Нефотохромогенные:
• M. avium (птичий) – наиболее распространенный вид среди атипичных микобактерий, вызывающих заболевания человека и животных. Является возбудителем легочных заболеваний людей.
• M. avium и M. intracellulare часто объединяют в комплекс M. аviumintracellulare, а также объединяют вместе с M. scrofulaceum в единый комплекс MАIS как три вида атипичных микобактерий, наиболее часто вызывающих заболевания человека. Представители комплекса MAIS вызывают три типа заболеваний: 1) шейные лимфоаденопатии; 2) прогрессирующие легочные поражения; 3) диссеминированные заболевания с вовлечением костей на фоне иммуносупрессивных состояний.
Быстрорастущие:
• M. fortuitum – является причиной абсцессов, возникающих после инъекций лекарств и после хирургических вмешательств.
Клиническое течение микобактериозов легких
Заболевание наиболее часто протекает под маской туберкулеза, пневмонии, хронического или затянувшегося бронхита. Клиника развивается, как правило, малосимптомно, постепенно. Появляются кашель с небольшим количеством мокроты, слабость, повышается температура. При более поздних сроках заболевания присоединяются одышка, боли в грудной клетке, увеличивается количество мокроты, нарастают симптомы интоксикации. Наряду с описанным встречается и острое течение микобактериоза (особенно когда возбудителем является M. аvium). Характерной особенностью микобактериозов является тенденция к распаду фокусов воспаления в легочной ткани и образованию каверн (у 76–83% больных), выраженность фиброзных изменений.
Микобактериоз и СПИД
У каждого второго больного СПИДом возникают поражения плевры, бронхов и особенно часто – легочной паренхимы. Возбудителем пневмопатий при СПИДе наиболее часто являются пневмоцисты, цитомегаловирус, М. tuberculosis и M. avium-intracellulare. Таким образом, микобактериозы, так же как и туберкулез, относятся к СПИД-ассоциированным заболеваниям. У таких больных необходим целенаправленный поиск M. avium-intracellulare в различном материале, в том числе в посевах крови и пунктатах костного мозга. Критерием диссеминированной инфекции M. avium-intracellulare считается выделение этих микобактерий из двух или более очагов, один из которых внелегочный.
У больных с сочетанием микобактериоза и СПИДа в очагах инфекции обычно не образуется гранулем. В легких и других органах обнаруживаются массивные гистиоцитарные инфильтраты и многочисленные внутриклеточно расположенные микобактерии.
Диагностика основана на клинико-рентгенологической симптоматике в сочетании с бактериологическими исследованиями. Гистологическое исследование при микобактериозе обнаруживает гранулемы, сходные с туберкулезными. Диагноз может быть поставлен только при наличии роста культуры микобактерий после ее идентификации. Без идентификации культуры провести дифференциальную диагностику между туберкулезом и микобактериозом невозможно. Материал для исследования берут из различных органов и тканей, чаще всего – бронхиальные смывы. Установления факта кислотоустойчивости микобактерий недостаточно для постановки диагноза туберкулеза или микобактериоза.
Для посева используются стандартные яичные среды (Левенштейна – Йенсена, Финна, Аникина). Все лица, входящие в группу риска, с жалобами на одышку, лихорадку, кашель, боли в груди, слабость, снижение массы тела должны быть в первую очередь обследованы рентгенологически, что позволяет заподозрить определенное заболевание, прежде всего – туберкулез, реже – микобактериоз. Также необходимо провести бактериологическое исследование.
Бактериологическая идентификация микобактерий проводится по следующей схеме (табл. 7).
Лечение микобактериозов вызывает большие трудности в силу устойчивости к основным противотуберкулезным препаратам. Наиболее эффективны: канамицин, амикацин, этионамид, этамбутол. Используют также сульфаниламиды, неспецифические антибиотики, противолепрозные средства. При наличии иммунодефицита показана иммунотропная терапия. Существенным достижением при лечении больных можно считать исчезновение симптомов интоксикации, прекращение бактериовыделения, стабилизацию патологических изменений в легочной ткани (частичное рассасывание инфильтративных изменений, истончение стенок, уменьшение размеров полостей). При хронических деструктивных процессах показано хирургическое лечение.
Таблица 7. Бактериологическая идентификация микобактерий
Данный текст является ознакомительным фрагментом.

Рубрика: 6. Клиническая медицина
Дата публикации: 07.01.2016
Статья просмотрена: 2137 раз
Микобактериоз легких (МЛ) — это инфекционное заболевание легких, вызываемое нетуберкулезными микобактериями (НТМБ). Первые сообщения о так называемых атипичных микобактериях, впоследствии названных нетуберкулезными, появились в 30-е годы XX века [2]. Роль НТМБ, как этиологического фактора в различной патологии, долгое время не обсуждалась, поскольку их рассматривали как микробы окружающей среды, колонизирующие организм человека. НТМБ широко распространены в природе, являются обычными обитателями экологических резервуаров, воды, почвы, однако некоторые из них, при определенных условиях, могут вызывать заболевание у людей — микобактериозы [1]. Многие виды НТМБ обладают высокой природной устойчивостью к действию различных дезинфектантов, многих химиопрепаратов, в том числе с противотуберкулезной активностью и способны выжить в экстремальных для них условий путем синтеза защитной пленки [7]. В настоящее время описано более 140 видов НТМБ, 40 из которых могут явиться этиологическими агентами заболеваний легких [5]. Отличительными особенностями микобактериозов, в том числе и при поражении легких, является то, что они не передаются от заболевшего человека другим людям и для их развития необходимы предрасполагающие факторы. Такими факторами являются массивный контакт с природными источниками НТМБ и предрасположенность организма человека к инфекции, в частности наличие иммуносупрессии [4]. Клиническое распознавание МЛ связано с трудностью видовой идентификации НТМБ, схожестью клинико-рентгенологических и морфологических проявлений болезни. У части пациентов МЛ трактуется как туберкулез с множественной лекарственной устойчивостью, а у других -диагностируются хронические неспецифические заболевания легких [1]. В обоих случаях пациенты не получают адекватное лечение.
В последнее десятилетие во многих странах, в том числе и в нашей республике, на фоне снижения заболеваемости туберкулезом отмечается значительный рост МЛ, что обусловлено нарастанием случаев ВИЧ-инфекции и других иммунодефицитных состояний, а также совершенствованием методов лабораторной диагностики НТМБ. В республике внедрена в практику современная лабораторная технология выделения и видовой идентификации НТМБ с применением информативных молекулярно-генетических методов исследования [3]. Однако многие вопросы диагностики, тактики лечения и диспансерного наблюдения при МЛ остаются не решенными и требуют дальнейшего изучения.
Материалы и методы исследования
Для выделения и идентификации НТМБ использовался алгоритм, включающий изучение морфологии колоний, пигментообразования, культивирование материала на питательных средах, идентификацию выделенных микобактерий с помощью микробиологических и молекулярно-генетических методов [6]. Выделение микобактерий проводили микробиологическими методами на плотной питательной среде Левенштейна-Йенсена и жидкой среде Миддлбрук 7Н9 в автоматизированной системе Bactec MGIT 960 (Becton Dickinson, США). Для идентификации НТМ использовали молекулярно-генетический метод GenoTypeMycobacteriumCM (HainLifeScience, Германия) [3]. Лекарственную чувствительность НТМБ изучали методом абсолютных концентраций на плотной питательной среде Левенштейна-Йенсена с использованием критических концентраций, установленных для М. tuberculosis.
Анализировались видовая принадлежность НТМБ, возрастно-половой состав пациентов, предъявляемые жалобы, результаты физикальных, лабораторных, инструментальных, рентгенологических методов обследований; наличие сопутствующей легочной патологии, а также факторов, индуцирующих иммуносупрессию; результаты стационарного и амбулаторного лечения.
Анализ полученных данных
Микробный спектр в исследуемой группе представлен на рисунке 1. Среди медленнорастущих НТМБ чаще определялись M.avium (16 чел.- 44,4 %), а в единичных случаях выявлялись M.intracellulare (4 чел.-11,1 %), M.kansasii (1 чел-2,8 %) и сочетание Micobacteriumavium с M. intracellulare (1 чел-2,8 %). Быстрорастущие НТМБ были представлены M.fortuitum (11 чел. — 30,5 %), M.scrofulaceum, M.abscessus и M.gordonae выявлялись по одному случаю (2,8 %)
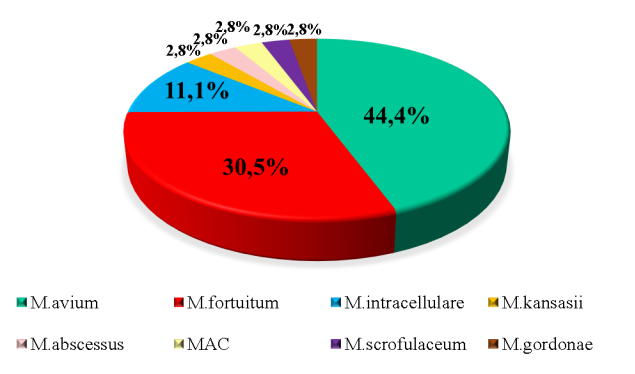
Рис. 1. Видовая принадлежность НТМБ
В изучаемой группе насчитывалось 22 женщины и 14 мужчин, в возрасте от 28 до 83 лет, 56,3 % из них составляли лица старше 50 лет. Средний возраст составил 54,58 года. Заболевания, вызванные M.аvium, чаще встречались у женщин 60 лет и старше (50 %), а заболевания, вызванные М.fortuitum — преимущественно у мужчин трудоспособного возраста (45,5 %) (таблица 1).
Половозрастная структура пациентов с МЛ.
Пол / возраст
M.avium
M.fortuitum
M.intracellulare
Повышение качества жизни людей затронутых ВИЧ-инфекцией
Свердловский областной центр профилактики и борьбы со СПИД, г. Екатеринбург, ул. Ясная 46 (цокольный этаж) тел. 8(343)266-32-11
Классификация ВИЧ-инфекции
Как человек может почувствовать, что заразился ВИЧ?
Как можно обнаружить ВИЧ?
С помощью тестирования на ВИЧ, путем сдачи крови. Иначе – никак. ВИЧ-инфекция протекает циклично и имеет в своем развитии определенные стадии. Все клинические проявления могут относиться как к другим инфекционным и неинфекционным заболеваниям, так и к проявлениям вторичных заболеваний, которые развиваются на фоне иммунодефицита.
Российская клиническая классификация ВИЧ-инфекции
— 1. Стадия инкубации;
— 2. Стадия первичных проявлений;
Варианты течения:
2А. Бессимптомное;
2Б. Острая ВИЧ-инфекция без вторичных заболеваний;
2В. Острая ВИЧ-инфекция с вторичными заболеваниями;
— 3. Субклиническая стадия;
— 4. Стадия вторичных заболеваний;
4А. Потеря массы тела менее 10%, грибковые, вирусные, бактериальные поражения кожи и слизистых, повторные фарингиты, синуситы, опоясывающий лишай;
4Б. Потеря массы тела более 10%, необъяснимая диарея или лихорадка более месяца, повторные стойкие вирусные, бактериальные, грибковые, протозойные поражения внутренних органов, локализованная саркома Капоши, повторный или диссеминированный опоясывающий лишай;
4В. Генерализованные вирусные, бактериальные, микобактериальные, грибковые, протозойные, паразитарные заболевания, в том числе: кандидоз пищевода, бронхов, трахеи, легких; пневмоцистная пневмония; злокачественные опухоли; поражения центральной нервной системы;
— 5. Терминальная стадия.
Характеристика стадий ВИЧ-инфекции
Стадия 2 – стадия первичных проявлений. В этот период активная репликация ВИЧ продолжается и появляется первичный ответ организма на внедрение возбудителя в виде клинических симптомов и/или выработки антител. Считается, что пациент находится в стадии первичных проявлений в течение 12 месяцев после сероконверсии (появления антител к ВИЧ).
Стадия первичных проявлений может протекать в нескольких формах.
2А – бессимптомная, когда какие-либо клинические проявления ВИЧ-инфекции или оппортунистических заболеваний, развивающихся на фоне иммунодефицита, отсутствуют. Ответ организма на внедрение ВИЧ проявляется при этом лишь выработкой антител.
2Б – острая ВИЧ-инфекция без вторичных заболеваний может проявляться разнообразными клиническими симптомами. Чаще всего это увеличение лимфатических узлов, лихорадка, фарингит, высыпания (уртикарные, папулезные, петехиальные) на коже и слизистых оболочках. Может отмечаться увеличение печени, селезенки, появление диареи. Иногда развивается асептический менингит, для которого характерен менингиальный синдром с повышением давления ликвора при отсутствии его визуальных и цитологических изменений. Изредка может развиваться серозный менингит.
2В – острая ВИЧ-инфекция с вторичными заболеваниями. В 10–15% случаев у больных острой ВИЧ-инфекцией на фоне выраженного снижения уровня CD4+ -лимфоцитов и развившегося вследствие этого иммунодефицита появляются вторичные заболевания различной этиологии (ангина, бактериальная пневмония, кандидозы, герпетическая инфекция и др.). Эти проявления, как правило, слабо выражены, кратковременны, хорошо поддаются терапии, но могут быть тяжелыми (кандидозный эзофагит, пневмоцистная пневмония) и в редких случаях иметь смертельный исход.
Продолжительность клинических проявлений острой ВИЧ-инфекции варьирует от нескольких дней до нескольких месяцев, но обычно составляет 2–3 недели. Исключением является увеличение лимфатических узлов, которое может сохраняться на протяжении всего заболевания. Клинические проявления острой ВИЧ-инфекции могут рецидивировать.
У подавляющего большинства пациентов стадия первичных проявлений ВИЧ-инфекции переходит в субклиническую стадию, но в некоторых случаях может переходить в стадию вторичных заболеваний.
Стадия 3 – субклиническая – характеризуется медленным прогрессированием иммунодефицита, компенсируемого за счет модификации иммунного ответа и избыточного воспроизводства CD4+ -лимфоцитов. В крови обнаруживают антитела к ВИЧ; скорость репликации вируса, в сравнении со стадией первичных проявлений, замедляется. Единственным клиническим проявлением заболевания служит увеличение лимфатических узлов, которое носит, как правило, генерализованный характер (персистирующая генерализованная лимфаденопатия, ПГЛ), но может отсутствовать. Могут (чаще у детей) отмечаться такие лабораторные изменения, как анемия, тромбоцитопения, в том числе приводящие к клиническим проявлениям нарушения гемостаза. Продолжительность субклинической стадии может варьировать от 2–3 до 20 и более лет, в среднем она составляет 6–7 лет. В этот период отмечается постепенное снижение количества CD4+ – лимфоцитов со средней скоростью 50–70 клеток/мкл в год.
Стадия 4 – стадия вторичных заболеваний. Продолжается репликация ВИЧ, которая сопровождается гибелью CD4+ -лимфоцитов и истощением их популяции. Это приводит к развитию на фоне иммунодефицита вторичных (оппортунистических) инфекционных и/или онкологических заболеваний. Клинические проявления оппортунистических заболеваний, наряду с ПГЛ, сохраняющейся у большинства пациентов с ВИЧ-инфекцией, и обусловливают клиническую картину стадии вторичных заболеваний.
В зависимости от тяжести вторичных заболеваний выделяются:
Стадия 4А (обычно развивается через 6–7 лет от момента заражения). Для нее характерны бактериальные, грибковые и вирусные поражения слизистых оболочек и кожных покровов, воспалительные заболевания верхних дыхательных путей. Обычно стадия 4А развивается у пациентов с уровнем CD4+ -лимфоцитов около 350 клеток/мкл;
Стадия 4Б (через 7–10 лет от момента заражения) — кожные поражения носят более глубокий характер и склонны к затяжному течению. Развиваются поражения внутренних органов. Кроме того, могут отмечаться локализованная саркома Капоши, умеренно выраженные конституциональные симптомы (потеря массы тела, лихорадка), поражение периферической нервной системы. Признаком перехода ВИЧ-инфекции в стадию 4Б может являться туберкулез, ограниченный одной анатомической областью. Например, это может быть туберкулез легких, в том числе с поражением бронхиальных лимфоузлов, или внелегочный туберкулез, но с поражением одного органа. Обычно стадия 4Б развивается у пациентов с уровнем CD4+ -лимфоцитов 200–350 клеток/мкл;
Стадия 4В (через 10–12 лет от момента заражения) характеризуется развитием тяжелых, угрожающих жизни вторичных (оппортунистических) заболеваний, их генерализованным характером, поражением центральной нервной системы. Обычно стадия 4В развивается у пациентов с уровнем CD4+ -лимфоцитов
Перечень состояний, свидетельствующих о развитии у пациента СПИДА — синдрома приобретенного иммунодефицита.
Случай СПИДа регистрируется, если у человека с ВИЧ-инфекцией диагностируют хотя бы одно из перечисленных ниже заболеваний (при отсутствии других причин для их развития):
1. Бактериальные инфекции (множественные или возвратные) у ребенка в возрасте до 13 лет;
2. Кандидоз пищевода;
3. Кандидоз трахеи, бронхов или легких;
4. Рак шейки матки (инвазивный);
5. Кокцидиомикоз (диссеминированный или внелегочный);
6. Внелегочный криптококкоз;
7. Криптоспоридиоз кишечника с диареей> 1 месяца;
8. Цитомегаловирусная инфекция (с поражением других органов, кроме печени, селезенки, лимфатических узлов) у пациента в возрасте старше одного месяца;
9. Цитомегаловирусный ретинит с потерей зрения;
10. Энцефалопатия, обусловленная действием ВИЧ;
11. Инфекция, обусловленная вирусом простого герпеса: хронические язвы, сохраняющиеся более 1 мес., или бронхит, пневмония, эзофагит у пациента в возрасте старше одного месяца;
12. Гистоплазмоз диссеминированный или внелегочный;
13. Изоспороз кишечника (с диареей длительностью более 1 мес.);
14. Саркома Капоши;
15. Интерстициальная лимфоидная пневмония у ребенка в возрасте до 13 лет;
16. Лимфома Беркитта;
17. Иммунобластная лимфома;
18. Лимфома мозга первичная;
19. Микобактериозы, вызванные M.kansasii, M. avium-intracellulare, диссеминированные или внелегочные;
20. Туберкулез легких у взрослого или подростка старше 13 лет;
21. Туберкулез внелегочный ;
22. Другие недифференцированные диссеминированные или внелегочные микобактериозы;
23. Пневмоцистная пневмония;
24. Пневмонии возвратные (две и более в течение 12 месяцев);
25. Прогрессирующая многоочаговая лейкоэнцефалопатия;
26. Сальмонеллезные (нетифоидные) септицемии возвратные;
27. Токсоплазмоз мозга у пациента в возрасте старше одного месяца;
28. Синдром истощения, обусловленный ВИЧ.
Диагностика
Диагноз ВИЧ-инфекции устанавливает врач-инфекционист путем комплексной оценки эпидемиологических данных, результатов клинического обследования и лабораторных исследований.
Диагностика ВИЧ-инфекции включает в себя два последовательных этапа:
— установление факта инфицирования ВИЧ;
— установление развернутого клинического диагноза – определение стадии и маркеров прогрессирования ВИЧ-инфекции (количества CD4+ -лимфоцитов и уровня РНК ВИЧ в крови).
Факт наличия у человека ВИЧ-инфекции устанавливается на основании эпидемиологических, клинических и лабораторных данных.
Больше информации в соцсетях ВКонтакте и Facebook
Читайте также:


