Классификация лепры по ридли
Лепра представляет собой хроническое генерализованное инфекционное заболевание, при котором поражаются преимущественно производные эктодермы (кожа, слизистые оболочки и периферическая нервная система), лимфатические узлы, печень, селезенка, кости, эндокринные железы (при лепроматозном типе). На земном шаре насчитывается около 15 млн. больных лепрой. Основные ее очаги находятся в юго-восточной Азии (Индия, Бирма, Таиланд и др.), Африке, на островах Океании (Сулавеси, Филиппинские, Гавайские острова и др.), в Индонезии, Центральной и Южной Америке. В Европе лепра встречается в Португалии, Испании, Греции, Италии, Франции и т. д. Небольшие очаги ее имеются в Средней Азии, на Дальнем Востоке, в низовьях Волги (Астраханская область), Дона, в Закавказье. В прошлом лепра как единичные казуистические случаи иногда выявлялась в прибалтийских республиках и в Беларуси. В нашей стране она не представляет ни социальную, ни медицинскую проблему.
Возбудителем лепры является кислото- и спиртоустойчивая палочка Mycobacterium leprae, описанная норвежским ученым Г. Хансеном в 1874 г. и впоследствии названная его именем. Однако культура ее до сих пор не получена.
Единственным источником заражения служит больной человек. Особенно восприимчивы к лепре дети. Предполагается, что в результате длительного контакта с больным лепрой у здорового человека постепенно происходит сенсибилизация к бациллам Хансена вследствие их многократного проникновения в организм. Вместе с тем следует отметить, что человек обладает естественной резистентностью к лепре. Однако ею можно заразиться при снижении защитных сил организма, что могут обусловить плохие социально-экономические условия, низкий санитарно-гигиенический уровень, высокая температура и влажность воздуха, простудные заболевания, гиповитаминозы, алкоголизм, беременность, роды, повреждения кожи, слизистых оболочек и т. д. В таком случае при длительном контакте с больным возможно заражение лепрой. Оно происходит в основном аэрогенно-капельным путем, через верхние дыхательные пути или через поврежденную кожу. Существует мнение, что лепра может распространяться и кровососущими насекомыми. Имеются данные, что микобактерии лепры могут проникать в слизистую ребенка с молоком больной кормящей матери. Установлено, что микобактерии лепры могут длительное время сохранять жизнеспособность, находясь вне организма человека. Это в определенной мере проясняет проблему эпидемиологии ряда случаев заболевания лепрой.
Степень передачи инфекции (заразительность) значительно выше уровня регистрируемой заболеваемости (интенсивность передачи возбудителя), т. е. эффективная заражаемость, или инфицированность, намного выше уровня клинической заболеваемости и болезненности, что объясняется высокой резистентностью человека к лепрозной инфекции.
Больные в субклинической стадии заболевания (в ряде случаев лепра длительно протекает в форме скрытой инфекции, без проявления клинических симптомов) могут быть бациллоносителями и служить источником заражения.
Некоторые успехи в области эпидемиологии, патогенеза и терапии лепры были достигнуты, когда экспериментально удалось добиться локального размножения микобактерии лепры после их введения в мякоть подошвы лапки мышей (S. Shepard, 1960) и заразить лепрой (путем внутривенного введения ее возбудителей) девятипоясного (W. Kirchheimer, E. Storrs, 1971) и восьми-поясного (Convit et al., 1978) броненосцев.
Согласно классификации Ридли — Джоплинга (1966), заболевание лепрой рассматривается как непрерывный иммунологический процесс. При этом туберкулоидный (ТТ) и лепроматозный (LL) типы лепры относятся к полярным группам и выделяются три промежуточные (пограничные) группы:
· пограничная (ВВ) и погранично-лепроматозная (BL).
Кроме того, выделяются две дополнительные группы: субполярный лепроматоз (LLS), недифференцированная лепра (I). В данную классификацию не укладываются стертые и атипичные разновидности (формы) лепроматозного типа лепры: лепра Лусио и гистоидная лепра.
В СНГ различают три типа лепры: лепроматозный, туберкулоидный и недифференцированный.
Комитет экспертов ВОЗ (1967) рекомендует медицинскому персоналу при работе в полевых условиях все случаи заболевания лепрой относить к лепроматозному, туберкулоидному или недифференцированному типу. Причем к первому (лепроматозному) типу следует относить заболевания, при которых бактериоскопические исследования дают положительные результаты, а также пограничную форму (недифференцированный тип); ко второму (туберкулоидному) типу — заболевания, при которых возбудитель не выявляется.
При определении типа лепры учитывают ее клинические проявления, результаты лепроминовой пробы, клеточную структуру очагов поражения, плотность популяций микобактерии в гистологических препаратах, количество лимфоцитов в гранулеме и их расположение, а также расположение последней по отношению к эпидермису, состояние периферических нервов кожи.
Инкубационный период лепры длится от 3—5 до 30 лет и более. Ее клиническая картина определяется степенью естественной резистентности организма, которая может быть установлена с помощью лепроминовой пробы (реакция Мицуды). Различают четыре стадии развития заболевания — прогрессирующую, стационарную, регрессирующую и резидуальную.
Дата публикования: 2015-02-22 ; Прочитано: 1342 | Нарушение авторского права страницы
studopedia.org - Студопедия.Орг - 2014-2020 год. Студопедия не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования (0.002 с) . 
Код но МКБ-10: АЗО Лепра [болезнь Гансена].
Лепра (сии.: проказа (устар.), болезнь Гансена) — хроническое инфекционное заболевание, вызываемое микобактериями лепры, характеризующееся гранулематозными поражениями кожи, слизистых оболочек, периферической нервной и эндокринной систем, внутренних органов, а также отличающееся длительным инкубационным периодом (от 1 до 20 лет и более), торпидным затяжным течением с периодическими обострениями.
Распространенность. Заболевание известно с глубокой древности. Пик заболеваемости проказой в Европе пришелся на XI—XIII столетия. Лишь проведенные широкие государственные меры борьбы с болезнью, главным образом открытие огромного числа специальных изоляционных приютов-лепрозориев, привели к значительному сокращению числа прокаженных.
Число больных лепрой точно не известно, так как не все страны эндемичных регионов сообщают точные данные о заболеваемости. Если в 1990-х гг. говорили о 10-12 млн прокаженных, то в последние 5-7 лет ежегодно регистрируется лишь от 450-520 тыс. больных. Заболевание относится к эндемичным в 53 странах мира, преимущественно в странах с жарким и влажным климатом: Юго-Восточной Азии, Индии, Африке, Южной и Центральной Америке, где проживает более 3 млрд человек.
На территории бывшего СССР эндемичными очагами по лепре считались дельта Волги, Северный Кавказ, Каракалпакия, Казахстан. В Республике Беларусь с 1992 г. на учете нет ни одного больного лепрой.
Этиология. Возбудитель заболевания — микобактерия лепры (Mycobacterium leprae) — был открыт норвежским врачом Г.А. Гансеном в 1873 г. Это первая из палочковидных бактерий, наличие которой связывали с развитием болезни у человека. Заболевание лепрой считалось в обществе долгое время позорным.
Mycobacterium leprae — это грамноложительная, некульти- вируемая, внутриклеточная кислотоустойчивая палочка. Микобактерии лепры — внутриклеточный паразит, имеющий очень много общих свойств с туберкулёзной палочкой. Вместе с тем геном палочки лепры значительно короче, чем у палочки туберкулёза. Чаще это прямые или слегка изогнутые палочки размерами 1-8 мкм в длину и 0,3-0,5 мкм в ширину, иногда встречаются булавовидные вздутия и зернистые формы. Палочки лепры обладают полиморфизмом, помимо типичных, встречаются длинные, короткие, тонкие, крупные, изогнутые, разветвленные, сегментированные, дегенеративные (распадающиеся на зерна) формы.
Возбудитель лепры не растет на питательных средах, применяемых для выращивания микобактерий туберкулёза. Это обстоятельство объясняется облигатным внутриклеточным паразитированием микроорганизма. Кроме того, для палочки Гансена характерен необыкновенно длительный для бактерий цикл размножения — 12—14 суток.
Для возбудителя лепры свойственна высокая степень резистентности. В трупах людей микобактерии лепры сохраняют свою полную инвазивность в течение длительного времени. Вне человеческого организма жизнеспособность возбудителя быстро утрачивается.
Пути передачи и патогенез. Источник заболевания — больной человек. Путь передачи инфекции до сих пор остается неясным. Вероятнее всего, это воздушно-капельный путь, но возможны и другие пути попадания инфекции в организм человека: через носоглотку, поврежденную кожу (укусы, царапины, небольшие раны, татуировки), предметы обихода, инфицированную пищу и воду (возможно). Заражение происходит главным образом при тесном и длительном общении здоровых лиц с больными. Микобактерии лепры содержатся в большом количестве в носовой слизи больных, в отделяемом слизистых оболочек глотки н гортани, особенно при лепроматозной, лепроматозно-пограничной лепре и при наличии реактивной фазы лепры. Эпидемиологи подсчитали, что такие больные во время одного акта чихания выбрасывают в окружающую среду вместе с микрокаиельками слизи свыше 2 млн бацилл. Основной источник инфекции — больные малобациллярными формами лепры, на долю которых в эндемичных регионах приходится 85-90%. Кроме носовой слизи, микобактерии лепры содержатся в сперме, слезах, моче, выделениях из уретры, в грудном молоке. Весьма важный фактор в развитии инфекционного процесса — понижение температуры внешней среды.
Кроме человека, основного резервуара и хозяина возбудителя лепры, естественному заражению подвержены и броненосцы (в Южной Америке живут 9-поясные броненосцы, которые могут болеть лепрой), а также шимпанзе и обезьяны мангобеи.
Большинство людей имеют высокую естественную резистентность по отношению к лепрозной инфекции, что подтверждается положительной лепроминовой пробой. Важный фактор риска по заболеваемости лепрой — проживание в эндемичном регионе. Известны тысячи примеров, когда даже после многолетних тесных контактов с больными лепрой люди оставались здоровыми. Вероятность заражения зависит от возраста (в эндемичных районах к лепре особо восприимчивы дети в возрасте от 5 до 14 лет и пожилые люди старше 55-60 лет), климата (влажный тропический климат и обилие укусов насекомых), социальных условий (плохое жилье, нищета, голодание, плохое общее состояние здоровья), восприимчивости организма (дети в семье прокаженных заболевают в 5-6 раз чаще, чем их одногодки из семей, где лепры нет). Наибольший процент заболевших с развернутой клиникой заболевания приходится на возрастную группу 30-50 лет. Мужчины и лица негроидной расы болеют чаще. Факторы, ослабляющие сопротивляемость организма (плохое питание, алкоголизм, наркотики, инфекционные и простудные болезни, тяжелая физическая работа), повышали опасность заражения у человека, находившегося в эндемичном очаге.
Активность клеточных реакций иммунного ответа на микобактерии лепры (по данным РБТЛ, теста торможения миграции лейкоцитов, лепроминовой пробы) постепенно снижается от ТТ к LL, отражая соответственно наивысшую и наименьшую степени иммунологической устойчивости к заболеванию. Тестом выбора остается внутрикожная лепроминовая проба, предложенная в 1919 г. японцем К. Митсуда, особенно поздняя (на 19-22-й день) реакция (именно она и называется реакцией
Митсуда). У больных туберкулоидной лепрой и у большинства (80-96%) здоровых людей реакция Митсуда положительная, а у больных лепроматозиой лепрой она всегда отрицательная. Поскольку тест Митсуда может меняться в процессе трансформации одного типа лепры в другой, а также иод влиянием лечения, нетрудно сделать вывод, что он не имеет диагностического значения. Тест Митсуда лишь отражает состояние иммунологической реактивности макроорганизма по отношению к возбудителю лепры. Вирулентность возбудителя лепры не влияет на характер заболевания. Доказано, что в одной семье при наличии одного источника заражения н одинаковых условий у контактных лиц нередко развиваются различные типы лепры.
Клиника заболевания всецело зависит от состояния специфического клеточного иммунитета. Возбудитель заболевания размножается в периферических нервах. М. leprae — единственная бактерия, способная поражать периферические нервы. Кроме того, микобактерии лепры находят во многих органах, где они длительное время сохраняются в эндотелиальных клетках и фагоцитах. Несмотря на то что в клинике данного заболевания преобладают поражения, связанные с дегенеративными изменениями кожи и периферической нервной системы, в процесс могут быть вовлечены все органы и системы организма человека, исключая центральную нервную систему и легкие. Этот факт позволяет относить данное заболевание к системным болезням.
Классификация лепры. В настоящее время рабочими классификациями лепры являются Мадридская (1953) и классификация Ридли — Джоплинга (1973).
Мадридская классификация выделяет два полярных тина (туберкулоидный и леироматозный) и две промежуточные группы (недифференцированная и пограничная, или диморфная).
Классификация Ридли — Джоплинга базируется на четырех критериях: 1) клиническом; 2) бактериологическом; 3) иммунологическом и 4) гистологическом. В своем первозданном виде авторы классификации рассматривали лепру как непрерывный иммунологический процесс между туберкулоидным (ТТ) и лепроматозным (LL) типами лепры, называемыми полярными, с выделением трех промежуточных (погранично-туберкулоид- ной (ВТ); пограничной (ВВ) и иогранично-лепроматозной (BL)) и двух дополнительных групп (недифференцированной (I) и субполярно-лепроматозного типа (LLs)). Все эти формы различаются характером клинических проявлений, лабораторными показателями, прогнозом и эпидемиологической значимостью.
Клиническая картина. Лепрозная инфекция отличается необычайно длительным периодом инкубации. Принято считать, что средняя продолжительность инкубационного периода составляет 3-5 лет, однако известны случаи, когда этот период длился 10-20 и более лет.
Владельцы патента RU 2415431:
Изобретение относится к области медицины, а именно к лабораторным методам исследования, в частности к способу определения типов лепроматозной лепры. Способ определения типов лепроматозной лепры заключается в определении в выделенных из периферической крови нейтрофильных гранулоцитах (фагоцитах), инкубированных с лепромином, уровня хемилюминесценции (ХЛ), и по уровню максимальной интенсивности ХЛ, активированной лепромином, определяют тип лепроматозной лепры. Вышеописанный способ повышает точность и информативность определения типов лепроматозной лепры. 1 табл.
Изобретение относится к области медицины, а именно к лепрологии, лабораторным методам исследования и может быть, в частности, использовано для определения типов лепроматозной лепры.
В настоящее время существуют традиционные способы определения типов и форм лепры, а именно клинический осмотр, бактериоскопическое и гистологическое исследование поражений, включающие определение бактериального и гистологического индекса. Но они оказываются недостаточно информативными и точными при определении типов лепроматозной лепры.
Из практики медицины в комплексе с традиционными способами известен иммунодиагностический способ, который в комплексе с традиционными способами может быть применен для определения формы лепры (Былыбин Е.C., Урляпова Н.Г. Способ определения формы лепры, 2006, патент №2279087), заключающийся в том, что в мононуклеарах переферической крови определяют уровень цАМФ через 0,5, 2, 20, 24, ч инкубации их с лепронином в концентрации 20 мкг/мл и по полученному характеру временной динамики этого уровня определяют форму лепры.
Недостатком известного способа является недостаточная точность и информативность, так как данный способ не позволяет выделять субполярный (LLs) и полярный (LLp) типы лепроматозной лепры согласно классификации Ридли Джоплинга, что является существенным в прогнозировании течения лепрозного процесса.
Из практики медицины известен иммунодиагностический способ, который в комплексе с традиционными способами может быть применен для определения формы лепры (Wilkinson K.A., Katoch К., Sengupta U., at al. Immune response to recombinant proteins of Mycobacterium leprae // J. Infect. Dis. - 1999. - Vol.l79. - P.1034-1037), заключающийся в том, что по периферической крови больных, нагруженной рекомбинантными белками M.leprae, определяют состояние продукции гамма-интерферона, свидетельствующей о принадлежности к той или иной форме заболевания.
Недостатком известного способа является недостаточная точность и информативность, так как данный способ не позволяет выделять субполярный (LLs) и полярный (LLp) типы лепроматозной лепры согласно классификации Ридли Джоплинга, что является существенным в прогнозировании течения лепрозного процесса.
Известен также иммунодиагностический способ определения формы лепры, который может использоваться в комплексе с традиционными (Medina F., Camargo A., Moreno J., Zonana-Nacach A., Aceves-Avila J., A. Fraga. Anti-neutrophil cytoplasmic autoantibodies in leprosy // British J.Rheumatology. - 1998. - P.270-273), заключающийся в том, что в плазме больных лепрой определяют наличие антинейтрофильных цитоплазматических антител (ANCA), наличие или отсутствие которых определяет принадлежность к той или иной форме заболевания. Существенным недостатком данного способа является то, что он не дает возможности различить между собой типы лепроматозной лепры (LLs и LLp) согласно классификации Ридли Джоплинга, что не позволяет получить конкретный технический результат - повышение точности и информативности способа.
Наиболее близким способом к предлагаемому является гистологический способ определения типов лепроматозной лепры (D.S.Ridley, M.F.Waters. Significance of variations within the lepromatous groupe, Leprosy Rev., Vol.40, P.143, 1969), который в комплексе с традиционными способами может быть применен для определения типов лепроматозной лепры, заключающийся в том, что гистологически определяют тип клеток гранулемы, ее микобактериальную насыщенность, количество и распределение лимфоцитов, характер и интенсивность поражения нервов, состояние субэпидермальной зоны.
Сходство данного способа с предлагаемым заключается в том, что оба они относятся к лабораторным методам, основаны на исследовании иммунного ответа организма в отношении микобактерий лепры и позволяют определять тип лепроматозной лепры.
Недостатками известного способа является:
- недостаточная точность и информативность, так как известный способ не позволяет быстро и качественно определить тип лепроматозной лепры;
- многоэтапное осуществление способа, что в итоге определяет большую трудоемкость и техническую сложность в осуществлении способа, даже для исследователя, владеющего определенными навыками специальной подготовки;
- большая травматичность способа из-за взятия материала методом малой хирургии с использованием биопсии участка кожного покрова со специфическими лепрозными поражениями;
- большая продолжительность осуществления способа.
Эти недостатки не дают возможность получить конкретный технический результат - повышение точности и информативности способа.
Предлагаемое изобретение решает основную задачу - повышение точности и информативности определения типов лепроматозной лепры. Предлагаемое изобретение позволяет дифференцировать лепроматозные типы - полярный (LLp) и субполярный (LLs). Сущность изобретения выражена совокупностью существенных признаков, достаточных для обеспечиваемого изобретением технического результата.
Решение поставленной задачи предлагаемым способом состоит в том, что при исследовании иммунологического состояния организма больного лепрой в выделенных из периферической крови нейтрофильных гранулоцитах (фагоцитах), инкубированных с лепромином в соотношении 10 микробных тел на фагоцит, определяют уровень хемилюминесценции (ХЛ) и по уровню максимальной интенсивности ХЛ, активированной лепромином, определяют тип лепроматозной лепры, причем субполярный тип (LLs) лепроматозной лепры определяют по ХЛ выше 1552.1 единиц люминесценции (ЕЛ); полярный тип лепроматозной лепры (LLp) определяют по уровню ХЛ, равной или ниже 1552,1 ЕЛ соответственно.
Проблема определения форм и типов лепрозного процесса остается одной из наиболее актуальных в современной лепрологии. При этом важнейшим ее аспектом является своевременное выявление именно типов лепроматоза, которые до настоящего времени диагностируются только гистологически и клинически.
Правильное позиционирование процесса в рамках этих двух типов довольно актуально для клинициста, так как по динамике проявлений субполярный лепроматоз (LLs) отличается большей иммунологической неустойчивостью и непредсказуемостью, что проявляется в его склонности к возникновению реверсивных и нисходящих лепрозных реакций (реакции первого типа), приводящих к многочисленным осложнениям. Напротив, полярный тип лепроматозной лепры (LLp) относится к стабильной форме заболевания. В этом случае процесс протекает довольно монотонно и в большинстве случаев наиболее трудно поддается химиотерапии, становясь часто почвой для длительного персистирования возбудителя в инфицированном организме.
В настоящее время наиболее доступным лабораторным способом определения указанных типов является анализ немногих специфических гистологических признаков, что практически невозможно в период бактериоскопической негативации больного при отсутствии гистоморфологического субстрата. Клинические критерии, среди которых скорость бактериоскопической негативации, становятся доступными в основном лишь в период уже развившихся лепрозных реакций, что не позволяет признать их эффективными и удовлетворительными. Поэтому поиск дополнительных критериев, способствующих уточнению классификации процесса при лепроматозной лепре и совершенствованию прогнозирования течения заболевания, представляет значительный интерес.
Предлагаемым способом достигается дифференцирование лепроматозных типов (полярного и субполярного) на разных стадиях заболевания, а также повышение точности и информативности в определении типов лепроматозной лепры.
Предлагаемый способ осуществляется следующим образом. Нейтрофильные гранулоциты выделяют из гепаринизированной крови на градиенте фиколл-гипак (плотность 1,114). Для этого гепаринизированную венозную кровь (50 Ед/мл гепарина) в количестве 3,5 мл наслаивают на 3,0 мл градиента и центрифугируют 40-50 мин при 3000 об/мин.
После центрифугирования в градиенте формируются два клеточных слоя в виде беловатых слоев. Верхний слой - лимфоциты, нижний - нейтрофилы. Нейтрофильный (нижний) слой с помощью пастеровской пипетки переносят в отдельную пробирку. Нейтрофильные клетки трижды отмывают в 5 мл раствора Хенкса. Объем доводят до 1 мл, после чего клетки подсчитывают и оценивают их жизнеспособность по окраске трипановым синим. Нейтрофилы в количестве 2×10 6 инкубируют 30 минут при 37°С в атмосфере СО2, к клеткам добавляют лепромин в соотношении 10 микробных тел на фагоцит. Затем добавляют люминол в конечной концентрации 50 мкг/мл в 1% диметилсульфоксиде. Для измерения хемилюминесценции используют флюориметр-люминометр FL 600 (Bio-Tek Instruments Inc., США). Измеряют максимум интенсивности индуцированной лепромином ХЛ в условных единицах люминесценции.
Для измерения хемилюминесценции используют универсальный флюориметр-люминометр FL 600 (Bio-Tek Instruments Inc., США).
Статистическую обработку полученных результатов проводят с использованием программного пакета Microsoft Office Excell для Windows 2003 с вычислением среднего арифметического (М), среднего квадратичного отклонения (δ) и критерия Стьюдента (t).
Изложенная сущность изобретения поясняется таблицей.
| Таблица | ||||
| Группа обследованных больных | n | Индуцированная лепромином ХЛ (в ЕЛ) | ||
| М | δ | Р | ||
| Первая группа (Больные LLp типом) | 13 | 1300,9 | 251,2 | 6 инкубируют 30 минут при 37°С в атмосфере СО2, к клеткам добавляют лепромин в соотношении 10 микробных тел на фагоцит. Затем добавляют люминол в конечной концентрации 50 мкг/мл в 1% диметилсульфоксиде. Для измерения хемилюминесценции используют флюориметр-люминометр FL 600 (Bio-Tek Instruments Inc., США). Измеряют максимум интенсивности индуцированной лепромином ХЛ в условных единицах люминесценции. |
ХЛ, индуцированная лепромином, - 2100 ЕЛ - является выше уровня 1552,1, что соответствует субполярному типу лепроматозной лепры (LLs).
Больная А., 1932 г.р., № истории болезни 1875. Больна лепрой с 1949 года. Рецидивы: 17.04.1954; 13.03.1958; 05.08.1965; 29.01.1965. Диагноз: лепра, лепроматозный тип (LLs). Остиомиелит костей стоп. Хронический специфический полиневрит. При осмотре: кожный покров свободен от активных проявлений лепры. Умеренно утолщен левый локтевой нерв, безболезнен при пальпации. Остальные периферические нервы не утолщены, безболезнены. Амиотрофии, контрактур, мутиляций - нет. Деформация концевых фаланг II-V, с двух сторон. Отсутствует тыльное сгибание левой стопы. На подошвенной поверхности левой стопы - трофическая язва. Гиперестезия до верхней трети предплечья с двух сторон, на тыльной поверхности кистей рук - до степени анестезии. На нижних конечностях гипостезия до верхней трети голени. Гистологическое исследование не проводилось. Лепроминовая проба отрицательная. ВН - БИН: 0-0-0. 20.08.2001. Получает лечение: дапсон 100 мг один раз в день. ХЛ, индуцированная лепромином, - 2461 ЕЛ - является выше уровня 1552,1, что соответствует субполярному типу лепроматозной лепры (LLs).
Больная У., 1928 г.р., № истории болезни 3696. Больна лепрой с 03.05.1982. Диагноз: лепра, лепроматозный тип (LLp) в стадии регресса. Хр. специфический полиневрит. Активность процесса: лепрозный процесс без активных проявлений, в стадии регресса. При осмотре: кожные покровы свободны от активных проявлений лепрозного процесса. Гипестезия на нижних и верхних конечностях по полиневротическому типу. Локтевые и малоберцовые нервы несколько утолщены, безболезненны при пальпации. Лепроминовая проба отрицательная. БИН: 0-0-0. Гистологическое исследование не проводилось. Лечение: дапсон 100 мг один раз в день. ХЛ, индуцированная лепромином, - 1091 - является ниже уровня 1552,1, что соответствует полярному типу лепроматозной лепры (LLp).
Больной К., 1927 г.р., № истории болезни 1927. Болен лепрой с 13.02.1958. Диагноз: лепра, лепроматозный тип (LLp) в стадии регресса. Хр. специфический полиневрит с чувствительными амиотрофическими нарушениями. Атеросклероз сосудов головного мозга, сердца, аорты. Симптоматическая гипертония. Активность процесса: лепрозный процесс без активных проявлений, в стадии регресса. При осмотре: кожные покровы свободны от активных проявлений лепрозного процесса. Локтевые нервы умеренно утолщены, при пальпации безболезненны. Остальные периферические нервы пальпации не доступны. Гипотрофия межкостностных мышц, m.thenara, hypothenara с двух сторон, западение I межпальцевого промежутка, грубее справа. Сгибательных контрактур нет. Гипостезия до с/3 голеней и в/3 предплечий. Мутиляций, трофических язв нет. Лепроминовая проба отрицательная. БИН: 0-0-0. Гистологическое исследование не проводилось. Лечение: дапсон 100 мг один раз в день. ХЛ, индуцированная лепромином, - 1552 ЕЛ - это равно уровню 1552,1, что соответствует полярному типу лепроматозной лепры (LLp).
Предлагаемый способ дает возможность с большой точностью и информативностью определить тип лепроматозной лепры. Способ позволяет дифференцировать лепроматозные типы - полярный (LLp) и субполярный (LLs). Предлагаемый способ не является трудоемким и технически сложным. Он может быть осуществлен любым исследователем, владеющим определенными навыками специальной подготовки. Предлагаемый способ менее травматичный по сравнению с прототипом, так как исключает хирургическое вмешательство. Предлагаемый способ выполняется в течение рабочего дня, независимо от активности лепрозного процесса, что свидетельствует о непродолжительности осуществления способа.
Предлагаемый способ может быть рекомендован для уточнения классификации процесса при лепроматозной лепре и совершенствования прогнозирования течения заболевания в лепрозных учреждениях системы здравоохранения.
Способ определения типов лепроматозной лепры, состоящий в исследовании иммунного ответа организма в отношении микобактерий лепры, отличающийся тем, что в выделенных из периферической крови нейтрофильных гранулоцитах (фагоцитах), инкубированных с лепромином в соотношении 10 микробных тел на фагоцит, определяют уровень хемилюминесценции (ХЛ) и по уровню максимальной интенсивности ХЛ, активированной лепромином, определяют тип лепроматозной лепры, причем субполярный тип (LLs) лепроматозной лепры определяют по ХЛ выше 1552.1 единиц люминисценции (ЕЛ); полярный тип лепроматозной лепры (LLp) определяют по уровню ХЛ, равной или ниже 1552,1 ЕЛ соответственно.
Лепра (проказа , от греч. lepros – чешуйчатый, шероховатый, шелушащийся) – это хроническое генерализованное заболевание, характеризующееся специфическим гранулематозным поражением производных эктодермы (кожи, слизистых оболочек, периферической нервной системы) и патологическими изменениями во внутренний органах.
Проказа – одна из древнейших болезней, известная человечеству задолго до нашей эры, подробные описания встречаются в египетских папирусах, индийских писаниях, относящихся к периоду 1500 лет до нашей эры. Известно, что она была распространена в Китае, Японии, Персии. Распространению заболевания способствовали развитие мореплавания и торговли, а так же завоевательнве походы – в античном море это были финикияне (morbus phoenicicus) и греки (elephantiasis graecorum), в Европу проказу принесли легионы Рима. В Европе максимальное распространение лепры относится к 11-13 столетиям (войны, крестовые походы, стихийные бедствия, эпидемии других заболеваний), откуда заболевание проникло в Новый Свет (15-16 вв.), Австралию и Океанию (начало 19 в.). В большинстве стран заболевание приравнивалось к гражданской смерти с исключением из общества и лишением наследства; больных либо убивали, либо изгоняли в пустынные места.

Изгнание больного проказой (лепрой).
Само библейское zaraath (проказа) было собирательным термином, обозначающим моральную и физическую нечистоту. Для изоляции больных еще в Византии были организованы ксенодохии, в средневековье их заменили лепрозории (созданы священником Лазарем – человека клали в гроб и в храме отпевали заупокойную, заболевание проказой приравнивалось к смерти), порядки которых напоминали тюрьмы, а побег всегда карался смертью. Однако драконовские методы дали свои плоды. Начиная с 14 в. заболеваемость в Европе резко снизилась, и сейчас проказа встречается в виде отдельных очагов. В настоящее время в мире насчитывается от 2 до 13 млн. больных, преимущественно в странах Третьего мира. Наибольшее количество больных находится в Азии (Индия – 64%, Китай, Бирма), Африке, Южной и Центральной Америке. На территории бывшего СССР районами эпидемии по лепре были Прибалтика, устья Волги, Дуная, Кавказ и Закавказье, Средняя Азия. На этих территориях располагаются лепрозории (сейчас крупнейший лепрозорий в СНГ располагается на территории Астраханской области).
Возбудитель – M. leprae был открыт норвежским врачом Г.А. Хансеном в 1873 г. в соскобе с поверхности лепромы.
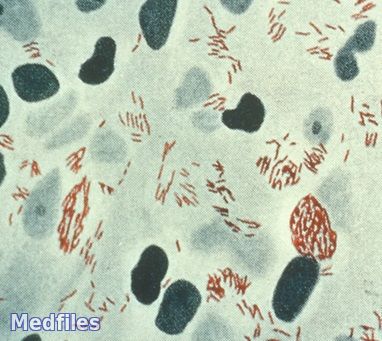
Морфология и тинкториальные свойства.
Строгие аэробы, оптимальная температура – 30-35 0 С (поражает, в основном, охлажденные участки организма – кожу). M. leprae – облигатный внутриклеточный паразит тканевых макрофагов, поэтому на питательных средах не растет, культивируется на животных (заболевание воспроизводится на девятипоясных броненосцах, а также используется экспериментальная модель –заражение белых тимусэктомированных мышей в подушечки лап (метод Шепарда) с последующим развитием гранулем). К настоящему времени установлена возможность естественного инфицирования броненосцев и обезьян мангобеев. Однако по некоторым литературным данным, M. leprae выращивают на глицериново-картофельном и кровяном агарах, яичных средах, среде Вассермана – рост наблюдается через 6-8 недель (период генерации – от 12 до 20-30 дней) в виде сухого морщинистого налета.
Утилизируют глицерин и глюкозу. Выделяют ферменты – пероксидазу, цитохромоксидазу, щелочную фосфатазу и специфический – О-дифенолоксидазу (ДОФА-оксидаза), отсутствующий у других микобактерий.
- Полисахаридные АГ – термостабильные, групповые для микобактерий;
- Белковые АГ – термолабильные, видоспецифические;
- Имеют перекрестнореагирующие антигены с антигенами людей 0 (I) группы крови Rh-.
- Высокое содержание липидов;
- Облигатное внутриклеточное паразитирование.
Вне организма человека возбудитель быстро утрачивает жизнеспособность, но в трупах людей может сохраняться долгое время. Также остаются жизнеспособными после 10-12 лет хранения при комнатной температуре в 40% формалине.
Заболевание мало контагиозно.
Источник инфекции – больной человек. От больного бактерии выделяются через кожу, при кашле, чихании, даже при разговоре. Есть сообщения о выделении возбудителя с семенной жидкостью, фекалиями, мочой, слезами.
Для лепры характерен длительный инкубационный период – 3-5 и даже до 20-30 лет, поэтому из памяти больного исчезают события, с которыми они могли бы связать заражение.
Механизм и пути передачи инфекции до конца не выяснены из-за трудности их изучения. Считается, что заражение происходит при непосредственных длительных и тесных бытовых контактах (прямых и непрямых), а также воздушно-капельным путем. Старые авторы называют проказу болезнью домашнего сожительства. Доказана возможность внутриутробного заражения, но дети, отделенные от больных родителей после рождения, не заболевают. Существует предположение, что в распространении лепры могут играть роль кровососущие насекомые (блохи, вши, клопы, комары).
Входные ворота: полагают, что возбудитель попадает в организм человека через нарушенные кожные и слизистые покровы.
Ведущая роль в распространении принадлежит социально-экономическим факторам – неблагоприятным бытовым и жилищным условиям: скученность, низкая санитарная культура, низкий жизненный уровень.
Лица, контактирующие с больными, не опасны для окружающих.
Патогенез и клинические проявления.
Особенности болезни определяются следующими свойствами возбудителя:
- Медленное размножение (инкубационный период до 20 лет) и хроническое течение;
- Поражение нервной системы ведет к инвалидности;
- Оптимальная температура ниже 37 0 С, следовательно, поражаются охлаждаемые ткани;
- Вызывает иммунологическую толерантность у людей с лепроматозной формой, и такие пациенты становятся главным источником заражения.
M. leprae проникает в нервные окончания, а оттуда в лимфатические и кровеносные капилляры, не вызывая видимых поражений в месте внедрения. В большинстве случаев возбудитель погибает и элиминируется, или болезнь протекает латентно, не проявляясь в течение всей жизни. Проявление заболевания прямо зависит от состояния факторов резистентности. При небольших отклонениях развивается абортивная инфекция в виде ограниченных гранулематозных высыпаний (иногда могут самопроизвольно исчезать).
Классификация лепры (Ридли-Джоплинга):
1. ТТ-тип – у лиц с хорошим иммунитетом развивается относительно доброкачественная туберкулоидная форма. Она характеризуется образованием гранулем из эпителиоидных и гигантских клеток, окруженных лимфоцитарным валом, на коже и слизистых оболочках, а также поражением периферических нервов, реже поражаются внутренние органы. Кожные элементы сыпи (одиночные слегка пигментированные пятна, папулезные высыпания, бляшки расположенные ассиметрично) постепенно рассасываются, оставляя местную анестезию, атрофию (не растут волосы, не функционируют потовые железы). Поражение периферических нервов приводит к нарушению чувствительности, а поражение крупных стволов к парезам, параличам, контрактуре пальцев, трофическим язвам.
3. Промежуточное положение занимает недифференцированная форма, встречаемая у людей с неустойчивым иммунитетом. Протекает с поражением периферических нервов и слабо выраженными кожными проявлениями. Со временем (3-5лет) этот тип трансформируется в туберкулоидный или лепроматозный.
4. Кроме того, различают погранично-туберкулоидную, пограничную и погранично-лепроматозную формы.
Естественная резистентность высокая. В результате контактов с больными заболевают далеко не все (не более 1-2 из каждых 100 контактных). Однако все факторы, способствующие ослаблению иммунитета, повышают риск заболеваемости. Известно много случаев, когда члены семьи больного, жившие с ними с самого начала заболевания, оставались долгое время здоровыми, что может свидетельствовать о формировании иммунитета у контактирующих с больными. Это подтверждается также в очень редких случаях заболевания лепрой врачей, обслуживающего персонала лепрозориев – в редких случаях, когда нарушались, установленные там правила, и контакт с больными выходили за пределы официальных отношений.
Более частая заболеваемость детей, по всей вероятности, связана с несовершенством их иммунной системы.
В процессе заболевания возникают изменения иммунокомпетентных клеток: снижается количество Т-лимфоцитов, падает их активность – в результате теряется способность реагировать на антигены возбудителя (формирование расщепленной толерантности к M. leprae). Гуморальный иммунитет не нарушается – в сыворотке крови больных обнаруживаются антитела к микобактериям лепры в высоких титрах, но они не играют защитной роли.
Для определения активности иммунитета больных, с диагностической целью, а также для определения эффективности лечения применяется проба Мицуды – кожная проба с лепромином. Лепромин – автоклавированная или прокипяченная взвесь лепроматозной ткани. Вводится внутрикожно по 0,1 мл. Стандартный препарат лепромина содержит в 1,0 мл 100 млн. микобактерий лепры. Реакция положительна у здоровых людей и у больных туберкулоидной формой. Отрицательна – при лепроматозной форме, что свидетельствует о резком снижении иммунитета. Различают раннюю реакцию (48 ч) – гиперемия, небольшая папула и позднюю реакцию, которая появляется через 2-4 недели в виде бугорка, узелка, иногда с некрозом.
Исследуемый материал – соскоб слизистой оболочки носа (с обеих сторон перегородки), содержимое лепрозных узлов, мокрота, отделяемое язв, пунктаты лимфатических узлов, кусочки органов, кровь (в период лихорадки).
1. Бактериоскопический метод (основной).
2. Биологический метод.
3. Аллергологический метод – проба Мицуды для определения способности к иммунному ответу.
4. Молекулярно-биологический метод – ПЦР, ДНК-гибридизация.
Профилактика и лечение.
Специфической профилактики (создана экспериментальная вакцина) и лечения нет.
Основные мероприятия неспецифической профилактики:
- Раннее выявление больных и изоляция их в лепрозории, где они пребывают до излечения;
- Наблюдение за членами семьи больного и их обследование первые 10 лет – 2 раза в год, в дальнейшем – 1 раз в год;
- Новорожденные дети сразу же изолируются от больной матери и вскармливаются искусственно, затем здоровые дети воспитываются в детском доме при лепрозории;
- Применяется превентивное введение вакцины БЦЖ населению тех районов, где часто встречается лепра.
Для лечения проказы испробовано огромное количество различных способов, включая и препараты золота (золото в разных соединениях убивает кислотоустойчивые бактерии) – кризолган, сольганол, санакризин; подсадки растительных и животных тканей с целью стимуляции иммунитета (йодистый калий).
Издавна применяется чаульмугровое масло, добываемое из тропических бобовых растений. Масло содержит ненасыщенные жирные кислоты, которые влияют на содержание в крови липазы, разрушающей клеточную оболочку бактерий.
В настоящее время основными средствами лечения проказы являются:
- Препараты сульфонового ряда (ДДС/дапсон – 4,4-диаминодифенилсульфон и др.);
- Рифампицин, клофазимин, фторхинолоны (офлоксацин);
- Противотуберкулезные препараты (фтивазид, тибон);
- Чаульмугровое масло и его препараты (мигрол, интилепрол).
Препаратами выбора считают: дапсон, рифампицин и клофазимин, применяемые отдельно или в комбинации.
Лечение проводится комплексное, длительными курсами и иногда пожизненно.
Читайте также:


