Кампилобактер и хеликобактер разница

Цена:
Авторы работы:
Научный журнал:
Год выхода:
МИКРОБИОЛОГИЯ, 2010, том 79, № 6, с. 779-781
ИЗУЧЕНИЕ ВЗАИМОДЕЙСТВИЯ BDELLOVIBRIO BACTERIOVORUS С БАКТЕРИЯМИ CAMPYLOBACTER JEJUNI И HELICOBACTER PYLORI
Институт фундаментальных проблем биологии РАН, Пущино Поступила в редакцию 05.11.2009 г.
Получены доказательства взаимодействия Bdellovibrio bacteriovorus 100 NCJB с бактериями Campylobacter jejuni (штаммы 1, 2, 3, 4, 5) и Helicobacter pylori ТХ30а. Литическое действие бделловибрионов имело место как в суспензионных культурах бактерий, так и при их развитии в адгезированном (на пластике) состоянии. Обсуждается возможность использования антибактериального потенциала бактерий-хищников в решении проблем биозащиты экосистем и здоровья населения.
Ключевые слова: хищные бактерии Bdellovibrio, Campylobacter jejuni, Helicobacter pylori, антибактериальный потенциал.
Естественные компоненты экосистемы — грамотрицательные бактерии-хищники, относимые к роду Bdellovibrio, паразитируют на других грамот-рицательных бактериях, в том числе патогенных, вызывая их гибель. Попытки использовать активность хищных бактерий для уничтожения нежелательной микрофлоры были давно, в том числе имеется французский патент, предлагающий использование бделловибрионов для лечения желудочно-кишечных заболеваний человека [1]. Однако эти исследования не нашли дальнейшего применения, поскольку в них оперировали суспензией клеток Bdellovibrio, которая быстро теряла активность. Необходимо было изыскать другой способ интродукции хищных бактерий в загрязненные источники. Главной проблемой являлось то, что со времени открытия бделловибрионов [2], жизненный цикл которых состоит из двух стадий — свободноживущей непродуктивной и внутриклеточной репродуктивной (бделлопласты). Их рассматривали как свободноживущих обитателей водной фазы, поэтому все эксперименты с этими бактериями проводились только с жидкой культурой. Позже было доказано, что бактерии-хищники существуют в природе в прикрепленном к поверхности состоянии [3]. Нами было выяснено, что основной формой их существования являются не свободноживущие бактерии, а их внутриклеточная форма [4], и разработан метод иммобилизации бактериальной системы хищник-жертва как удобной экспериментальной модели изучения феномена бактериального хищничества [4—7].
Цель настоящей работы — установить возможность взаимодействия бактерий-хищников B. bacteriovorus с клетками Campylobacter jejuni и Helicobacter
1 Адрес для корреспонденции (е-mail: nmarkelova@ mail.ru).
pylori, часто встречающимися в окружающей среде и способными вызывать желудочно-кишечные заболевания.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования была бактерия-хищник Bdellovibrio bacteriovorus 100 NCJB 9529, полученная от проф. Н. Stolp, Германия [2]. В качестве бактерии-хозяина использовали Esherichia coli ИБФМ В-102 из коллекции ВКМ, а также Campylobacter jejuni (штаммы 1, 2, 3, 4, 5) и Helicobacter pylori ТХ30а, полученные из лаборатории доктора Shahamat, США. Бактерии В. bacteriovorus и Е. coli культивировали, как было описано ранее [2, 5]. С. jejuni и Н. pylori выращивали на 7% кровяном агаре.
Спектры литического действия бделловибрио-нов определяли как в их суспензионных жидких культурах, так и при иммобилизации клеток на поверхности прозрачного пластикового носителя диаметром 12 мм "Fisher Scientific" (США), как описано ранее [5]. Количество клеток бактерий-жертв при их взаимодействии с бделловибионами определяли по разнице численности колониеобразующих единиц (КОЕ) до и после взаимодействия. Подсчет количества свободных и внутриклеточных (бделлопластов) клеток бделловибрионов и интактных клеток бактерий-жертв проводили методом двухслойного агара [2] и выражали числом бляшкообразующих единиц (БОЕ). Концентрация клеток С. jejuni и H. pylori до начала взаимодействия составляла 2.0 х 1010 кл/мл, а концентрация В. bacteriovorus — 3.0 х 103 кл/мл. Для окрашивания препаратов использовали краситель акридиновый оранжевый. В исследованиях использовали световой микроскоп Axioscope-40 ("Zeiss", Германия) и эпифлуоресцентный микроскоп Bx60 ("Olympus Optical Co., LTD", Япония).
Эффективность литического действия В. bacteriovorus в отношении клеток бактерий С. jejuni и Н. pylori
Эффективность литического действия
суспензия клеток клетки на поверхности носителя
Бактерия-жертва КОЕ/мл БОЕ/мл Взаимодействие*
С. jejuni (шт. 1, 2, 3) 2.0 х 1010 0 0
С. jejuni (шт. 4) 7.0 х 104 2.0 х 104 +
С. jejuni (шт. 5) 1.0 х 104 6.0 х 103 +
H. pylori 5.6 х 103 9.0 х 106 +
Примечание. Результаты учитывали через 24 ч взаимодействия. * Оценивается визуально при просмотре микрофотографий.
Опыты проводили в четырех повторностях, в статье приведены их средние значения.
Основные факты
- Campylobacter является одной из четырех основных причин диарейных болезней во всем мире. Эта бактерия считается наиболее распространенной в мире бактериальной причиной гастроэнтерита у людей.
- Инфекции Campylobacter протекают в основном в легкой форме, но могут приводить к летальному исходу у детей раннего возраста, пожилых людей и людей с ослабленным иммунитетом.
- Бактерии рода Campylobacter погибают под воздействием высоких температур и при надлежащем приготовлении пищи путем тепловой обработки.
- Для профилактики инфицирования бактериями Campylobacter следует готовить пищу в соответствии с основными практическими правилами пищевой гигиены.
В связи с широкой распространенностью диареи, вызванной бактериями Campylobacter, а также ее продолжительностью и возможными осложнениями, ее социально-экономическое значение весьма велико. В развивающихся странах инфекции Campylobacter особенно часто встречаются у детей младше 2 лет, причем иногда они заканчиваются летальным исходом.
Бактерии Campylobacter имеют преимущественно спиралевидную, S-образную или изогнутую, палочкообразную форму. В настоящее время к роду Campylobacter относят 17 видов и 6 подвидов, из которых наиболее часто вызывают заболевания у людей C. jejuni (подвид jejuni) и C. coli. У пациентов с диарейными заболеваниями были изолированы и другие виды, такие как C. lari и C. upsaliensis, но эти виды регистрируются реже.
Заболевание
Кампилобактериоз — заболевание, которое вызывается инфицированием бактерией Campylobacter.
- Симптомы болезни обычно развиваются через 2-5 дней после инфицирования бактерией, но могут развиваться и через 1-10 дней.
- Наиболее распространенными клиническими симптомами инфекций Campylobacter являются диарея (часто с кровью в фекалиях), боли в области живота, повышенная температура, головная боль, тошнота и/или рвота. Обычно симптомы длятся от 3 до 6 дней.
- Кампилобактериоз редко заканчивается летальным исходом, который, как правило, отмечается только среди детей самого раннего возраста, пожилых людей или людей, уже страдающих какой-либо другой тяжелой болезнью, такой как СПИД.
- С разной степенью частоты были зарегистрированы такие осложнения, как бактериемия (наличие бактерий в крови), гепатит, панкреатит (соответственно, инфекции печени и поджелудочной железы) и самопроизвольный аборт. Постинфекционные осложнения могут включать в себя реактивный артрит (болезненное воспаление суставов, которое может продолжаться несколько месяцев) и неврологические расстройства, такие как синдром Гийена-Барре, подобная полиомиелиту форма паралича, которая в редких случаях может приводить к дыхательной и тяжелой неврологической дисфункции.
Источники и передача инфекции
Виды Campylobacter широко распространены среди большинства теплокровных животных. Они часто встречаются в организме животных, продукты которых используются в пищу, таких как домашняя птица, крупный рогатый скот, свиньи, овцы и страусы, а также у домашних животных, включая кошек и собак. Кроме того, эти бактерии были обнаружены у моллюсков.
Считается, что инфекция передается в основном пищевым путем — через мясо и мясные продукты, прошедшие недостаточную тепловую обработку, а также через сырое или загрязненное молоко. Загрязненные вода или лед также являются источником инфекции. Определенная доля случаев заболевания бывает вызвана контактом с загрязненной водой во время рекреационных мероприятий.
Кампилобактериоз является зоонозом — болезнью, передаваемой человеку от животных или из продуктов животного происхождения. Чаще всего туши или мясо загрязняются Campylobacter из фекалий во время забоя. При этом у животных Campylobacter редко приводит к заболеваниям.
Относительное значение каждого из вышеперечисленных источников для общего бремени болезни неизвестно, но основным фактором считается потребление зараженного мяса домашней птицы, прошедшего недостаточную тепловую обработку. Поскольку на вспышки болезни, связанные с общим источником инфекции, приходится довольно незначительная процентная доля случаев, подавляющее большинство случаев заболевания регистрируется как спорадические, без четко прослеживаемых моделей.
Следовательно, оценить значимость всех известных источников инфекции чрезвычайно сложно. Кроме того, широкая распространенность Campylobacter затрудняет разработку стратегий борьбы с инфекцией на протяжении всей продовольственной цепи. Тем не менее, в странах, где применяются целенаправленные стратегии по уменьшению распространенности Campylobacter среди живой домашней птицы, наблюдается аналогичное уменьшение случаев заболевания среди людей.
Лечение
Лечения, как правило, не требуется, за исключением возмещения электролитов и регидратации. Противомикробная терапия рекомендуется в инвазивных случаях (когда бактерии проникают в клетки слизистой оболочки кишечника и разрушают ткани) или для ликвидации состояния носительства (состояние людей, являющихся носителями Campylobacter и выделяющих бактерии, но не обнаруживающих симптомов заболевания).
Методы профилактики
Существует ряд стратегий, которые могут использоваться для профилактики болезни, вызванной бактериями Campylobacter:
- Профилактика основывается на контрольных мерах во всех звеньях пищевой цепи — от сельскохозяйственного производства до обработки, производства и приготовления пищевых продуктов как с коммерческой целью, так и в домашних условиях.
- В странах, где отсутствуют надлежащие системы канализации, возможно, будет необходимо дезинфицировать фекалии и продукты, загрязненные фекалиями, перед утилизацией.
- Меры по сокращению распространенности Campylobacter среди домашней птицы включают в себя укрепление биобезопасности во избежание передачи Campylobacter из окружающей среды поголовью птиц на ферме. Эта мера контроля осуществима только в том случае, если птицы содержатся в закрытом помещении.
- Практика забоя с соблюдением надлежащих правил гигиены позволяет сократить загрязнение тушек фекалиями, но не гарантирует отсутствие бактерий Campylobacter в мясе и мясопродуктах. Чтобы свести загрязнение к минимуму, чрезвычайно важна подготовка работников, осуществляющих забой животных, и производителей сырого мяса в области гигиенической обработки и приготовления пищевых продуктов.
- Профилактические меры защиты от инфекции на домашней кухне схожи с мерами, принимаемыми для защиты от других бактериальных болезней пищевого происхождения.
- Единственным эффективным методом уничтожения Campylobacter в зараженных пищевых продуктах является бактерицидная обработка, такая как нагревание (например, приготовление пищи посредством тепловой обработки или пастеризация) или облучение.
Деятельность ВОЗ
В сотрудничестве с другими заинтересованными сторонами ВОЗ решительно отстаивает важную роль безопасности пищевых продуктов как одной из ключевых составляющих обеспечения доступа к безопасной и питательной диете. ВОЗ разрабатывает меры политики и рекомендации, охватывающие всю пищевую цепь от производства до потребления, опираясь при этом на разные виды экспертных знаний и опыта в различных областях.
ВОЗ работает над укреплением систем обеспечения безопасности пищевых продуктов во все более глобализованном мире. Установление международных стандартов безопасности пищевых продуктов, повышение качества эпиднадзора за болезнями, просвещение потребителей и подготовка лиц, занимающихся обработкой и приготовлением пищевых продуктов, в области безопасного обращения с пищевыми продуктами входят в число важнейших способов предотвращения болезней пищевого происхождения.
ВОЗ укрепляет потенциал национальных и региональных лабораторий в области эпиднадзора за патогенами пищевого происхождения, такими как Campylobacter и Salmonella.
Кроме того, ВОЗ способствует комплексному эпиднадзору за устойчивостью патогенов, присутствующих в пищевой цепи, к противомикробным препаратам, собирая образцы у людей и животных и образцы пищевых продуктов и анализируя данные, полученные в разных секторах.
ВОЗ совместно с ФАО оказывает помощь государствам-членам, координируя международные усилия по раннему выявлению вспышек болезней пищевого происхождения и соответствующим ответным мерам через сеть национальных органов в государствах-членах.
Кроме того, ВОЗ осуществляет научную оценку, которая используется в качестве основы для разрабатываемых Комиссией ФАО/ВОЗ по Кодекс алиментариус международных стандартов, принципов и рекомендаций в отношении пищевых продуктов для профилактики болезней пищевого происхождения.
Рекомендации для населения и лиц, совершающих поездки
Обеспечить безопасность во время поездок помогут следующие рекомендации:
- Обеспечить, чтобы пищевые продукты прошли надлежащую тепловую обработку и были все еще горячими при их подаче.
- Избегать употребления сырого молока и продуктов, приготовленных из сырого молока. Пить только пастеризованное или кипяченое молоко.
- Избегать употребления льда, если только он не был изготовлен из безопасной воды.
- Употребляйте лед только в том случае, когда он сделан из безопасной воды.
- При наличии сомнения в безопасности воды, прокипятить ее или, если это невозможно, продезинфицировать ее с помощью какого-либо надежного дезинфицирующего вещества медленного действия (обычно такие вещества можно приобрести в аптеках).
- Тщательно мыть руки и часто использовать мыло, особенно после контактов с домашними или сельскохозяйственными животными, а также после посещения туалета.
- Тщательно мыть фрукты и овощи, особенно при их потреблении в сыром виде. По возможности снимать кожуру с овощей и фруктов.
- Руководство по безопасным пищевым продуктам для туристов
Рекомендации для лиц, занимающихся обработкой и приготовлением пищевых продуктов
ВОЗ сформулировала следующие рекомендации для лиц, занимающихся обработкой и приготовлением пищевых продуктов:
Спиралеобразная форма бактерии, от которой, собственно, и произошло родовое название Helicobacter, как полагают, связана с приобретением этим микроорганизмом в ходе эволюции способности проникать в слизистую оболочку желудка и двенадцатиперстной кишки, и с тем, что такая форма облегчает её движение в слизистом геле, покрывающем слизистую оболочку желудка. [2]
История открытия
В 1875 году немецкие учёные обнаружили спиралевидную бактерию в слизистой оболочке желудка человека. Эта бактерия не росла в культуре (на известных в то время искусственных питательных средах), и это случайное открытие было в конце концов забыто. [3]
В 1893 году итальянский исследователь Джулио Биззоцеро описал похожую спиралевидную бактерию, живущую в кислом содержимом желудка собак. [4]
Бактерия была вновь открыта в 1979 году австралийским патологом Робином Уорреном, который затем провёл дальнейшие исследования её вместе с Барри Маршаллом, начиная с 1981 года. Уоррену и Маршаллу удалось выделить и изолировать этот микроорганизм из проб слизистой оболочки желудка человека. Они также были первыми, кому удалось культивировать этот микроорганизм на искусственных питательных средах. [6] В оригинальной публикации [7] Уоррен и Маршалл высказали предположение, что большинство язв желудка и гастритов у человека вызываются инфицированием микроорганизмом Helicobacter pylori, а не стрессом или острой пищей, как предполагалось ранее. [8]
Медицинское и научное сообщество медленно и неохотно признавали патогенетическую роль этой бактерии в развитии язв желудка и двенадцатиперстной кишки и гастритов, вследствие распространённого в то время убеждения, что никакой микроорганизм не в состоянии выжить сколько-нибудь длительное время в кислом содержимом желудка. Признание научным сообществом этиологической роли этого микроба в развитии заболеваний желудка начало постепенно приходить лишь после того, как были проведены дополнительные исследования. Один из наиболее убедительных экспериментов в этой области был поставлен Барри Маршаллом: он сознательно выпил содержимое чашки Петри с культурой бактерии H. pylori, после чего у него развился гастрит. [9] Бактерия была обнаружена в слизистой его желудка, тем самым были выполнены три из четырёх постулатов Коха. Четвёртый постулат был выполнен, когда на второй эндоскопии, спустя 10 дней после преднамеренного заражения, были обнаружены признаки гастрита и присутствие H. pylori. Затем Маршалл сумел продемонстрировать, что он в состоянии излечить свой хеликобактерный гастрит с помощью 14-дневного курса лечения солями висмута и метронидазолом. [9] Маршалл и Уоррен затем пошли дальше и сумели показать, что антибиотики эффективны в лечении многих, если не большинства, случаев гастрита и язв желудка и двенадцатиперстной кишки. [9]
В 1994 году Американский Национальный Институт Здравоохранения опубликовал экспертное мнение, в котором утверждалось, что большинство рецидивирующих язв желудка и гастритов с повышенной кислотностью вызываются инфицированием микробом H. pylori, и рекомендовал включать антибиотики в терапевтические режимы при лечении язвенной болезни желудка, а также гастритов с повышенной кислотностью. [10] Постепенно накапливались данные также о том, что язвы двенадцатиперстной кишки и дуодениты также ассоциированы с инфицированием H. pylori. [11] [12]
В 2005 году первооткрыватели медицинского значения бактерии Робин Уоррен и Барри Маршалл были удостоены Нобелевской премии по медицине. [13]
До того, как стала понятна роль инфекции Helicobacter pylori в развитии язвенной болезни желудка и двенадцатиперстной кишки и гастритов, язвы и гастриты обычно лечили лекарствами, которые нейтрализуют кислоту (антациды) или снижают её продукцию в желудке (ингибиторы протонного насоса, блокаторы H2-гистаминовых рецепторов, М-холинолитики и др.). Хотя такое лечение в ряде случаев бывало эффективным, язвы и гастриты весьма часто рецидивировали после прекращения лечения. Весьма часто используемым препаратом для лечения гастритов и язвенной болезни желудка и двенадцатиперстной кишки был висмута субсалицилат (пепто-бисмол). Он часто был эффективен, но вышел из употребления, поскольку его механизм действия оставался непонятным. Сегодня стало понятно, что эффект пепто-бисмола был обусловлен тем, что соли висмута действуют на Helicobacter pylori как антибиотик. На сегодняшний день большинство случаев язв желудка и двенадцатиперстной кишки, гастритов и дуоденитов с доказанной лабораторными тестами хеликобактерной этиологией, особенно в развитых странах, лечат антибиотиками, эффективными против Helicobacter pylori. [14]
Хотя H. pylori остаётся наиболее медицински значимой бактерией, способной обитать в желудке человека, у других млекопитающих и некоторых птиц были найдены другие представители рода Helicobacter. Некоторые из них способны заражать и человека. Виды рода Helicobacter были также обнаружены в печени некоторых млекопитающих, причём они способны вызывать поражения и заболевания печени. [15]
Систематика
Многие виды рода Helicobacter являются патогенными для человека и животных и обитают в ротовой полости, желудке, различных отделов кишечника человека и животных (патогенными для человека и животных кроме H. pylori являются также виды H. nemestrinae, H. acinonychis, H. felis, H. bizzozeronii и H. salomonis)). [18] Наибольший уровень сходства по результатом ДНК-ДНК гибридизации отмечен между видами H. pylori и H. mustelae. [18]
Виды рода Helicobacter являются единственными известными на сегодняшний день микроорганизмами, способными длительно выживать в чрезвычайно кислом содержимом желудка и даже колонизировать его слизистую. [19]
Разработано много методов определения как внутривидовой дифференциации штамов H. pylori, так и для дифференцировки от других видов рода Helicobacter, такие как биотипические, и серологические методы, методы определения уреазной активности и токсинообразования, так и молекулярные — белковый электрофорез клеточного лизата, метод определения полиморфизма длин рестрикционных фрагментов (ПДРФ), полимеразная цепная реакция (ПЦР), секвенирование 16S рибосомальной РНК [18] Показан высокий уровень внутривидового полиморфизма штаммов H. pylori по сравнению с крайне близким видом H. mustelae, проявляющим высокий уровень консерватизма. Полиморфизм заключается в однонуклеотидных заменами, а также крупных внутригеномных перестройках, и высоких частотах трансформации. [18]
Типовые штаммы H. pylori: ATCC 43504, DSM 4867, JCM 7653, LMG 7539, NCTC 11637. [18]
Строение
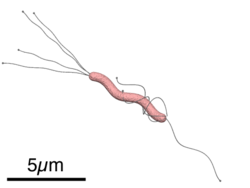
Helicobacter pylori — спиралевидная грамотрицательная бактерия, около 3 мкм в длину, диаметром около 0,5 мкм. Она обладает 4-6 жгутиками и способностью чрезвычайно быстро двигаться даже в густой слизи или агаре. Она микроаэрофильна, то есть требует для своего развития наличия кислорода, но в значительно меньших концентрациях, чем содержащиеся в атмосфере.
Бактерия содержит гидрогеназу, которая может использоваться для получения энергии путём окисления молекулярного водорода, продуцируемого другими кишечными бактериями. [20] Бактерия также вырабатывает оксидазу, каталазу и уреазу.
Helicobacter pylori обладает способностью формировать биоплёнки (англ.) , способствующие невосприимчивости бактерии к антибиотикотерапии и защищающие клетки бактерий от иммунного ответа хозяина. [21] Предполагают, что это увеличивает её выживаемость в кислой и агрессивной среде желудка.
Кокковидные клетки отличаются деталями строения клеточной стенки (преобладанием N-ацетил-D-глюкозаминил-β(1,4)-N-ацетилмурамил-L-Ала-D-Глю мотива в пептидогликане клеточной стенки (GM-дипептида)), изменение строения клеточной стенки приводит к неузнаванию бактерии иммунной системой хозяина (бактериальная мимикрия). [23]
Геном
Известно несколько штаммов Helicobacter pylori, и геном двух из них полностью секвенирован. [24] [25] [26]
Ген cagA кодирует один из важнейших белков вирулентности H. pylori. Штаммы, имеющие ген cagA ассоциированны со способностью вызывать тяжёлые формы язвы желудка. Ген cagA кодирует белок длинной 1186 аминокислотных остатка. Белок cagA транспортируется внутрь клеток, где он нарушает нормальное функционирование цитоскелета. Остров патогенности Cag состоит из примерно 30 генов, кодирующих сложную систему секреции типа IV. [27] . После адгезии H.pylori к клеткам эпителия желудка, cagA впрыскивается в клетку посредством системы секреции типа IV. Белок cagA фосфолирируется тирозиновыми протеинкиназами клетки и взаимодействует с фосфатазой Src, изменяя морфологию клеток. [28] Вирулентные штаммы H. pylori способны активировать рецептор эпидермального фактора роста (epidermal growth factor receptor, EGFR), мембранный белок с тирозинкиназным доменом. Активация EGFR H. pylori ассоциирована с изменённой сигнальной трансдукцией и изменением профиля экспрессии генов клетки хозяина, что может влиять на течение патологического процесса. [29]
Показана синергетичность действия генов babA2, cagA, и s1 vacA при патологическом процессе, вовлечённом в метаплазии кишечника. [30] Продукты генов cagA и babA2 идентифицируются иммуногистохимически, гистологически и при помощи in situ гибридизации при метаплазии кишечника и злокачественных новообразованиях желудка, ассоциированных с хеликобактерной инфекцией и могут служить возможными диагностическими маркерами. [31]
Также идентифицированы некоторые гены, ассоциированные со способностью к колонизации эпителия желудка, такие как flg, flh, tlp (отвечают за наличие жгутиков и хемотаксис), ureA, nixA, amiE (гены, отвечающие за синтез уреазы и продукцию аммиака), fur, pfr, fecA, frpB (гены, отвечающие за метаболизм железа), sod, hptG (ответ на стресс), и algA, rfaJ, lpxB (гены, отвечающие за биосинтез липополисахарида и экзополисахарида). [32] Показана роль в реакциях Helicobacter pylori на внешние раздражители продукта гена tlpD, предположительно кодирующего сенсорный белок. [33]
Факторы вирулентности
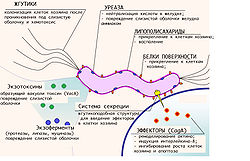
Способность H. pylori колонизировать слизистую желудка и вызывать гастрит либо язву желудка зависит не только от состояния иммунитета организма хозяина, но и от индивидуальных особенностей конкретного штамма бактерии. [34]
Одним из важных факторов вирулентности хеликобактер является наличие у неё жгутиков, благодаря которым обеспечивается быстрое движение микроорганизма в слое густой слизи, защищающей слизистую желудка от воздействия кислоты, её хемотаксис в места скопления других бактерий этого вида и быстрая колонизация слизистой.
Липополисахариды и белки наружной оболочки бактерии обладают свойством адгезии к наружной оболочке мембран клеток слизистой желудка. Кроме того, липополисахариды наружной оболочки H. pylori вызывают иммунный ответ организма хозяина и развитие воспаления слизистой.
Секретируемые бактерией во внешнюю среду литические ферменты — муциназа, протеаза, липаза — вызывают деполимеризацию и растворение защитной слизи (состоящей в основном из муцина) и повреждение слизистой желудка.
Очень важную роль в вирулентности бактерии и в её способности выживать в кислом содержимом желудка играет секреция бактерией уреазы — фермента, расщепляющего мочевину с образованием аммиака. Аммиак нейтрализует соляную кислоту желудка и обеспечивает бактерии локальное поддержание комфортного для неё pH (около 6-7).
Продукция хеликобактером различных экзотоксинов, в частности, вакуолизирующего экзотоксина (продукта гена vacA), также вызывает вакуолизацию, повреждение и гибель клеток слизистой желудка.
Штаммы H. pylori, выделенные от больных с язвой желудка или двенадцатиперстной кишки, как правило, проявляют большую биохимическую агрессивность, чем штаммы, выделенные от больных с гастритом, а штаммы, выделенные от больных с гастритом, обычно более агрессивны и вирулентны, чем штаммы, выделенные от бессимптомных носителей. [34] В частности, штаммы, выделенные от больных с язвенной болезнью, чаще бывают cagA-положительными (то есть продуцирующими cagA эффекторные белки). Штаммы, выделенные от больных с гастритом, чаще продуцируют экзотоксин vacA, чем штаммы, выделенные от бессимптомных носителей. [37] [38]
Патогенетические механизмы
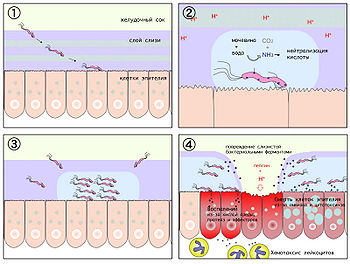
На начальном этапе после попадания в желудок H. pylori, быстро двигаясь при помощи жгутиков, преодолевает защитный слой слизи и колонизирует слизистую оболочку желудка. Закрепившись на поверхности слизистой, бактерия начинает вырабатывать уреазу, благодаря чему в слизистой оболочке и слое защитной слизи поблизости от растущей колонии растёт концентрация аммиака и повышается pH. По механизму отрицательной обратной связи это вызывает повышение секреции гастрина клетками слизистой желудка и компенсаторное повышение секреции соляной кислоты и пепсина, с одновременным снижением секреции бикарбонатов.
Муциназа, протеаза и липаза, вырабатываемые бактерией, вызывают деполимеризацию и растворение защитной слизи желудка, в результате чего соляная кислота и пепсин получают непосредственный доступ к оголённой слизистой желудка и начинают её разъедать, вызывая химический ожог, воспаление и изъязвление слизистой оболочки.
Диагностика инфекции
Диагностика геликобактерной инфекции обычно производится путём опроса больного на наличие диспептических жалоб и симптомов, и затем выполнения тестов, которые могут помочь подтвердить или опровергнуть факт наличия хеликобактерной инфекции.
Неинвазивные (не требующие эндоскопии) тесты на наличие хеликобактерной инфекции включают в себя определение титра антител в крови к антигенам H. pylori, определение наличия антигенов H. pylori в кале, а также уреазный дыхательный тест, состоящий в том, что пациент выпивает раствор меченой 14C- или 13C-углеродом мочевины, которую бактерия расщепляет с образованием меченой, соответственно, 14 C- или 13 C- двуокиси углерода, которая затем может быть обнаружена в выдыхаемом воздухе при помощи масс-спектрометрии.
Существуют также уреазные дыхательные тесты, основанные на определении концентрации аммиака в выдыхаемом воздухе. [42] Данные методы предполагают приём пациентом мочевины нормального изотопного состава и последующее измерение концентрации аммиака с помощью газоанализатора. К достоинствам метода можно отнести невысокую стоимость обследования, скорость получения результатов, высокую чувствительность (96 %), значительно меньшую стоимость оборудования по сравнению с масс-спектрографами.
Ни один из методов диагностики хеликобактерной инфекции не является полностью достоверным и защищённым от диагностических ошибок и неудач. В частности, результативность биопсии в диагностике хеликобактерной инфекции зависит от места взятия биоптата, поэтому при эндоскопическом исследовании обязательно взятие биоптатов из разных мест слизистой желудка. Тесты на наличие антител к антигенам хеликобактера имеют чувствительность всего лишь от 76 % до 84 %. Некоторые лекарства могут повлиять на активность уреазы, продуцируемой хеликобактером, в результате чего при исследовании уреазной активности при помощи меченой мочевины могут получиться ложноотрицательные результаты.
Хеликобактер был выделен из кала, слюны и зубного налёта инфицированных пациентов, что объясняет возможные пути передачи инфекции — фекально-оральный или орально-оральный (например, при поцелуях, пользовании общей посудой, общими столовыми приборами, общей зубной щёткой или анилингусе). Возможно (и весьма часто встречается) заражение хеликобактером в учреждениях общественного питания. Иногда возможно заражение через инфицированные эндоскопы при проведении диагностической гастроскопии.
Считается, что в отсутствие лечения хеликобактерная инфекция, однажды колонизировав слизистую желудка, может существовать в течение всей жизни человека несмотря на иммуный ответ хозяина. [44] [45] Однако у пожилых людей, а также у больных с давно существующим гастритом, хеликобактерная инфекция, вероятно, может самостоятельно исчезать, поскольку с возрастом или с давностью заболевания гастритом слизистая желудка становится всё более атрофичной, истончённой и менее пригодной для колонизации хеликобактером, менее благоприятной для обитания микроба. Вместе с тем, атрофический гастрит у пожилых, или гастрит, перешедший в стадию атрофического гастрита после многих лет болезни, поддаётся лечению гораздо труднее, чем хеликобактерные гастриты.
Процент острых хеликобактерных инфекций, которые переходят в хроническую персистирующую форму, точно не известен, однако в нескольких исследованиях, в которых изучалось естественное течение болезни без лечения в человеческих популяциях, сообщалось о возможности спонтанного самоизлечения (спонтанной элиминации микроба-возбудителя). [46] [47]
Лечение Helicobacter pylori-ассоциированных заболеваний
У пациентов с язвой желудка, язвой двенадцатиперстной кишки и гастритом с доказанной хеликобактерной этиологией стандартным протоколом лечения является эрадикация Helicobacter pylori, то есть лечебный режим, направленный на полное уничтожение этого микроба в желудке с целью обеспечить условия для заживления язвы.
Отмечены случаи непродуктивности антибиотикотерапии хеликобактерной инфекции, связанные как с антибиотикорезистентностью, так и с наличием зон в желудочно-кишечном тракте, в которых бактерии защищены от действия антибиотиков. [52] Отмеченно появление полирезистентных к антибиотикам изолятов H. pylori [53] , в том числе и кларитромицин-резистентных штаммов. [54] Также отмечены случаи появления хинолон-резистентных штаммов H. pylori. [55]
Также ведутся исследования по поиску и синтезу более эффективных и менее токсичных препаратов, направленных на эрадикацию H. pylori, показана эффективность in vitro препарата TG44 [56] , препарат NE-2001 в опытах in vitro проявлял высокую селективность по отношению к H. pylori [57] Показана эффективность пероральной вакцинации клеточным лизатом H. pylori на мышиной модели. [58]
Читайте также: