Иммунохроматографический анализ при бруцеллезе

Используемые в настоящее время методы диагностики инфекционных заболеваний направлены в основном на определение возбудителя заболевания и его антигенов либо на выявление иммунного ответа инфицированного организма на антигены возбудителя. К последнему типу относятся методы серодиагностики – определения специфических антител в крови. Несмотря на то, что современные аналитические методы обеспечивают крайне низкий предел обнаружения, в ряде случаев серодиагностический подход оказывается предпочтительным. Гуморальный иммунный ответ всегда сопровождается значительным повышением концентрации специфических антител в крови, делая сыворотку крови универсальным материалом для диагностики разнообразных инфекционных заболеваний [1].
Серодиагностический подход наиболее оправдан при первичных обследованиях, а поскольку для массового скрининга решающее значение имеет скорость получения результата, представляется перспективным сочетание серодиагностики с таким простым и экспрессным методом, как иммунохроматографический анализ (ИХА). Результат ИХА может быть получен за 10–15 мин непосредственно на месте отбора пробы, без дополнительного оборудования и привлечения высококвалифицированного персонала.
Существенным ограничением для применения иммунохроматографии в серодиагностике является необходимость без разделения реагентов выявлять специфические антитела на фоне многократного избытка неспецифических антител. В настоящей работе на примере тест-системы для определения специфических антител против липополисахарида (ЛПС) Brucella abortus рассматривается подход, позволяющий обойти данное ограничение.
Материалы и методы
3. Получение коллоидного золота [6]. К 97,5 мл воды добавляли 1,0 мл 1 %-ного раствора золотохлористоводородной кислоты. Смесь доводили до кипения и при перемешивании добавляли 1,5 мл 1 %-ного раствора цитрата натрия. Кипятили 30 мин, затем охлаждали до комнатной температуры.
Для формирования аналитической зоны использовали препарат ЛПС Br. abortus. На 1 см полосы наносили 2 мкл препарата (1,0 мг/мл в дистиллированной воде).
5. Изготовление иммунохроматографических тест-систем [4, 5]. Полученные подложки и рабочие мембраны сушили на воздухе при 20–22 °C не менее 20 ч. Собирали мультимембранный композит, из которого получали полоски шириной 3,5 мм, используя автоматический гильотинный нарезчик Index Cutter-1 (“A-Point Technologies”, США). Тест-полоски помещали в пластиковые кассеты и герметично упаковывали в пакеты из ламинированной алюминиевой фольги с силикагелем в качестве осушителя с помощью запаивателя с миниконвейером FR-900 (“Wenzhou dingli packing machinery”, Китай).
Результаты и обсуждение
Традиционная схема иммунохроматографического анализа, применяемая для серодиагностики, предполагает взаимодействие всех антител, содержащихся в пробе, с конъюгатом коллоидного золота и реагента для связывания антител (обычно в качестве такового реагента используют антивидовые антитела, белок А Staphylococcus aureus или белок G Streptococcus spp.). После связывания части иммуноглобулинов в пробе конъюгат диффундирует по тест-полоске, и в аналитической зоне небольшая часть связанных иммуноглобулинов, специфичных к патогену, взаимодействует с иммобилизованным в аналитической зоне антигеном. Таким образом, сигнал ИХА (степень связывания окрашенной метки в аналитической зоне) в этом случае зависит не только от концентрации специфических антител, но и от общего содержания иммуноглобулинов в пробе, что не является диагностически значимым параметром и негативно сказывается на достоверности диагностики. Этот принцип лежит в основе разработанных на сегодняшний день ИХА тестов для серодиагностики бруцеллеза [2, 3].
В настоящей работе использован альтернативный подход, основанный на применении поливалентности антител. В данном формате ИХА коллоидное золото конъюгируется с тем же антигеном, который иммобилизован в аналитической зоне. Специфические антитела взаимодействуют разными валентностями с молекулами антигена, иммобилизованными на разных поверхностях: коллоидного золота и рабочей мембраны. В таком случае во взаимодействии принимают участие только специфические антитела.
В качестве антигена был использован ЛПС Br. abortus. Для определения предела обнаружения иммунохроматографических тестов использовали моноклональные антитела против ЛПС Brucella abortus. Чувствительность тестов составила 5 мкг/мл антител – как в буферном растворе, так и в сыворотке крупного рогатого скота, несмотря на то, что сыворотка содержит более 5 мг/мл общих иммуноглобулинов (рис. 1). Таким образом, предложенная тест-система позволяет выявлять менее 0,1 % специфических антител в пробе.
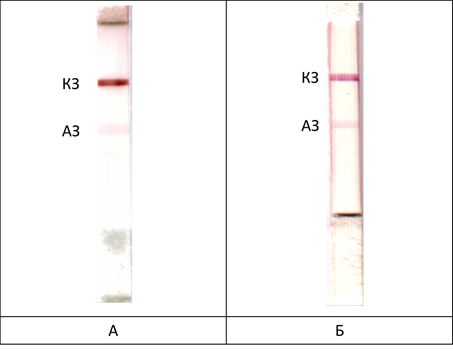
Рис. 1. Иммунохроматографическое выявление специфических антител (5 мкг/мл): А – в фосфатном буфере (pH 7,4); Б – в сыворотке крови крупного рогатого скота. АЗ – аналитическая зона, КЗ – контрольная зона
Разработанный тест был испытан на выборке из 39 коров, больных бруцеллезом. Данные иммунохроматографического тестирования сравнивали с данными иммуноферментного анализа (ИФА). В качестве унифицированной характеристики количества специфических антител в сыворотке использовали величину ее разведения, которая на асимптотической кривой титрования в ИФА соответствует оптической плотности 0,7. Полученные результаты приведены в табл. 1. Как видим, данные, полученные двумя методами, хорошо согласуются друг с другом.
Таблица 1. Результаты тестирования сывороток коров методами ИФА и ИХА
Номер патента: 30489





Скачать PDF файл.
Формула / Реферат
Способ изготовления тест-системы для диагностики бруцеллеза животных методом иммунохроматографического анализа
Изобретение относится к биотехнологии, в частности к способам получения диагностикумов для проведения иммунохроматографического анализа, и может быть использовано при диагностике бруцеллеза животных.
Для достижения указанной цели в способе изготовления тест-системы для диагностики бруцеллеза крупного рогатого скота методом иммунохроматографического анализа, на нитроцеллюлозную мембрану наносят антиген, выделенный из взвеси клеток штамма В. Abortus 19 экстракцией в горячем растворе хлорида натрия. Экстракт затем подвергают очистке методом гель-фильтрации на сефадексе. Вместе с антигеном на мембрану наносится вторая линия (контрольная), содержащая моноклональные антитела к легкой цепи иммуноглобулинов крупного рогатого скота.
На отдельную мембрану наносится конъюгат - белок G, меченый коллоидным золотом.
Сборку теста осуществляют последовательным наклеиванием на пластиковую адгезивную подложку мембран в следующем порядке:
-мембрана с нанесенными тестовой и контрольной полосой,
-адсорбирующуя мембрана,
-мембрана с коньюгатом,
-сепарирующая мембрана,
-мембрана для нанесения образца.
Предлагаемый способ позволяет получить более активную и специфичную иммунохроматографическую тест-систему для диагностики бруцеллеза у разных видов животных, позволяющий проводить анализ на сыворотке и на цельной крови.
11
Текст
(51) 61 39/40 (2006.01) 01 33/543 (2006.01) МИНИСТЕРСТВО ЮСТИЦИИ РЕСПУБЛИКИ КАЗАХСТАН ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ПАТЕНТУ бруцеллеза крупного рогатого скота методом иммунохроматографического анализа,на нитроцеллюлозную мембрану наносят антиген,выделенный из взвеси клеток штамма В.19 экстракцией в горячем растворе хлорида натрия. Экстракт затем подвергают очистке методом гельфильтрации на сефадексе. Вместе с антигеном на мембрану наносится вторая линия (контрольная),содержащая моноклональные антитела к легкой цепи иммуноглобулинов крупного рогатого скота. На отдельную мембрану наносится конъюгат белок , меченый коллоидным золотом. Сборку теста осуществляют последовательным наклеиванием на пластиковую адгезивную подложку мембран в следующем порядке-мембрана с нанесенными тестовой и контрольной полосой,-адсорбирующуя мембрана,-мембрана с коньюгатом,-сепарирующая мембрана,-мембрана для нанесения образца. Предлагаемый способ позволяет получить более активную и специфичную иммунохроматографическую тест-систему для диагностики бруцеллеза у разных видов животных,позволяющий проводить анализ на сыворотке и на цельной крови.(72) Чунчубаев Жолымхан Калиханович Рахимбаев Серик Жумадилович Шенжанов Канат Толюбаевич Нуралин Дулат Жанахметович Кемешов Жомарт Омирбекович(73) Товарищество с ограниченной ответственностью Бицентр Акционерное общество Национальный научно-технологический холдинг Парасат(54) СПОСОБ ИЗГОТОВЛЕНИЯ ТЕСТСИСТЕМЫ ДЛЯ ДИАГНОСТИКИ БРУЦЕЛЛЕЗА ЖИВОТНЫХ МЕТОДОМ ИММУНОХРОМАТОГРАФИЧЕСКОГО АНАЛИЗА(57) Изобретение относится к биотехнологии, в частности к способам получения диагностикумов для проведения иммунохроматографического анализа, и может быть использовано при диагностике бруцеллеза животных. Для достижения указанной цели в способе изготовления тест-системы для диагностики Изобретение относится к биотехнологии, в частности к способам получения диагностикумов для проведения иммунохроматографического анализа, и может быть использовано при диагностике бруцеллеза животных. Известен способ изготовления иммунохроматографического теста для диагностики бруцеллеза крупного рогатого скота 254604,15.02.2012,включающий нитроцеллюлозную мембрану с нанесенными антигеном и контрольными антителами, мембрану с конъюгатом коллоидного золота и антибычьих антител,мембрану для нанесения образца и адсорбирующую мембрану. Недостатком этого метода получения тест-системы является невозможность ее применения для диагностики бруцеллеза у других видов животных, а также исследование цельной крови. Задачей изобретения является создание тестсистемы для диагностики бруцеллеза у разных видов животных методом иммунохроматографического анализа при исследовании сыворотки крови и цельной крови. Сущность изобретения заключается в том, что в конъюгат вместо антивидовых антител вводят рекомбинантный белок , позволяющий проводить анализ на бруцеллез у нескольких видов животных,а также введение в состав тест-полоски дополнительной фильтрующей мембраны,позволяющей использовать для анализа не только сыворотку, но и цельную кровь. Для достижения указанной задачи в способе изготовления тест-системы для диагностики бруцеллеза животных методом иммунохроматографического анализа,сенсибилизацию нитроцеллюлозной мембраны осуществляют высокоочищенным липополисахаридным антигеном из В.штамм 19 (тестовая линия) и моноклональными антителами к легкой цепи иммуноглобулинов крупного рогатого скота (контрольная линия). Мембрану подсушивают и блокируют в растворе альбуминов. В качестве выявляющего агента выступает конъюгат коллоидного золота с белком ,обладающим видовой универсальностью в отношении антител большинства млекопитающих. Конъюгат наносят на заранее блокированную раствором альбуминов мембрану и высушивают. Сборка теста осуществляется на пластиковой адгезивной положке последовательным наклеиванием нитроцеллюлозной мембраны,мембраны с конъюгатом,адсорбирующей мембраны, фильтрующей мембраны и мембраны для нанесения образца. Готовые тесты нарезают на полоски и упаковывают в фольгированные пакеты с влагопоглотителем. Пример изготовления тест-системы для диагностики бруцеллеза животных методом иммунохроматографического анализа. Приготовление липополисахаридного антигена Осадок бактериальной массы автоклавируют. После автоклавирования клетки ресуспендируют в 0,2 М растворе хлорида натрия, нагретого до 60 С. Ресуспендированные клетки выдерживают при 66 С на водяной бане в течение 3 ч. Суспензию остужают и центрифугируют при 10 000 об/мин 15 мин при 4 С. Отбирают надосадок и добавляют к нему 3 объема холодного перегнанного этанола и 1 этанола, насыщенного ацетатом натрия. Оставляют на ночь при 4 С для формирования осадка. Сформировавшийся осадок центрифугируют 10 мин при 10 000 об/мин. Супернатант отбрасывают,а осадок ресуспендируют в трис-буфере, содержащем 1 мМ ЭДТА и 0,5 дезоксихолата натрия в 15-кратном объеме к весу осадка (г/см 3). Образец ЛПС выдерживают 16 часов при 37 С. Хроматографическую колонку с сефадексом промывают дистиллированной водой. Затем колонку промывают трис-буфером, содержащим 1 мМ ЭДТА и 0,5 дезоксихолата натрия. Загружают образец ЛПС-антигена и подключают резервуар с буфером. Отбирают первую фракцию. Полученный антиген диализуют против дистиллированной воды в течение ночи при 4 С. Приготовление конъюгата Конъюгат коллоидного золота с белком) получают с использованием коммерческого набора. Нанесение реагентов на мембрану Антиген и контрольные антитела(моноклональные антитела к легкой цепиКРС) иммобилизуют путем нанесения при помощи струйно-капилярного устройства на нитроцеллюлозную мембрану. Сорбцию проводят в чистой комнате при температуре 18-22 С и относительной влажности 70-80. После нанесения антигена мембрану сушат в термостате 2 ч при температуре 37 С. Расстояние между контрольной и тестовой линией на нитроцеллюлозной мембране должно быть 5 мм. После нанесения антител мембрану сушат 2 часа при 37 С в сушильной камере. Блокировка мембраны осуществляется после нанесения антигенов и антител путем погружения в раствор бычьего,овечьего и лошадиного альбуминов. Инкубируют мембрану 60 мин при 37 С. После чего мембрану сушат 4 часа при 37 С в сушильной камере. Нанесение конъюгата на мембрану Перед нанесением коньюгата стекловолоконную мембрану блокируют раствором бычьего, овечьего и лошадиного альбуминов. Для нанесения коллоид-золотого коньюгата используется то же специальное устройство, что и для нанесения антигена, но вместо капельных распылителей применяют аэрозольный. Полученная мембрана сушится в сушильной камере при 37 С. Сборка компонентов на адгезивной подложке Сборку тестов из подготовленных компонентов осуществляют в чистом помещении при температуре 20-22 С и относительной влажности воздуха 30-40 Сборка осуществляется путем приклеивания компонентов на адгезивную подложку (карточку) в следующем порядке по центру адгезивной подложки приклеивают нитроцеллюлозную мембрану с нанесенными тестовой и контрольной полосой размером,сверху приклеивают адсорбирующую мембрану с перекрытием нитроцеллюлозной мембраны на 2 мм, снизу нитроцеллюлозной мембраны приклеивают мембрану с конъюгатом с перекрытием нитроцеллюлозной мембраны на 2 м, затем приклеивают сепарирующую мембрану с перекрытием мембраны с конъюгатом на 4 мм, в конце приклеивают мембрану для нанесения образца с перекрытием сепарирующей мембраны на 4 мм. Нарезка тест-полосок Готовая тест-карта нарезается на тест-полоски шириной 4 мм при помощи ручного резака либо специального автоматического устройства. Приготовление раствора для разведения исследуемых проб Состав раствора , КС, 2 О 4, К 2 НРО 4,додецилсульфат натрия, азид натрия, твин-20. Навески солей засыпают в мерную колбу,наливают воду и перемешивают до полного растворения.устанавливают 7,5. Проведение анализа 1. Открывают крышку микропробирки с раствором для разведения проб. В случае, если в набор предусматривает комплектацию пустыми пробирками и флаконом с раствором, из флакона в пробирку переносят 0,3 мл (10 капель) раствора.(30 мкл) исследуемого образца, аккуратно перемешать. 3. Погрузить тест-полоску в пробирку. В случае,если тест-полоска помещена в пластиковую кассету,из пробирки с разведенной пробой в окно для загрузки образца помещают 4-5 капель. 4. Наблюдать за движением фронта реагентов в течение 7-10 минут. 2.4 Учт результатов анализа. Проводят визуально или при помощи специального аппаратно-программного комплекса. Визуальный учет - при окраске двух полос(реакционной и контрольной) - результат считают позитивным. При окраске одной полосы(контрольной) - результат считают негативным. Внимание Если анализ проведен правильно,контрольная полоса должна появляться всегда, не зависимо от присутствия антител в исследуемом образце. Если же контрольная полоса отсутствует,анализ проведен некорректно. Исследование чувствительности иммунохроматографической тест-системы Для исследования на чувствительность тестировали 43 пробы положительных на бруцеллез полевых сывороток, взятых из разных источников и предварительно исследованных с помощью классических методов (РА с розбенгал антигеном и единым бруцеллезным антигеном). Результаты теста учитывали визуально по наличию тестовой полосы. Чувствительность методов определяли согласно требованиям МЭБ. Результаты проведенных исследований представлены в таблице 1. Таблица 1 Исследование чувствительности иммунохроматографической тест-системы Сыворотка 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 Таким образом, исходя из полученных результатов, следует, что чувствительность тестсистемы составила 97,6, из исследованных проб сывороток одна проба показала отрицательный результат и одна проба - сомнительный результат. Исследование специфичности иммунохроматографической тест-системы Для исследования на специфичность тестировали 67 проб отрицательных на бруцеллез сывороток, полученных из разных источников и подтвержденных в РА с розбенгал антигеном и непрямом ИФА. Кроме того были исследованы 2 пробы сыворотки против кишечного ерсиниоза. Результаты теста учитывали визуально по наличию или отсутствию тестовой полосы. Специфичность методов определяли согласно требованиям МЭБ. Результаты проведенных исследований представлены в таблице 2. Таблица 2 Исследование специфичности иммунохроматографической тест-системы Сыворотка 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 Результаты, представленные в таблице 2,свидетельствуют, что специфичность тест-системы равна 100. Сравнительные испытания тест-системы с зарубежными аналогами Исследования иммунохроматографических тестсистем проводили с аналогичными тестами производства(Литва) и(Корея). Постановку анализа осуществляли согласно прилагаемым наставлениям. В опытах использовалось по 10 тест-систем каждого производителя. Результаты проведенных исследований представлены в таблице 3. Таблица 3 Результаты сравнительных исследований иммунохроматографических тест-систем от разных производителей Как видно из фотографий, представленных в таблице 3, по образованию полос в результате реакции с положительными и отрицательными сыворотками заявляемый экспресс-тест и зарубежные аналоги идентичны. ФОРМУЛА ИЗОБРЕТЕНИЯ Способ изготовления тест-системы для диагностики бруцеллеза животных методом иммунохроматографического анализа, включающий нанесение антигена бруцелл и контрольных антител на нитроцеллюлозную мембрану, конъюгата коллоидного золота на стекловолоконную мембрану и сборку всех составляющих тест-полоски на адгезивной подложке, отличающийся тем, что в составе конъюгата используют рекомбинантный белок , позволяющий проводить диагностику у нескольких видов животных и дополнительно используют фильтрующую мембрану,позволяющую проводить анализ на цельной крови.
– Олег Дмитриевич, чем продиктовано принятие нового ГОСТа?
– Если быть точным, то в действие введен ГОСТ 34105-2017 (Межгосударственный стандарт. Животные. Лабораторная диагностика бруцеллеза. Серологические методы). Его появление обусловлено не только внедрением в российскую ветеринарную диагностическую практику новых серологических тестов, в частности, реакции непрямой гемагглютинации, вариантов иммуноферментного и иммунохроматографического анализа, но и целесообразностью совершенствования диагностики – прежде всего повышения ее оперативности и специфичности.
Разрабатывать этот ГОСТ начинали одновременно с подготовкой по распоряжению Минсельхоза России новых Ветеринарных правил осуществления профилактических, диагностических, ограничительных и иных мероприятий, установления ограничений, направленных на предотвращение возникновения, распространения и ликвидацию очагов бруцеллеза животных в России (далее – новые правила). Сейчас проект правил проходит стадию согласования различными ведомствами.
Разумеется, оценка диагностических титров серологических реакций при диагностике бруцеллеза в ГОСТе и новых правилах будет одинаковой. Поэтому считаю, что до выхода в свет этих правил ветеринарные диагностические лаборатории не должны переходить на работу по ГОСТ 34105-2017.
– Потому что между ГОСТом и действующими в настоящее время Ветеринарными правилами по борьбе с бруцеллезом (ВП 13.3.1302-96) сохраняются существенные различия.
– На какие положения стандарта вы хотели бы обратить внимание специалистов в первую очередь?
– К сожалению, несмотря на то, что ГОСТ34105-2017 согласовывался специалистами стран Евразийского экономического союза, в нем сохраняются недочеты.
– Одним из таких недочетов является предписание проводить дополнительное исследование образцов сыворотки в РИД и ИФА с ОПС-антигеном в случае выявления в группах животных, иммунизированных и не иммунизированных против бруцеллеза и положительно реагирующих по результатам серологических исследований в ряде реакций. Такое требование предусмотрено пп. 8.2, 8.3 и 8.4 данного ГОСТа в целях уточнения диагноза.
– Если речь идет об уточнении диагноза, то почему вы называете это недочетом?
– Дело в том, что, по состоянию на сегодняшний день, диагностические тест-системы для иммуноферментного анализа в рамках госзаказа выделяются в ограниченном количестве. Представители большей части ветеринарных диагностических лабораторий утверждают, что им такие тест-системы будут недоступны. Соответственно, непроведение серологического тестирования в ИФА, согласно ГОСТу, будет расценено представителями надзорных учреждений как нарушение.
С учетом разницы в диагностической чувствительности между РИД с ОПС-антигеном и ИФА с ОПС-антигеном исследование последним методом является принципиальным. В противном случае при выполнении серологического исследования только в РИД с ОПС-антигеном объективность его результатов может быть сомнительной.
Не буду вдаваться в подробности других имеющих принципиальное значение недочетов, отмечу лишь, что после их обсуждения и согласования с диагностическими ветеринарными лабораториями должно быть инициировано внесение изменений в ГОСТ 34105-2017.
– Какие ошибки чаще всего допускают при лабораторной диагностике бруцеллеза?
– О существенных ошибках мне неизвестно. К тому же мы не контролируем работу лабораторий. Однако, когда специалисты ряда лабораторий обращаются к нам, чтобы обсудить спорные результаты исследований, кажется, что некоторые из них не знакомы со всеми документами, регламентирующими диагностику болезни. Впрочем, большинство специалистов проявляют инициативу и демонстрируют познания, достаточные для диагностики болезни. Не менее важно и то, что они заинтересованы в получении объективных результатов.
– Какова сегодня эпизоотическая ситуация по бруцеллезу среди крупного и мелкого рогатого скота на территории России?
В период с 2013 по 2017 годы количество неблагополучных по бруцеллезу мелкого рогатого скота пунктов, остававшихся на конец года, составляло 30, 28, 22, 17 и 14. Число заболевших животных – 1,9; 2,5; 2,2; 1,22 и 1,01 тыс. голов.
– Можно утверждать, что динамика положительная?
– Система контроля бруцеллеза животных в стране несовершенна?
– Сложившуюся систему контроля бруцеллеза животных в Российской Федерации можно считать удовлетворительной. Однако это не исключает необходимости ее совершенствования. Прежде всего в части сокращения временных затрат при установлении диагноза за счет более широкого применения средств дифференциальной диагностики болезни, а именно реакции иммунодиффузии и иммуноферментного анализа с ОПС-антигеном, возможно, за счет сочетания средств диагностики.
Важным представляется проведение исследований и установление возможных, максимально ранних сроков серологического исследования вакцинированных животных, особенно мелкого рогатого скота, иммунизированного агглютиногенными вакцинами. В настоящее время этим никто не занимается.
Не стоит забывать, что самый эффективный способ оздоровления неблагополучного хозяйства предусматривает ликвидацию всего поголовья в таком хозяйстве. Однако данный способ не слишком широко применяется в нашей стране. (Должен отметить, что в проекте новых правил его применение регламентировано в большем количестве случаев, нежели в Ветеринарных правилах 13.3.1302-96.) Поэтому перед проведением вакцинации животных в рамках оздоровления путем вакцинации и последующих периодических серологических исследований особенно важно максимально полно удалять инфицированных особей из групп животных.
– В нынешних условиях это реально?
– Я бы сказал, что это возможно за счет введения животным неблагополучных по бруцеллезу хозяйств провоцирующих неагглютиногенных антигенов, в отличие от применяющихся вакцин, с последующим серологическим исследованием и удалением выявленных больных животных.
При этом не могу не отметить, что организации-производители, планировавшие выпускать такие антигены, зарегистрированные ими ранее в Российской Федерации, пока не справляются со своими планами и не понятно, справятся ли.
– Что препятствует повышению эффективности системы контроля бруцеллеза?
– На мой взгляд, совершенствование этой системы не представляется возможным без решения целого ряда задач. Во-первых, нужно создавать в регионах, неблагополучных по бруцеллезу, мясокомбинаты и бойни, обеспечивающие убой больных животных, что решает проблему неполного, несвоевременного и антисанитарного убоя. При этом следует компенсировать владельцам убыток. К сожалению, он неизбежен при изъятии больных животных, прежде всего в условиях ведения отгонного животноводства.
Во-вторых, следует запретить введение нетелей и ярок в стада и отары взрослых животных. В-третьих, нужно ограничить концентрацию поголовья в хозяйствах молочного направления, которые находятся на территориях, неблагополучных по бруцеллезу. В-четвертых, необходимо оперативно завершать реализуемую в стране программу идентификации (мечения) животных.
– Несложно предположить, что для решения этих задач требуются немалые финансовые вложения.
– Конечно, но если эти задачи не решить, то искоренить бруцеллез на территории нашей страны не получится.
– Лаборатория качества и стандартизации бактерийных лекарственных средств ВГНКИ как структурное подразделение Россельхознадзора разрабатывает образцы сыворотки, которая применяется для диагностики бруцеллёза. Соответствует ли она эталонным стандартам МЭБ?
– Более 30 лет тому назад в лаборатории была разработана Национальная стандартная сыворотка анти-Бруцелла абортус, активность которой составляет 1000МЕ агглютинирующих антител/см 3 . Сыворотка предназначена для стандартизации антигена для реакции агглютинации (РА), применяемой при серологической диагностике бруцеллеза. Периодически с интервалом в пять-семь лет лаборатория готовит очередную серию сыворотки взамен предыдущей. Каждая серия стандартизуется по международной эталонной сыворотке с использованием международного стандарта антигена, предоставляемых Международным эпизоотическим бюро.
Национальная стандартная сыворотка используется и для оценки активности антигенов для других серологических реакций. Но в этой части с учетом современных требований и рекомендаций МЭБ она нуждается в совершенствовании и в изменении ее статуса.
– В заключение расскажите, пожалуйста, о приоритетных задачах вашей лаборатории.
– Традиционно лаборатория выполняет регистрационные и сертификационные испытания, осуществляет инспекционный контроль сертифицированной продукции, а также лекарственный мониторинг и выборочный контроль качества образцов средств специфической профилактики и диагностики бруцеллеза животных. Наряду с этим предполагается выполнение научно-исследовательской работы, цель которой – разработка национальных стандартных образцов сыворотки anti-Brucella abortus для стандартизации антигенов для реакции агглютинации, реакции связывания комплемента, кольцевой реакции с молоком, метода поляризации флуоресценции и иммуноферментного анализа. В частности, речь идет о трех образцах сыворотки anti-Brucella abortus для непрямого ИФА, конкурентного ИФА и поляризации флуоресценции ИФА, стандартизированных по международным стандартным сывороткам с использованием международных стандартных антигенов бруцелл.
Разработка и применение национальных стандартных образцов сыворотки анти-бруцелла абортус для стандартизации бруцеллезных антигенов, используемых в разных серологических тестах, обеспечивает объективную оценку результатов диагностики бруцеллеза в стране, а также международную гармонизацию диагностического тестирования болезни.

- Форма выпуска: набор / 10 исследований
- Назначение: тест иммунохроматографический для выявления антигенов ротавируса в кале
Инструкция по применению
Тест иммунохроматографический для выявления ротавируса в кале
Регистрационное удостоверение: №ФСР 2012/13624 от 29.06.2012
Ротавирус вызывает гастроэнтерит у детей и подростков, реже – у взрослых. Ротавирус передается фекально-оральным путем. Основные симптомы вирусного гастроэнтерита – водянистая диарея, рвота, головная боль, повышение температуры, боли в желудке. Как правило, симптомы проявляются на 1-2 день после инфицирования и продолжаются 3 дня.
Определение основано на принципе иммунохроматографического анализа. Анализируемый образец жидкого биологического материала абсорбируется поглощающим участком тест-полоски. При наличии в образце ротавируса он вступает в реакцию с нанесенными на стартовую зону специфическими моноклональными антителами против ротавируса, меченными окрашенными частицами, и продолжает движение с током жидкости. В аналитической зоне тест-полоски происходит взаимодействие со специфическими моноклональными антителами, иммобилизованными на поверхности мембраны, с образованием окрашенного иммунного комплекса.
В контрольной зоне тест-полоски специфический окрашенный иммунный комплекс образуется независимо от наличия в тестируемом биологическом материале ротавируса.
В том случае, если в анализируемом образце присутствует ротавирус, на тест-полоске образуются две параллельные окрашенные линии (красная аналитическая, обозначенная буквой Т, и зеленая контрольная, обозначенная буквой С), что указывает на положительный результат анализа. В случае отсутствия в анализируемом образце ротавируса на тест-полоске образуется одна зеленая контрольная линия (С), что указывает на отрицательный результат анализа.
- контейнеры для сбора образцов кала;
- одноразовые резиновые или пластиковые перчатки;
- часы или таймер.
Свежесобранный биологический материал (кал), не содержащий консерванты.
Образцы кала должны быть собраны в чистый контейнер. Следует отбирать образцы кала для анализа в первые 1-2 дня после появления симптомов, т.к. спустя 5-7 дней после инфицирования количество ротавируса значительно уменьшается.
Образцы кала до определения можно хранить при температуре 2–4°С не более 2 сут., при необходимости более длительного (до 1 года) хранения – при температуре –20°С и ниже.
Перед анализом образцы кала должны быть полностью разморожены и доведены до комнатной температуры.
Повторное замораживание и оттаивание образцов недопустимо.
1. Снять крышку-капельницу с пробирки и с помощью стержня на крышке взять небольшое количество анализируемого образца. Для этого ввести стержень в 2 разные зоны образца, собрав примерно 100 мг кала (рис. 1-1). Если образец жидкий, отобрать 100 мкл с помощью пипетки. Ввести стержень с образцом в пробирку с буфером для растворения образца и плотно завинтить крышку-капельницу (рис. 1-2).
2. Несколько раз встряхнуть пробирку, чтобы облегчить растворение образца (рис. 2-1).
3. Встряхнуть пробирку с раствором образца (рис. 2-1). Отрезать или отломить кончик крышки-капельницы.
6. Через 10 мин визуально оценить результат реакции.
Мифы о вакцинации
В последние годы в мире складывается неоднозначное отношение к прививкам. Несмотря на то, что поголовная вакцинация против некоторых заболеваний привела к практически полному их исчезновению, ряды противников обязательных прививок растут. Этому способствует широкое распространение заблуждений, касающихся вакцинации.
Неизвестная инфекция — главная опасность
Кишечные инфекции, вал клещевых энцефалитов и южные инфекции, привезенные россиянами из отпусков,— таковы медицинские итоги лета.
Один из самых именитых инфекционистов России академик Виктор Малеев рассказал о наших самых маленьких, но от этого не менее опасных врагах.
Прививки для детей от рождения до 7 лет: рекомендации на 2017 год
Национальный календарь профилактических прививок включает в себя далеко не самый полный перечень вакцин, существующих в мире. При его составлении учитывается великое множество факторов, и далеко не последнюю роль.
Антипрививочники меняют свои убеждения
Большая часть студентов-антипрививочников, интервьюировавших людей с заболеваниями, которые можно было предупредить вакцинацией, изменила свою позицию на провакцинаторскую. В целом, 75% учащихся, выступавших против прививок, поменяли свое отношение к вакцинации, причем 50% полностью перешли в лагерь ее сторонников.
Комплексный ответ простуде и гриппу
С наступлением холодного сезона ежегодно повышается заболеваемость острыми респираторными вирусными инфекциями (ОРВИ), гриппом и другими инфекциями дыхательных путей, на пике холодов приобретая масштабы эпидемии.
Читайте также:


