Хеликобактер и с-реактивный белок
Aннотация
В статье анализируются данные зарубежной и российской литературы о связи хеликобактерной инфекции и риска развития кардиоваскулярной патологии. Анализируются варианты патогенетических механизмов формирования корреляции Helicobacter pylori и риска развития ИБС. Появляется все больше доказательств того, что отдельные микробные агенты могут иметь этиопатогенетическию роль в развитии атеротромбоза. Helicobacter pylori (H. pylori) - бактерия, которая вызывает язвенную болезнь, была предложена в качестве одного из микробов, участвующих в развитии атеротромбоза. Эта гипотеза основывается на следующих наблюдениях: более высокая распространенность инфекции H. pylori у пациентов с ишемической болезнью сердца, инфарктом миокарда, цереброваскулярными заболеваниями; связь инфекции H. pylori и сердечно-сосудистых факторов риска, таких как концентрации триглицеридов и холестерина в сыворотке и фибриногена в плазме; уровень H. pylori коррелирует с уровнем острофазовых белков, ассоциированных с повышенным риском коронарных заболеваний, таких как C-реактивный белок; и противоречивые ПЦР исследования, указывающие на присутствие инфекции H. pylori в атеромах. Анализ научных данных свидетельствует о том, что инфицирование H. pylori может косвенно способствовать развитию и осложнить атеротромбозы и сердечно-сосудистые заболевания. По нашему мнению, необходимы очень крупные рандомизированные исследования для того, чтобы доказать достоверность наличия возможной связи между H. pylori и сердечно-сосудистыми заболеваниями.
Введение. В настоящее время ученые все чаще изучают коморбидные болезни. Это особенно актуально по отношению к значительно распространенным сердечно-сосудистым заболеваниям (ССЗ) (большая часть из которых - ишемическая болезнь сердца (ИБС) [5, 7]) или цереброваскулярным заболеваниям с патогенным механизмом атеротромбоза, болезням желудочно-кишечного тракта [1]. Среди сочетанных заболеваний внутренних органов около до 52% приходится именно на сочетание ИБС и язвенной болезни (ЯБ), что приводит к атипичному течению заболеваний и поздней диагностике [6]. Взаимное отягощение и прогрессирование рассматриваемых заболеваний основывается на объединении некоторых патологических звеньев [3, 18]. В возникновении сочетания ИБС и язвенной болезни большую роль играют генетическая предрасположенность и общие факторы риска.
В ряде исследований выявлена корреляция между сердечно-сосудистыми факторами риска, маркерами воспалительных процессов при атеросклеротическом процессе и Helicobacter pylori (H. pylori), приводящая к развитию ишемической болезни сердца (ИБС) [22]. Инфекция Н. pylori активирует как локальный, так и системный воспалительный процесс и может рассматриваться как возможный дополнительный фактор риска развития и обострения ИБС. Результаты многочисленных исследований дают основание предполагать о возможной патогенетической или опосредованной роли инфекции H. pylori в развитии и/или течении заболеваний, не относящихся к пищеварению. Несмотря на множество исследований, в которых подтверждается роль H. pylori в патогенезе ССЗ, в ряде исследований делаются весьма противоречивые выводы [9].
Основная часть
Цель исследования: изучить имеющиеся литературные данные о роли H. pylori в патогенезе и прогрессировании ИБС и риске сердечно-сосудистой патологии.
Материалы и методы исследования: обзор отечественных и иностранных литературных источников
Результаты исследования и их обсуждение
Н. pylori - это бактерия, которая встречается повсеместно, распространенность которой варьирует в зависимости от социально-экономических условий жизни населения [20]. Она считается этиопатогенетическим агентом как доброкачественных, так и злокачественных гастродуоденальных заболеваний; уничтожение бактерии приводит к рубцеванию пептической язвы, подавлению гастрита, снижению рецидивов язвенной болезни, улучшению симптоматики диспепсии и регрессу роста MALT-лимфомы. Она была классифицирована всемирной организации здравоохранения (ВОЗ), как тип 1 канцероген [20]. Кроме того, в последние годы было предложено, что H. pylori имеет большое значение в атеротромботическом процессе, доказательства этого анализируются ниже.
Изучение связи инфекции H. pylori с сердечно-сосудистыми заболеваниями (ишемической кардиопатии и ишемической цереброваскулярной болезни) были проведены разными следователями.
Возможными механизмами воздействия H. pylori на организм являются: 1) активация воспалительного процесса с продукцией цитокинов, эйкозаноидов и других медиаторов; 2) молекулярная мимикрия между антигенами бактерии и компонентами тканей макроорганизма с дальнейшим их аутоиммунным повреждением; 3) взаимодействие с тучными клетками с последующей секрецией биологически активных веществ, действующих на сосуды, бронхи, другие внутренние органы; 4) развитие аллергических реакций преимущественно немедленного типа; 5) снижение барьерной функции кишечника, приводящее к поступлению токсических продуктов, аллергенов в кровь; 6) поглощение макро- и микроэлементов, в частности железа, для процессов своей жизнедеятельности и, следовательно, обкрадывание макроорганизма [2].
Исследования взаимосвязи между серотипом H.pylori и факторами риска сердечно-сосудистой системы.
Давно изучены факторы, которые повышают риск атеротромбоза, такие как повышение в плазме фибриногена и VII фактора свертывания, гиперхолестеринемия и гипертриглицеридемия. В отношении взаимосвязи данных факторов и хеликобактерной инфекции имеются противоречивые результаты. Niemëla и соавторы [23] обнаружили значимые различия между триглицеридами и ЛПВП среди испытуемых серопозитивных и серонегативных по H. pylori. По мнению Rengström [29] также не было обнаружено существенных различий в плазме уровней фибриногена, холестерина или триглицеридов среди серопозитивных и серонегативных пациентов. В другом крупном исследовании авторы показали значительное увеличение фибриногена у серопозитивных пациентов, но не нашли значительных различий уровня холестерина и триглицеридов в плазме у некоторых серонегативных пациентов [25]. Также в этом исследовании был изучен VII фактор свертывания крови, но никаких существенных различий не было обнаружено среди пациентов, серопозитивных для H.pylori по отношению к серонегативным. В исследовании Pellicano R. выявлена способность бактерии усиливать агрегацию тромбоцитов и стимулировать прокоагулянтную активность компонентов крови [27]. В работе Weydig C. указаны возможные механизмы проагрегационных свойств H.pylori посредством молекул адгезии (L- и P-селектины), гликопротеина Ib, фактора Виллебрандта [31].
Исследования взаимосвязи между серотипом H.pylori и маркерами воспалительного процесса.
Существует все больше доказательств того, что воспаление играет этиопатогенетическию роль в развитии атеросклероза и что некоторые маркеры воспаления связаны с большим риском развития ИБС. Ухудшают прогноз ИБС такие маркеры, как С реактивный белок (СРБ), уровень лейкоцитов в крови, фибриногена в плазме или наличие белков теплового шока (БТШ) [8, 21]. При сравнении серопозитивных пациентов, по отношению к H.pylori, с серонегативными, Patel и соавторы [25] выявили увеличение уровня лейкоцитов в крови и фибриногена. Birnie и др. обнаружили увеличение БТШ бактерий для миоцитов, в частности БТШ-60 и БТШ-65 [11], при этом повышение C реактивного белка было связано с ухудшением прогноза у больных с нестабильной стенокардией или недавно перенесенным инфарктом миокарда. Также была исследована связь коронарной кардиопатии с ФНО-α, также маркером воспаления, но статистически значимых различий при этом не было выявлено.
Присутствие H. pylori в атероматозных бляшках.
Исследования проводились с использованием полимеразной цепной реакции (ПЦР) для обнаружения ДНК H. pylori в исследуемых тканях. Эти исследования, помимо того, что малочисленны (только 2 группы исследователей представили результаты), но и противоречивы. Cunningham и соавторы обнаружили наличие H. pylori в атероматозных бляшках (Первый Европейский конгресс по химиотерапии), в то время как Blasi и соавторы [12], в ходе исследования, проведенной на хирургических образцах аневризмы аорты, не обнаружили наличие H.pylori ни в одном из 51 образцов, несмотря на то, что 47 пациентов были серопозитивными.
С другой стороны, известно, что бактерии, которые противостоят сыворотке, или литической активности сывороточного комплемента, выживают дольше в кровотоке, что позволяет ему колонизировать другие области организма. В этом отношении Н. pylori восприимчива к бактерицидной активности сыворотки крови человека (в основном за счет активации альтернативного пути комплемента), и существуют определенные отличия в соединении разных штаммов к комплименту С3, что делает выживание этой бактерии в потоке крови маловероятным [16]. Тем не менее, в более позднем исследовании, проведенным коллективом под руководством Oshima T., выявлены были бактерии в биоптатах сосудов [24]. Багдадские ученые в 2015г. также обнаружили хеликобактерную специфическую ДНК в атеросклеротической бляшке из материала коронарных артерий. Кроме того, они оценивали роль фактора вирулентности H. pylori (цитотоксин ассоциированный ген (CagА)), липидный профиль, изучили уровень провоспалительных маркеров (С-реактивный белок) в качестве факторов риска ИБС у 70 пациентов с ИБС и наличием H. pylori. В результате получили существенные различия в среднем значении CagА, СРБ и обнаружением хеликобактерной специфической ДНК в атеросклеротической бляшке из материала коронарных артерий. Его ассоциация к позитивности антихеликобактерной терапии и клинических симптомов истолкованы авторами, как свидетельство участия хеликобактерной инфекции в прогрессировании ИБС [21] .
В крупном метаанализе, в котором приняли участие более 1000 больных, изучалась возможность корреляции между факторами риска ИБС и H. pylori. Авторы предполагают, что корреляцию между обнаружением H. pylori и выявлением факторов риска сердечно-сосудистой системы (ССС), можно объяснить преимущественной публикацией только положительных результатов, или случайными совпадениями, или обоими факторами одновременно [4]. В этом плане следует отметить крупное исследование HOPE, которое не подтвердило достоверную ассоциацию между инфекцией H. pylori и риском возникновения патологии сердца и сосудов.
Основываясь на научных данных, мы предлагаем различные механизмы для объяснения ассоциации инфекции H. pylori с сердечно-сосудистыми заболеваниями.
Субфебрильная хроническая воспалительная реакция вырабатывается, провоцируя атерогенный процесс через изменения некоторых сердечно-сосудистых факторов риска, таких как свертывающие и липидные факторы, с выделением фибриногена, СРБ, фактора некроза опухоли (ФНО-α) и интерлейкина 6 (ИЛ-6), в дополнение к увеличению количества лейкоцитов в крови, которое может вызвать протромботическое состояние. У взрослых H.pylori индуцирует активный хронический воспалительный процесс с наличием нейтрофилов, Т-лимфоцитов, B-лимфоцитов и плазматических клеток [14]. Специфический клеточный ответ характеризуется образованием Т-хелперных лимфоцитов, приводящих к увеличению цитокинов, особенно ИЛ-1, ИЛ-6, ИЛ-8, ФНО-α и интерферона-γ.
Способность индуцировать цитокины отличается среди различных штаммов H.pylori в частности, по CagA+, CagE+, VacAs1+, VacAm1+, BabA2+ – генам и культуральным свойствам [30]. С CagA+ штаммами наблюдалось продуцирование наиболее интенсивно высвобождающихся цитокинов с большим разнообразием [15]. Ряд исследователей предполагает, что именно вирулентные цитотоксические штаммы H. pylori, в частности с CagA, способны вызывать патологические изменения в сосудах.
Выявлено, что CagA - ассоциированная модификация актина влияет на его сократительную активность и находит свое выражение через каскадный механизм, включающий специфические белки-транспортеры (в частности, CagF) и медиаторное звено, представленное энзимными и неэнзимными компонентами [26]. Анти-CagA антитела обнаруживали в цитоплазме гладкомышечных клеток и они перекрестно реагировали с антигенами интактных и атеросклеротических сосудов; связывание их с антигенами поврежденных артерий, что может способствовать прогрессированию атеросклероза у лиц, инфицированных H. pylori [9]. Видимо CagA является одним из наиболее значимых агентов, обеспечивающих кардиопатогенность H.pylori.
Однако, ни в одном из исследований, отрицающих роль H. pylori в патогенезе ИБС, не оценивали распространенность вирулентных CagA-позитивных штаммов H. pylori среди обследованных пациентов [9]. С другой стороны, было также замечено, что растворимые выделения H.pylori способствуют агрегации бляшек в микроциркуляции слизистой желудка [17].
Симонова Ж.Г с соавторами разработала интегральную схему многогранного патогенного действия микроорганизма в отношении сердечно-сосудистой системы, которую мы представляем на рис. [8]. На ней обозначены основные патогенетические цепи, развивающиеся в результате реализации конкретного фактора вирулентности H. pylori. По ее мнению, превалирующую роль играют антителогенез, действие цитокинов и модуляторов системного воспаления, а запускает патохимический каскад молекулярных агентов, продуцируемых самим микроорганизмом, белок CagA [8].
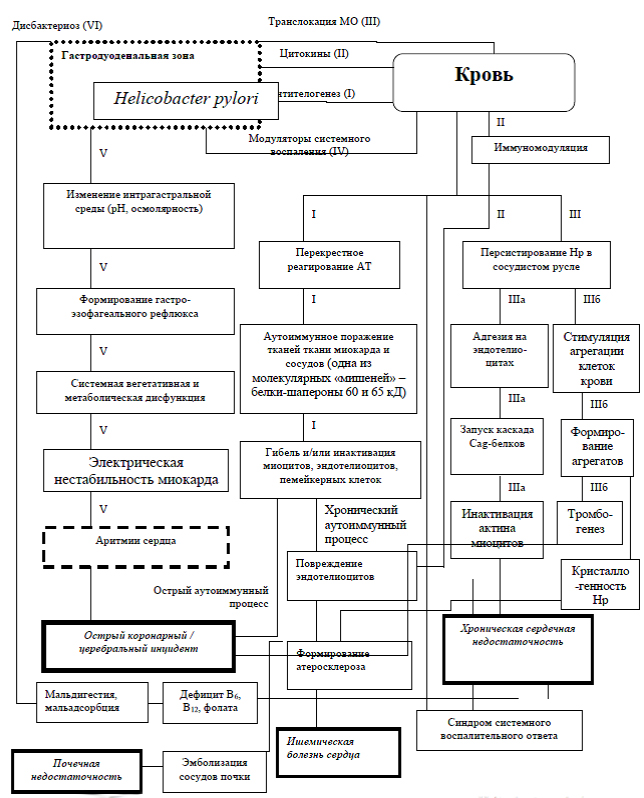
Рис. Патогенетические механизмы развития и прогрессирования H.pylori-ассоциированных заболеваний сердечно-сосудистой системы.
Fig. The pathogenetic mechanisms of development and progression of H.pylori-associated cardiovascular diseases.
Результаты исследования и их обсуждение.
Изменение липидов крови
Инфицирование H.pylori вызывает повышение уровня холестерина и триглицеридов со снижением уровня ЛПВП, способствуя развитию дислипидемии – известный сердечно-сосудистый фактор риска.
Ряд авторов предполагают, что формирование окислителей также важно. Было замечено снижение антиоксидантов у пациентов с H. pylori, что может привести к активации перекисного окисления липидов и, следовательно, к развитию атерогенеза, так как окисление липопротеинов низкой плотности (ЛПНП) является первым из основных шагов в атерогенном процессе.
Перекрестная реактивность с антителами белков теплового шока (БТШ)
Другая теория заключается в анти-БТШ антителах с перекрестной реактивностью. Выявлено, что H. pylori вырабатывает БТШ-60 с высокой степенью гомологичной последовательностью с БТШ-60 человека, находящимися в эндотелии.
Гипергомоцистеинемия достаточно новый сердечно-сосудистый фактор риска, поскольку было замечено, что повышение уровня гомоцистеина связано с увеличением риска сердечно-сосудистых заболеваний. В этом отношении у пациентов с хроническим гастритом, как правило вызванным хеликобактерной инфекцией, наблюдается уменьшение абсорбции витамина В12 и фолиевой кислоты, вызывая тем самым вторичную гипергомоцистеинемию [13].
В исследованиях Rasmi Y., Raeisi S.изучался механизм эндотелиальной дисфункции в патогенезе кардиального синдрома Х, обусловленный структурно-функциональными нарушениями эндотелиоцитов в результате воспаления и пролиферативных изменений от H. pylori, приводящих к изменению эластических свойств сосудов через провоспалительные цитокины, молекулы клеточной адгезии, факторы роста и белки острой фазы. [28].
Заключение
Таким образом, механизмы патогенного действия H. pylori на ССС многогранны и способны приводить к формированию острых и хронических заболеваний сердечно-сосудистой системы. Тем не менее, роль H. pylori в этиопатогенезе ССЗ остается до конца не уточненной. В литературе появляются новые сообщения о возможной связи H. pylori и ИБС. Некоторые исследователи считают, что даже если связь существует и претерпевает обратное развитие после эррадикации хронической инфекции, необходимы очень крупные рандомизированные исследования для того, чтобы доказать достоверность наличия возможной связи между H. pylori и ССЗ.
В настоящее время литературные данные о взаимосвязи H. pylori с ИБС, носят разрозненный и противоречивый характер, все же они позволяют дополнить фундаментальные представления о патогенезе заболеваний, которые развиваются в рамках воспалительных и иммунных реакций на уровне различных органов и систем вне пищеварительного тракта, в частности в ССС. Хотя нет точных данных, подтверждающих роль H. рylori в развитии атеросклероза, накопившиеся факты указывают, что наряду с другими факторами патогенеза эти бактерии могут способствовать развитию данного заболевания. Противоречия о неоднозначности роли H. pylori в формировании атеросклероза и ИБС могут быть связаны с их генетической гетерогенностью.
В целом, приведенные выше противоречивые данные, дают основание для дальнейшего изучения этой проблемы с целью выявления достоверных сведений.
Список литературы
Научные результаты биомедицинских исследований включен в научную базу РИНЦ (лицензионный договор № XML-262/2019 от 2 апреля 2019г).

Цель исследования: оценить частоту и характер эрозивно-язвенных и воспалительных поражений пищевода, желудка и двенадцатиперстной кишки (ДПК), показатели гуморального иммунитета и выявить интенсивность хеликобактерной инфекции у больных БА.
Материалы и методы. В исследование включены 215 пациентов с бронхиальной астмой в возрасте от 15 до 60 лет (из них 107 мужчин и 108 женщин), проходивших обследование и лечение в аллергологическом отделении МУ ГКБ № 21 городского округа г. Уфы в течение 2009-2010 гг.
Диагноз бронхиальная астма, степень тяжести и уровень контроля устанавливались, учитывая диагностические критерии заболевания (согласно международному документу Глобальная стратегия лечения и профилактики бронхиальной астмы - GINA, пересмотр 2006, 2007 гг.).
Основными критериями включения явились наличие у пациентов подтвержденной БА в стадии обострения, наличие или отсутствие подтвержденных заболеваний верхних отделов ЖКТ в стадии обострения. В исследование не включали пациентов с тяжелыми сопутствующими заболеваниями в стадии декомпенсации, с сахарным диабетом, злокачественными новообразованиями.
Изучались жалобы пациентов, анамнестические данные. Сведения получены со слов больных в ходе беседы, данных амбулаторных карт, выписок стационаров. Объективные данные были получены при осмотре, пальпации, перкуссии, аускультации по стандартной схеме.
Применялись лабораторные методы исследования: клинический анализ периферической крови, общий анализ мочи, биохимический анализ крови, общий анализ мокроты. Всем пациентам проводилось исследование функции внешнего дыхания - спирография по традиционной методике. Характер поражения пищевода, желудка и двенадцатиперстной кишки устанавливали по результатам ФЭГДС (обследовано 156 пациентов).
Для оценки иммунологического статуса был проведен иммуноферментный анализ (ИФА) сыворотки крови. Основную группу составляли 63 пациента с бронхиальной астмой, имеющие сопутствующую патологию в виде эрозивно-язвенных и воспалительных заболеваний верхнего отдела пищеварительной системы. В контрольную группу были включены 43 больных бронхиальной астмой без поражений пищевода и гастродуоденальной зоны. Группы были сопоставимы по возрасту, тяжести заболевания и форме БА.
Статистическую обработку данных проводили с использованием интегрированного пакета Statistica 8 for Windows фирмы StatSoft.
Результаты и обсуждение. Наибольшее распространение получила смешанная форма БА (44 %, 95 человек), аллергическая форма определена в 38 % случаев (81 пациент) и неаллергическая - в 18 % БА (39 человек). Средняя степень тяжести была у большинства пациентов (138 человек, 64 %), легкое течение отметили у 55 пациентов (26 %), тяжелое - у 22 больных (10 %).
Наиболее высокий уровень приходился на возраст 50 лет и более и составил 31 % от общего числа; примерно поровну распределились пациенты в возрасте до 20 лет, 20-29 лет и 40-49 лет (20 %, 19 % и 20 % соответственно). В возрасте от 30 до 39 лет наблюдались 22 человека (10 %). Анализируя полученные данные, число случаев заболевания среди женщин растет с увеличением возраста с 2 % (до 20 лет) до 26 % (старше 50 лет). Среди мужского населения наибольшее число пациентов относилось к возрастной группе до 20 лет, что связано с призывным возрастом пациентов.
На наличие хронического гастрита в прошлом указывает 9 % опрошенных лиц, эрозий и / или язв желудка и / или двенадцатиперстной кишки - 15 %, хронического панкреатита - 23 % и хронического холецистита и / или ЖКБ - 25 % больных БА.
По данным ФЭГДС патология ЖКТ у больных БА выявлена в 71,8 % случаев (112 человек) и проявилась в виде хронического гастрита и / или дуоденита у 60 (38 %) человек с БА, эрозии желудка - у 15 (10 %) человек, ЯБДК - у 12 (8 %) больных, эрозии пищевода - у 7 (5 %) пациентов и эрозии ДПК - у 8 (5,2 %) обследованных. Катаральный эзофагит и язва желудка обнаружены у 5 пациентов по каждой нозологии (3,2 % и 3,2 % соответственно). У 44 (28,2 %) человек патологии со стороны слизистой пищевода, желудка и ДПК не выявлено. ЯБ отмечена у 11 % пациентов, что несколько превышает ее популяционную частоту - 7,5 % [9].
Оценка гуморального звена иммунного ответа проведена 106 пациентам. При исследовании иммунологических показателей у больных с БА в сочетании с воспалительными и эрозивно-язвенными поражениями ЖКТ выявлено повышенное содержание общего IgМ по сравнению с пациентами без патологии ЖКТ (2,66±0,80 мг/мл и 2,01±0,93 мг/мл соответственно; р 9 /л

Во внутреннем оформлении использованы фотографии и иллюстрации: Valentina Razumova, marina_ua, Double Brain, Blamb, Designua, joshya / Shutterstock.com
Используется по лицензии от Shutterstock.com
Предисловие

Основатель серии Академия доктора Родионова Антон Родионов и главный редактор медицинского направления Ольга Шестова
От Ольги Шестовой
Тема книги важна буквально для каждого, потому что, с одной стороны, всем знаком дискомфорт в области живота, а с другой – в этой медицинской области, как ни в какой другой, распространены мифы и заблуждения, и не только среди нас, пациентов, но и среди врачей. Не все знают, что многие проблемы, с которыми, казалось бы, надо идти к терапевту или педиатру, на самом деле находятся в ведении гастроэнтеролога.
Например, если у вас болит горло, на нем пузырчатые высыпания, скорее всего, проблема вызвана гастрологическим заболеванием, это может быть энтерит.
Прочитав эту книгу, вы сможете задавать врачу вопросы, которые помогут ему быстрее поставить диагноз и определиться с необходимостью лечения или обоснованного отказа от него. Всегда нужно помнить, что есть болезни, которые не требуют агрессивной терапии и проходят со временем сами.
канд. биол. наук Ольга Шестова
От Антона Родионова
Признаюсь, будучи по первому образованию терапевтом, в дальнейшем посвятившим свою практику кардиологии, я чуточку недолюбливаю гастроэнтерологию по одной простой причине – далеко не во всех ее разделах я уверенно ориентируюсь. Хотя мне, как преподавателю, приходится постоянно читать различные специализированные руководства, я вдруг с удивлением для себя обнаружил, что книга доктора Парамонова даже для меня расставила многие вещи на свои места.
Наслаждайтесь увлекательным литературным путешествием по желудочно-кишечному тракту, и пусть изжоги, поносы и запоры обойдут вас стороной!
канд. мед. наук Антон Родионов

От автора
Уважаемые слушатели Академии доктора Родионова! Вы уже успешно освоили девять курсов-книг по различным разделам медицины и держите в руках десятую, посвященную гастроэнтерологии.
Еще одна особенность этой книги – в ней много клинических примеров (как сейчас принято говорить – кейсов), каждый из которых взят из моей практики, и их описание отражает те этапы поиска и обследований, которые пришлось пройти с реальным больным для постановки диагноза. Иногда этот путь был долгим и многолетним. Я предложу вам использовать определенный логический аппарат, который может сократить этот путь многократно и позволит задавать вашему лечащему врачу правильные вопросы, совместно с ним быстрее обнаружить болезнь и назначить правильное лечение.
С уважением, Алексей Парамонов.
Глава 1
Острая и хроническая боль в животе: что делать, если заболело внезапно
В этой книге мы часто будем делить симптомы на острые и хронические. Это важно, поскольку их происхождение и прогноз, порядок действий при них различаются коренным образом.
Внезапная острая боль в животе может быть признаком серьезного заболевания, требующего срочной операции, хотя может быть и следствием того, что вчера вы съели много фруктов, которые вызвали повышенное газообразование и кишечную колику.
Цель этой главы – помочь вам определить, когда можно самостоятельно принять безрецептурный препарат, а когда нужна экстренная госпитализация.
Итак, появилась боль. Какие симптомы должны быть маркерами тревоги:
✓ раньше так не болело никогда;
✓ боль невероятной силы, как будто кинжал вонзили;
✓ живот раздулся и внешне увеличился в размерах;
✓ перистальтика необычно сильная, со звуком и болью;
✓ живот молчит, раздулся, но стула нет и даже газы не отходят;
✓ боль сопровождается многократной рвотой;
✓ рвота имеет черно-коричневый цвет;
✓ кал стал совершенно черным или необычно светлым;
✓ боль возникла в верхней части живота, но постепенно спустилась вниз, стала менее явной, но все же весьма назойливой;
✓ боль сопровождается подъемом температуры, падением давления и увеличением пульса.
Если симптомов тревоги нет, боль непродолжительная, после стула или однократной рвоты она прекратилась и состояние улучшилось, то, вероятно, врач не нужен и можно принять симптоматическое средство, например, дротаверин (но-шпу), антациды или адсорбенты – эти ситуации и препараты подробно описаны в пятой книге этой серии.
В случае если боль неоднократно появлялась раньше, то это боль хроническая, и ее причиной служит одна из болезней, которые мы обсудим в последующих разделах.
Основная задача врача в приемном отделении – понять, есть ли у вас инфекционное заболевание как причина этих симптомов. Обычно он приглашает хирурга, чтобы исключить хирургические заболевания. Но пока он не уверен, что это не инфекция, вы будете пребывать в палате наблюдения приемного отделения. Здесь вам при необходимости сделают анализы и ультразвуковое исследование, обзорную рентгенографию органов брюшной полости, могут пригласить инфекциониста. Если врачи установят инфекционный диагноз, а состояние не внушает опасений, вам предложат лечиться дома. Если состояние тяжелое, вас должны перевести в инфекционную больницу. Если инфекции нет, вас госпитализируют в хирургическое отделение. Но и здесь операция может быть предложена далеко не сразу или не предложена вовсе. Иногда хирург должен наблюдать несколько часов за течением болезни, чтобы утвердиться с диагнозом и окончательно определить показания к операции. В особенно сложных случаях могут назначить лапароскопию – это мини-операция, при которой в передней брюшной стенке делают прокол, вводят в живот видеокамеру и осматривают его изнутри, выявляя источник проблемы. Если проблема найдена – например, аппендицит или кишечная непроходимость, диагностическая лапароскопия может перейти в лечебную операцию.
Да, такие ситуации бывают:
✓ это приступы периодической болезни (периодической средиземноморской лихорадки) – наследственного заболевания, которое связано с национальностью, болеют обычно армяне, евреи, ассирийцы. Болезнь проявляется в повторяющихся приступах боли по всему животу с повышением температуры. В крови повышаются лейкоциты и маркер воспаления – С-реактивный белок. Ситуация очень похожа на хирургическую, но учет национальности, рассказа о повторении стереотипных приступов и наличия похожих болевых эпизодов у ближайших родственников позволят избежать ненужной операции;
✓ приступы боли в животе при геморрагическом васкулите и порфирии. Эти нечастые болезни обычно известны пациенту, и он должен предупредить хирурга о них.
Одну ситуацию, когда может быть сделана необоснованная операция, разберем подробнее на клиническом примере. Подобные ситуации встречаются достаточно часто, а информированность о ней не только пациентов, но и врачей оставляет желать лучшего.

Девушка (25 лет) поступает в хирургическое отделение с жалобами на острую, невыносимой силы боль по всему животу с распространением в таз. Доставлена из аэропорта, прилетела из страны – члена Евросоюза. За границей в течение последних трех месяцев были выполнены две операции: по поводу аппендицита и кисты яичника, операции проводили при подобных приступах боли, но затем боль повторялась вновь. Хирург, осмотрев пациентку, увидел несоответствие между высокой интенсивностью боли и отсутствием симптомов раздражения брюшины, которые всегда сопровождают катастрофы в брюшной полости. Был созван консилиум, и подробный расспрос позволил установить, что приступы боли стали возникать после эмоционального потрясения, которое повторялось перед каждой госпитализацией. Данные анализов и УЗИ не выявили существенных проблем. Консилиум решил воздержаться от диагностической лапароскопии и выдвинул гипотезу о наличии соматоформного расстройства (когда психологическая проблема имитирует заболевания физического тела). Пациентке был внутривенно введен противотревожный препарат (диазепам), и в течение 20 минут боль была купирована и более не повторялась. Последующее лечение, включавшее курс антидепрессантов, пациентка получила у психотерапевта.
Читайте также:


