Формулировка диагноза септического эндокардита
Справочник болезней

Инфекционного эндокардита
• Ревматическая болезнь сердца.
• Врожденные (цианотичные) пороки сердца.
• Искусственные клапаны сердца.
• Гемодиализ.
• Венозные катетеры.
• Внутривенное введение препаратов.
• Иммунодепрессанты.
• Пожилой и старческий возраст.
Тромбоэмболий
• Вегетации >10 мм (Mohananey D, et al, 2018).
• Флотирующие вегетации.
• Поражение митрального клапана.
• Инфекция Staph. aureus.
БОЛЬШИЕ КРИТЕРИИ
1. Положительная культура крови
1.1. Типичные микробы в 2 пробах крови:
• Str. viridans, Str. gallolyticus (bovis), Staph. aureus, HACEK группа.
• Внебольничные Enterococci без первичного очага.
1.2. Повторные культуры крови, характерные для ИЭ:
• ≥2 культур крови с интервалом >12 ч.
• Все 3 культуры крови или большинство из ≥4 проб.
1.3. Культура Coxiella burnetti или IgG в титре >1:800.
2. Визуальные признаки
2.1. Эхокардиографические признаки:
• Вегетация,
• Абсцесс, псевдоаневризма, интракардиальная фистула.
• Перфорация или аневризма клапана.
• Новое частичное раскрытие искусственного клапана.
2.2. Аномальная активность возле искусственного клапана по 18Ф-ФДГ ПЭТ/КТ (имплантация >3 мес) или СПЕКТ/КТ сцинтиграфии с меченными лейкоцитами.
2.3. Паравальвулярное повреждение по КТ сердца.
МАЛЫЕ КРИТЕРИИ
1. Предрасполагающие заболевания сердца, инъекции.
2. Лихорадка >38°С.
3. Сосудистые феномены: эмболии крупных артерий, септические инфаркты легких, микотические аневризмы, внутричерепные кровоизлияния, кровоизлияния в конъюнктиву, повреждения Джейуэя.
4. Иммунные нарушения: гломерулонефрит, узелки Ослера, пятна Рота, ревматоидный фактор.
5. Культура крови, не соответствующая большим критериям, или серологические признаки активной инфекции микробом, способным вызвать ИЭ.
Определенный ИЭ = 2 больших, или 1 большой + 3 малых, или 5 малых.
Вероятный ИЭ = 1 большой + 1 малый или 3 малых.
Лечение острого ИЭ до выявления микроба
• Ампициллин + Оксациллин по 12 г/сут в 4 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м.
• Ванкомицин 30 мг/кг/сут в 2 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м.
• Ванкомицин 30 мг/кг/сут в 2 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м + Рифампин 900–1200 мг в 2 приема в/в, per os при нозокомиальном или раннем эндокардите искусственного клапана.
Стрептококк, чувствительный к пенициллину
• Цефтриаксон 2 г однократно или Амоксициллин 100–200 мг/кг/сут в 4 приема в/в [4 нед].
• Цефтриаксон 2 г однократно или Амоксициллин 100–200 мг/кг/сут в 4 приема в/в + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед].
• Ванкомицин 30 мг/кг/сут в 2 приема в/в [4 нед].
Стрептококк, относительно нечувствительный к пенициллину
• Цефтриаксон 2 г однократно или Амоксициллин 200 мг/кг/сут в 4 приема в/в [4 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед].
• Ванкомицин 30 мг/кг/сут в 2 приема в/в [4 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед].
• Терапия 6 вместо 4 нед при эндокардите искусственного клапана.
Стафилококк, чувствительный к метициллину
• Оксациллин 12 г/сут в 4 приема в/в [4–6 нед].
• Оксациллин 12 г/сут в 4 приема в/в + Рифампин 900–1200 мг в 2 приема в/в, per os [≥6 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед] при искусственном клапане.
Стафилококк, нечувствительный к метициллину
• Ванкомицин 30–60 мг/кг/сут в 2 приема в/в [4–6 нед].
• Даптомицин 10 мг/кг однократно в/в [4–6 нед].
• Ванкомицин 30–60 мг/кг/сут в 2 приема в/в + Рифампин 900–1200 мг в 2 приема в/в, per os [≥6 нед] + Гентамицин 3 мг/кг однократно в/в, в/м [2 нед] при искусственном клапане.
Сердечная недостаточность
• Выраженная регургитация или обструкция с симптомами СН или эхокардиографическими признаками нарушенной гемодинамики.
• Отек легких или кардиогенный шок.
Неконтролируемая инфекция
• Локальная: абсцесс, ложная аневризма, фистула, растущие вегетации.
• Инфекция грибами или мультирезистентными микроорганизмами.
• Персистирующая позитивная культура крови, несмотря на адекватную антибиотикотерапию и контроль септических метастатических очагов.
• Эндокардит искусственных клапанов, вызванный стафилококками или не-HACEK грамотрицательными бактериями.
Профилактика эмболий
• Эндокардит аортального или митрального клапанов с персистирующими вегетациями >10 мм после ≥1 эмболического эпизода, несмотря на адекватную антибиотикотерапию.
• Эндокардит аортального или митрального клапанов с изолированными вегетациями >30 мм.
Особые формы инфекционного эндокардита
Эндокардит протезированных клапанов
2. Вторичный, на измененных клапанах
Эндокардит при гемодиализе
а) с относительно благоприятным прогнозом
Эндокардит при кардиомиопатиях
б) с неблагоприятным прогнозом
Инфекционный эндокардит при пролапсе митрального клапана.
Иммунологический вариант течения (миокардит, гломерулонефрит, артрит, васкулит)
Примеры формулировки диагноза инфекционного эндокардита
1.Осн: Инфекционный эндокардит, первичный, вызванный s. Viridans, подострое течение
ОСЛ: Аортальная недостаточность. Недостаточность кровообращения IIа стадии с приступами сердечной астмы. Геморрагический васкулит, кожно - суставная форма.
2.ОСН:Инфекционный эндокардит, первичный, неутонченной этиологии, с поражением аортального и митрального клапана, подострое течение
ОСЛ: Септическая пневмония с локализацией в нижней доле правого легкого. Дыхательная недостаточность 2 степени. Острый гломерулонефрит, смешанная (протеинурическая-гематурическая) форма. ОПН, олигоурический период. Гипохромная анемия средней степени тяжести
3. ОСН: Инфекционный эндокардит, первичный, вызванный S. aureus, острое течение, с поражением аортального клапана.
ОСЛ: Бактериально-токсический шок. Острый ДВС-синдром. Тромбоэмболия правой плечевой артерии.
4. ОСН: Инфекционный эндокардит, вторичный, неуточненной этиологии, затяжное течение.
ОСЛ: Инфекционно-аллергический полиартрит с поражением коленных и голеностопных суставов. Кожный васкулит. Нормохромная анемия, средней степени тяжести.
СОП: Ревматизм неактивная фаза. Сочетанный аортальный порок сердца с преобладанием стеноза. НК IIа.
Дифференциальный диагноз инфекционного эндокардита.
Дифференциальный диагноз инфекционного эндокардита сложен.
Однако при всем многообразии клинических симптомов, можно выделить З группы заболеваний, которые первоначально чаще всего диагностируются у больных первичным подострым инфекционным эндокардитом.
Первую большую группу составляют острые инфекционные заболевания: грипп, пневмонии, туберкулез, сепсис. Эти диагнозы ставят с одинаковой частотой у лиц молодого, среднего и пожилого возраста.
Ко второй группе заболеваний, которые ошибочно диагностируют у больных ИЭ, относятся ревматизм, системная красная волчанка, реже узелковый периартериит.
Третья группа ошибочных диагнозов включает предположение о лимфопролиферативных заболеваниях, но чаще о злокачественных опухолях различной локализации, особенно у лиц пожилого и старческого возраста. Основанием для ошибочной диагностики являются повышение температуры тела, нарастающая общая слабость, снижение массы тела, анемия, повышение СОЭ Сходная, с первичным подострым инфекционным эндокардитом, клинико-лабораторная картина может наблюдаться у лиц пожилого и старческого возраста при наличии у них таких заболеваний, как простатит, пиелонефрит, холецистит.
Далее приведены некоторые наиболее часто дифференцируемые с инфекционным эндокардитом заболевания:
1. При острой ревматической лихорадке (ОРЛ) в отличие от первичного ИЭ прослеживается хронологическая связь с А-стрептококковой инфекцией глотки, полиартрит имеет симметричный и мигрирующий характер, отмечается преимущественное поражение митрального клапана сердца с более медленным формированием порока. Характерно быстрое обратное развитие клинических и лабораторных симптомов на фоне противовоспалительной терапии.
Более сложен процесс дифференциальной диагностики повторной атаки ОРЛ и вторичного ИЭ на фоне приобретенного порока сердца. Наличие в ближайшем анамнезе медицинских манипуляций, сопровождающихся бактериемией, а также:
ознобов даже при субфебрильной температуре тела,
быстрое формирование нового порока сердца (или усугубление уже имеющегося) с преобладанием клапанной регургитации и развитием застойной недостаточности кровообращения,
появление петехий на коже и слизистых,
высокие лабораторные параметры воспалительной активности
отсутствие эффекта от противовоспалительной терапии
- заставляет заподозрить наличие вторичного ИЭ еще до получения данных ЭхоКГ и исследования на гемокультуру.
2. Для установления диагноза системной красной волчанки большое значение имеют молодой возраст, женский пол, усиленное выпадение волос, эритема на щеках и над скуловыми дугами, фотосенсибилизация, язвы в полости рта или носа. Наиболее частым симптомом поражения сердца при этом заболевании является перикардит; клапанная патология - эндокардит Либмана-Сакса - развивается значительно позднее и относится к категории признаков высокой активности болезни. Следует отметить, что антинуклеарный фактор и антитела к нативной ДНК могут выявляться и при ИЭ, однако повторное обнаружение данных показателей в высоких титрах более характерно для системной красной волчанки.
3. Достаточно сложен дифференциальный диагноз ИЭ со злокачественными новообразованиями, особенно у лиц пожилого возраста. Высокая лихорадка часто отмечается при гипернефроме, опухолях толстого кишечника, поджелудочной железы и др. У таких больных при наличии опухоли наблюдается анемия, ускорение СОЭ. В то же время у пожилых людей следствие хронической ишемической болезни сердца или атеросклероза аорты, нередко встречается шумы регургитации. В подобных ситуациях, прежде чем остановиться на диагнозе ИЭ, необходимо настойчиво искать опухоль, применяя все современные диагностические методы. Следует иметь в виду, что у больных пожилого и старческого возраста возможно сочетание ИЭ и опухоли
4. Значительные трудности представляет дифференциальная диагностика ИЭ и хронического пиелонефрита в стадии обострения, особенно у пожилых больных. Так, развитие пиелонефрита с характерной клинической картиной (лихорадка с ознобом, анемия, ускорение СОЭ, иногда - бактериемия) может наводить на мысль о наличии ИЭ с вовлечением в процесс почек. С другой стороны, у больных, длительно страдающих пиелонефритом, возможно развитие ИЭ, вызванного микрофлорой, наиболее часто встречающейся при инфекциях мочевыводящих путей (кишечная палочка, протей, энтерококки и др.)
Неврологические осложнения инфекционного эндокардита
Шевченко Ю.Л., Кузнецов А.Н., Тюрин В.П. Национальный медико-хирургический центр имени Н.И.Пирогова, Москва
Ни одно заболевание сердца не может сравниться с инфекционным эндокардитом по частоте, разнообразию и тяжести неврологических осложнений. Не случайно, что более ста лет назад Ослер описал инфекционный эндокардит как триаду, состоящую из лихорадки, сердечного шума и гемиплегии [1]. Инфекционный эндокардит является чрезвычайно тяжелым заболеванием с летальностью, достигающей при консервативном лечении 80% (общая летальность составляет [2, 3]. В настоящее время инфекционный эндокардит вышел на четвертое место по уровню смертности среди инфекционных синдромов после уросепсиса, пневмонии и перитонита и занял нишу социально обусловленных заболеваний [4]. Несмотря на успехи в диагностике и лечении инфекционного эндокардита частота неврологических осложнений заболевания остается в последние три десятилетия на уровне (по нашим данным — около 25%) [5, 6, 7, 8, 9, 10, 11]. Присоединение неврологических осложнений значительно увеличивает летальность. При мозговой эмболии на фоне инфекционного эндокардита она колеблется между 20% и 80% (по нашим данным — около 60%), а в доантибиотическую эру она составляла 100% [5, 11, 12, 13, 14]. Основными этиопатогенетическими факторами при инфекционном эндокардите являются: травма эндокарда, бактериемия и ослабление резистентности организма. Спектр наиболее частых возбудителей и предрасполагающих кардиальных повреждений к настоящему времени претерпел некоторые изменения. Ревматическое заболевание сердца было одним из наиболее распространенных заболеваний сердца, предрасполагающих к эндокардиту (вторичный инфекционный эндокардит), но сейчас чаще развивается первичный инфекционный эндокардит, то есть поражение условно неизмененных клапанов сердца. Вместе с изменениями предрасполагающих условий изменились и возбудители эндокардита. Наиболее частыми остаются стрептококки и стафилококки, однако, частота стрептококковой этиологии снижается, а стафилококковой — растет, кроме того, в последние годы продолжает расти доля энтерококка, а также грамотрицательной флоры, микоплазм, вирусов, грибов, риккетсий, вероятно, вследствие иммуносупрессии, изменения клапанного субстрата и использования антимикробных средств. Неврологические осложнения у больных инфекционным эндокардитом чаще развиваются при поражении золотистым стафилококком [3, 11, 12, 15, 16]. Характерный патологический признак инфекционного эндокардита — это наличие вегетаций на створках клапанов. Вегетации состоят из аморфного фибрина и тромбоцитов вместе с возбудителями и лейкоцитами, являясь, таким образом, инфицированными белыми фибрин-тромбоцитарными тромбами. Возбудители, как правило, локализуются глубоко внутри вегетации и, таким образом, надежно защищены от антибактериальных факторов крови. Для обнаружения вегетаций используют эхокардиографию. Трансэзофагеальная эхокардиография значительно превосходит трансторакальное исследование — чувствительность достигает специфичность — [3]. У обследованных нами пациентов вегетации имели существенные различия: по размеру — от очень мелких до массивных (24 мм); по форме — шаровидные, булавовидные, лентовидные, дольчатые; по характеру прикрепления к клапану — на узком основании, на широком основании; по подвижности — флотирующие, фиксированные; по структуре — рыхлые, организованные. Очень важной является последняя характеристика, поскольку она отражает активность инфекционного процесса в сердце и эмбологенный потенциал вегетаций. Шестидесятиминутный транскраниальный допплеровский мониторинг кровотока по средней мозговой артерии позволяет детектировать микроэмболические сигналы (МЭС) у больных инфекционным эндокардитом. В нашем исследовании все пациенты с МЭС имели свежий инфекционный эндокардит (давность не более 2 месяцев) и рыхлые вегетации по данным эхокардиографии. При давности эндокардита более 2 месяцев МЭС не обнаруживались. Появление МЭС связано с пассажем мелких фрагментов рыхлых клапанный вегетаций, а также агрегатов тромбоцитов, образующихся в турбулентном потоке вблизи пораженного клапана. Неврологические осложнения наиболее часто возникают до начала антибактериальной терапии и в первую неделю ее проведения. В подавляющем большинстве случаев церебральная эмболия развивается в течение первого месяца от момента появления симптомов эндокардита. В этот период вегетации являются рыхлыми и могут легко фрагментироваться, вызывая эмболизацию. Затем в процессе адекватной антибактериальной терапии происходит уплотнение вегетаций. По данным эхокардиографии, выполненной в динамике, вегетации становятся плотными и прочными, они организуются, покрываются эндотелием и уже реже вызывают эмболии. Неврологические осложнения инфекционного эндокардита связаны с количеством, размером, локализацией и инфицированностью эмболов. Пациенты с инфекционным эндокардитом могут переносить инфаркт головного мозга, интрацеребральную и субарахноидальную геморрагию, микотическую аневризму, энцефалопатию, внутримозговой абсцесс, менингит и менингоэнцефалит. Ишемический инсульт является наиболее частой неврологической манифестацией инфекционного эндокардита (по данным литературы — у пациентов с инфекционным эндокардитом, по нашим данным — у 20%). Методы нейровизуализации демонстрируют в большинстве случаев множественные ишемические очаги, из которых примерно половина — корковые, локализующиеся в бассейнах концевых ветвей мозговых артерий, а другая половина представляет собой лакунарные очаги, располагающиеся в глубине полушарий мозга на границе серого и белого вещества. При небольших размерах очагов течение инсульта является достаточно доброкачественным. МРТ является более информативным методом исследования, чем КТ, в выявлении очагового поражения головного мозга у больных инфекционным эндокардитом. Наиболее часто поражается бассейн левой средней мозговой артерии. Церебральная геморрагия имеет место приблизительно у пациентов с инфекционным эндокардитом (по нашим данным — у 5%), чаще при поражении Staphylococcus aureus, и происходит вследствие трех отдельных патофизиологических механизмов. Церебральная септическая эмболия с последующим эрозивным артериитом является причиной и ранней геморрагии, и образования микотических аневризм с их последующим разрывом. Геморрагическая трансформация ишемического инфаркта дополняет данную триаду. Экспериментальные исследования церебральной септической эмболии документируют появление септического артериита в течение 1 дня после эмболии. Считается, что сосудистая деструкция возникает вследствие проникновения микроорганизмов из просвета сосуда в пространства Вирхова-Робена через vasa vasorum окклюзированного сосудистого сегмента. Микроорганизмы затем проникают в адвентицию сосуда, разрушая более медиальные слои до тех пор, пока не достигнут внутренней эластической пластинки. Микотические аневризмы по данным литературы имеют место у 5%-12% пациентов с эндокардитом (по нашим данным — около 1%). Примерно половина микотических аневризм разрывается с развитием интрацеребральной геморрагии или субарахноидального кровоизлияния. Иногда разрыв аневризм происходит спустя месяцы после излечения эндокардита. Летальность при разрыве достигает 80%. У 30% больных при антибиотикотерапии аневризмы подвергаются обратному развитию, а также менее вероятен разрыв аневризмы. Острая энцефалопатия — второе по частоте неврологическое осложнение эндокардита (по данным литературы и нашим данным ее переносят около 20% пациентов с инфекционным эндокардитом). Патофизиологическими механизмами являются мультифокальная септическая микроэмболия с последующим образованием микроинфарктов и микроабсцессов, изменения интракраниальных артерий (периваскулярная пролиферация), мозговая дисциркуляция и интоксикация. Аутопсические исследования пациентов с неврологическими осложнениями эндокардита показывают множественные микроинфаркты у 23%, микроабсцессы — у 26%. Большие абсцессы головного мозга редки. Они имеют место менее чем в 1% случаев при эндокардите. Менингит и менингоэнцефалит развиваются примерно у 4% пациентов с инфекционным эндокардитом, являются, как правило, дебютом заболевания, и поражение клапанов сердца выявляется уже после постановки неврологического диагноза. Таким образом, неврологические осложнения при инфекционном эндокардите представляют собой довольно пеструю картину. Инфекционный эндокардит до сегодняшнего дня остается одним из наиболее трудно диагностируемых заболеваний, несмотря на хорошо известные клинические и лабораторные признаки. Особенно затруднена постановка правильного диагноза в случае дебюта заболевания неврологическими осложнениями. По нашим данным примерно у 10% больных инфекционный эндокардит дебютировал развитием неврологических осложнений в виде ишемического, геморрагического инсультов или субарахноидального кровоизлияния. В этом случае имеются некоторые отличительные особенности течения неврологической патологии, которые позволяют заподозрить инфекционный эндокардит в качестве причинного фактора.
- Начало развития неврологической симптоматики является острым, с захватом нескольких бассейнов кровоснабжения головного мозга. Очаговые симптомы поражения нервной системы часто не достигают выраженной степени. Более часто, чем при инсультах иного генеза, встречается общемозговая симптоматика (головная боль, оглушение и др.).
- При нейровизуализации выявляются множественные инфаркты мозга.
- Часто наблюдается повышение температуры тела еще до развития симптомов поражения нервной системы.
- При лабораторных исследованиях выявляется: снижение уровня гемоглобина, снижение количества эритроцитов, лейкоцитоз, увеличение СОЭ.
- При УЗИ часто обнаруживается увеличение селезенки.
- При эхокардиографии выявляются клапанные вегетации.
, MD, North Shore Hospital, Auckland
Last full review/revision September 2017 by Guy P. Armstrong, MD







Эндокардит обычно означает инфекцию эндокарда (то есть инфекционный эндокардит). Термин эндокардит также может включать неинфекционный эндокардит, при котором стерильные тромбоциты и фибриновые тромбы фиксируются на клапанах сердца и прилегающем эндокарде. Неинфекционный эндокардит иногда может приводить к инфекционному эндокардиту. Оба могут привести к эмболизации и нарушению функции сердца.
Диагноз инфекционного эндокардита обычно устанавливается с учетом совокупности всех клинических данных, а не результата одного исследования.
Инфекционный эндокардит может возникнуть в любом возрасте. Мужчины заболевают в два раза чаще, чем женщины. Лица, употребляющие внутривенные наркотики, пациенты с ослабленным иммунитетом и пациенты с искусственными клапанами сердца и другими внутрисердечными устройствами имеют наибольший риск.
Этиология
Здоровое сердце относительно устойчиво к инфекции. Бактерии и грибы не легко адгезируются к поверхности эндокарда, и постоянный ток крови помогает предотвратить их оседание на эндокард. Таким образом, для развития эндокардита требуются, как правило, 2 условия:
Предшествующая аномалия эндокарда
Присутствие микроорганизмов в кровотоке (бактериемия)
Реже, массивная бактериемия или особо вирулентные микроорганизмы поражают нормальные клапаны.
Эндокардит часто поражает клапаны сердца. Основными предрасполагающими факторами ИЭ являются врожденные пороки сердца, ревматическое поражение клапанов, бикуспидальный или кальцинированный аортальный клапан, пролапс митрального клапана, гипертрофическая кардиомиопатия и предшествующий эндокардит. Протезирование клапанов и других внутрисердечных устройств представляет особый риск. Иногда пристеночные тромбы, дефекты межжелудочковой перегородки и область открытого аортального протока подвергаются инфицированию. Ядром инфекции является стерильная фибринозно-тромбоцитарная вегетация, формирующаяся при высвобождении поврежденными эндотелиальными клетками тканевых факторов.
Инфекционный эндокардит чаще всего поражает левые отделы сердца (например, митральный или аортальный клапаны). Примерно в 10–20% случаев поражаются правые отделы (трикуспидальный или пульмональный клапаны). Внутривенные наркоманы имеют более высокий риск развития правостороннего эндокардита (около 30–70%).
Микроорганизмы, поражающие эндокард, могут попадать из отдаленных очагов инфекции (например, кожный абсцесс, воспаленные или инфицированные десны, инфекция мочевыводящих путей) или через очевидные входные ворота, такие как центральный венозный катетер или места инъекций препаратов. Практически любой чужеродный имплантированный материал (например, желудочковый или перитонеальный шунт, протез) подвергается риску бактериальной колонизации, тем самым становясь источником бактериемии и, следовательно, эндокардита. Эндокардит может быть результатом асимптомной бактериемии, которая, как правило, возникает во время инвазивных стоматологических, медицинских или хирургических вмешательств. Даже чистка зубов и жевание могут приводить к бактериемии (обычно зеленящим стрептококком) у пациентов с гингивитом.
Возбудители различаются в зависимости от места инфекции, источника бактериемии и факторов риска пациента (например, внутривенные наркоманы), но в 80–90% случаев стрептококки и Staphylococcus aureus являются причиной ИЭ. Энтерококки, грам-отрицательные бациллы, микроорганизмы группы HACEK (Haemophilus, гемофильные бактерии, Actinobacillus actinomycetemcomitans, Cardiobacterium hominis, Eikenella corrodens и Kingella kingae) и грибки являются причиной большинства других случаев.
Болезнь протекает в трех стадиях:
Бактериемия: микроорганизмы присутствуют в крови
Адгезия: микроорганизм присоединяется к аномальному или поврежденному эндотелию с помощью поверхностных адгезинов
Колонизация: пролиферация организма вместе с развитием воспаления, что приводит к образованию зрелых вегетаций
Многие из возбудителей образовывают полисахаридные биопленки, которые защищают их от иммунной защиты хозяина и препятствуют проникновению антибиотиков
Патофизиология
Эндокардит имеет локальные и системные осложнения.
Местные последствия инфекционного эндокардита включают:
Абсцессы миокарда с деструкцией тканей, а иногда и с нарушением проводимости (чаще при нижне-перегородочных абсцессах).
Внезапная, тяжелая клапанная регургитация может привести к сердечной недостаточности и смерти (чаще из-за поражения митрального или аортального клапана).
Аортит в связи с распространением инфекции из прилегающих структур.
Для больных с протезированными клапанами характерно развитие абсцессов клапанного кольца, обструктивных вегетаций, абсцессов миокарда и грибковых аневризм, что проявляется клапанной обструкцией, дисфункцией клапана и нарушением проводимости.
Системные осложнения в первую очередь обусловлены
Эмболизация инфицированным материалом из сердечного клапана
Иммуно-опосредованные явления (в основном при хронической инфекции)
Поражение правых камер сердца характеризуется развитием септических эмболий легочной артерии, которые могут привести к инфаркту легкого, пневмонии или эмпиеме. Поражение левых камер сердца может приводить к эмболиям любых органов, особенно часто почек, селезенки и центральной нервной системы. Микотические аневризмы могут формироваться в любых крупных сосудах. Часто развиваются эмболии кожи и сетчатки. Вследствие отложения иммунных комплексов развивается диффузный гломерулонефрит.
Классификация
Инфекционный эндокардит может иметь вялотекущее, подострое течение или более острое, молниеносное течение с высокой опасностью развития быстрой декомпенсации.
Подострый бактериальный эндокардит (ПБЭ), несмотря на агрессивность, обычно развивается незаметно и прогрессирует медленно (т.е от нескольких недель до месяцев). Источник инфекции или входные ворота часто не выявляются. Возбудителями ПСЭ чаще всего являются стрептококки (особенно зеленящий, микроаэрофильный, анаэробный, стрептококки группы D и энтерококки), реже причиной могут быть золотистый и эпидермальный стафилококки - S. aureus, Staphylococcus epidermidis, стрептококки Gemella morbillorum, Abiotrophia defectiva (ранее, Streptococcus defectivus), Granulicatella и требовательный к питательным средам Haemophilus. Стрептококковый подострый эндокардит часто развивается на пораженных клапанах после асимптомной бактериемии, вследствие инфекций периодонта, гастроинтестинальных и урогенитальных инфекций.
Острый бактериальный эндокардит (ОБЭ) обычно развивается внезапно и прогрессирует быстро (т.е. в течение дней). Источник инфекции или входные ворота часто легко выявляются. Когда инфекция высоко вирулентна или бактериальное воздействие массивно, острый бактериальных эндокардит может поражать нормальные клапаны сердца. Он обычно вызван золотистым стрептококком S. aureus, гемолитическим стрептококком группы А, пневмококком или гонококком.
Эндокардит протезированного клапана (ЭПК) развивается у 2–3% пациентов в течение первого года после протезирования клапана и в 0,5% в последующие годы. Чаще развивается после замены аортального клапана, нежели митрального и в одинаковой степени поражает как механические, так и биологические протезы. Раннее начало инфекции ( 2 мес. после хирургического лечения) вызвано главным образом инфицированием в ходе операции бактериями, резистентными к противомикробным препаратам (S. epidermidis, дифтероиды, колиформные бациллы, Candida, Aspergillus). Позднее начало инфекции происходит в основном в результате контаминации низко-вирулентными организмами во время оперативного вмешательства или при транзиторных бессимптомных бактериемиях, чаще всего благодаря попаданию стрептококка; S. epidermidis; дифтероидов; и требовательной к средам грамотрицательной палочки Haemophilus, Actinobacillus actinomycetemcomitans, и Cardiobacterium hominis.
Клинические проявления
Клиническая картина зависит от классификации, но она неспецифична.
Первоначально симптомы подострого бактериального эндокардита смазанные: субфебрильная лихорадка ( 39 ° С), ночные поты, утомляемость, недомогание и потеря веса. Возможны озноб и артралгии. Симптомы клапанной недостаточности могут быть первым признаком, ведущим к постановке диагноза. Первоначально менее чем ( ≤ ) у 15% пациентов наблюдается лихорадка или шумы в сердце, но со временем оба эти симптома развиваются практически у всех больных. Объективное исследование может выявлять бледность, лихорадку, изменение ранее существовавшего шума или появление шума новой регугитации и тахикардию.

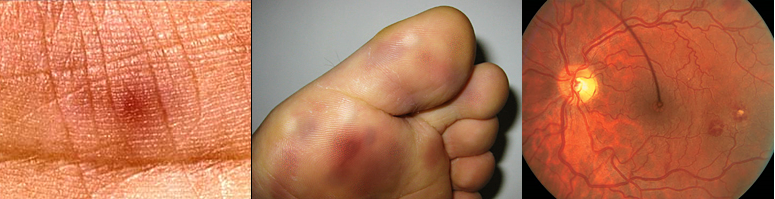
Этот пациент с инфекционным эндокардитом имеет множественные узелки Ослера (болезненные, эритематозные узелки на пальцах ног).
У данного пациента с инфекционным эндокардитом на ладонях видны множественные язвочки Джейнвея (безболезненные эритематозные папулы). На пальцах пациента также наблюдаются своеобразные узлы Ослера (болезненные, эритематозные узелки на пальцах).
На изображении слева показан узелок Ослера (мягкий эритематозный узелок) на большом пальце. На изображении справа показаны язвочки Джейнвея (безболезненные эритематозные пятна на ладони).
Точечные кровоизлияния представляют собой небольшие линейные кровоизлияния под ногтевыми пластинами.

На данной фотографии показаны конъюнктивальные петехии у пациента с инфекционным перикардитом.
На данной фотографии показано конъюктивальное кровоизлияние у пациента с инфекционным перикардитом.
На изображении слева показаны множественные пятна Рота или ретинальные кровоизлияния. Изображение справа – увеличенный снимок пятен Рота с бледной зоной в центре.
Клиническая картина острого бактериального эндокардита и эндокардита искусственного клапана подобна картине подострого бактериального эндокардита, но течение более быстрое. Лихорадка почти всегда выявляется в начале заболевания, у пациентов имеются симптомы интоксикации; иногда развивается септический шок. Сердечные шумы выявляются первоначально примерно у 50–80% пациентов и со временем у > 90%. Редко развивается гнойный менингит.
Септическая эмболия легочной артерии может вызывать кашель, плевральные боли в грудной клетке и иногда кровохарканье. Характерно наличие шума трикуспидальной регургитации.
Диагностика
Эхокардиография, иногда – другие методы получения изображения
Так как клиническая картина неспецифична, вариабельна и может развиться незаметно, диагностика требует высокой настороженности. Эндокардит следует подозревать у пациентов с лихорадкой без явных причин инфекции, особенно если есть шум в сердце. Настороженность в плане ИЭ должна быть очень велика в том случае, если имеются положительные результаты посева крови у пациентов с патологией клапанов сердца, у пациентов, которым недавно выполнялись инвазивные процедуры или у внутривенных наркоманов. Пациенты с доказанной бактериемией должны быть тщательно и многократно обследованы на предмет новых клапанных шумов и признаков эмболии.
Кроме позитивных посевов крови, других специфических лабораторных изменений нет. Установленные инфекционные поражения эндокарда часто приводят к нормохромной нормоцитарной анемии, лейкоцитозу, повышению СОЭ, увеличению уровня иммуноглобулинов, появлению циркулирующих иммунных комплексов и положительному ревматоидному фактору, но эти изменения не помогают в постановке диагноза. В общем анализе мочи часто выявляется микрогематурия, иногда эритроцитарные цилиндры, пиурия или бактериурия.
Идентификация возбудителя и определение его чувствительности к антибиотикам жизненно необходимы для определения тактики лечения.
Если заподозрен эндокардит, должно быть выполнено 3 забора крови на посев (20 мл каждый) в течение 24 ч (если клиническая картина представлена острым бактериальным эндокардитом, то 2 забора крови с интервалом между 1-м и 2-м в 1 час). Каждый новый забор крови должен быть произведен путем отдельной венепункции (т.е. не из ранее установленных внутрисосудистых катетеров). Забор крови не должен производиться во время наличия у пациента лихорадки или озноба, поскольку у большинства пациентов бактериемия носит постоянный характер. При эндокардите и в отсутствие предшествовавшей антибиотикотерапии все 3 посева образцов крови положительны, поскольку бактериемия продолжается; по крайней мере, 1 посев крови положительный в 99% случаев. Необходимо избегать преждевременного использования эмпирической антибактериальной терапии у пациентов с приобретенными или врожденными пороками во избежание эндокардитов с негативными посевами крови. Если ранее проводили антибактериальную терапию, следует также получить результаты гемокультуры, однако они могут быть отрицательными.
Посевы крови требуют 3–4-недельной инкубации для определенных микроорганизмов; однако некоторые запатентованные автоматически мониторирующие культуральные системы могут идентифицировать позитивные культуры в течение недели. Другие микроорганизмы (например, Aspergillus sp) могут не выявляться при посевах крови. Некоторые микроорганизмы (например, Coxiella burnetii, Bartonella sp, Chlamydia psittaci, Brucella sp) требуют серологической диагностики; другие микроорганизмы (например, Legionella pneumophila) требуют специальную культуральную среду или ПЦР (например, Tropheryma whippelii). Негативные результаты посевов крови могут быть следствием первичной антибактериальной терапии, инфицированности микроорганизмами, которые не растут на стандартных питательных средах, или указывать на другой диагноз (например, неинфекционный эндокардит, миксома предсердия с эмболиями, васкулит).
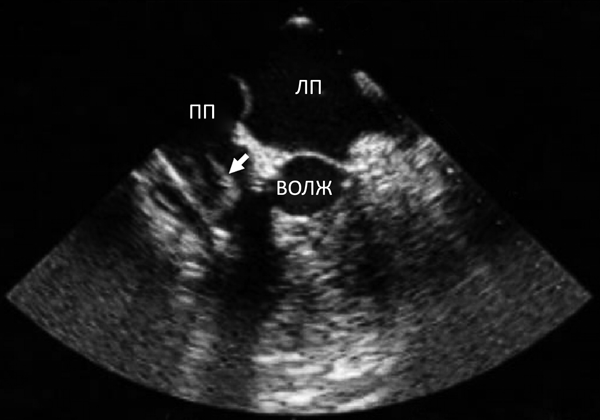
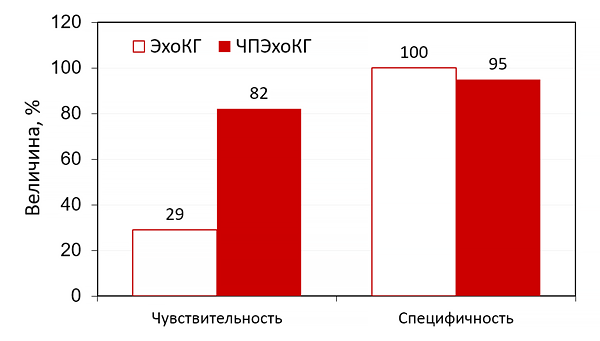
На начальном этапе необходимо выполнение эхокардиаграфии, обычно трансторакальной (ТТЭ), а не трансэзофагеальной (ТЭЭ). ТЭЭ является более чувствительной (т.е. способна выявлять вегетации маленького размера, невидимые при ТТЭ),
Чреспищеводную эхокардиографию следует проводить при таких случаях:
Пациенты имеют искусственный клапан
Трансторакальная эхокардиография не является диагностической
Диагноз инфекционного эндокардита был установлен клинически (проводится для выявления перфораций, абсцессов и свищей)
Иногда используется КТ, если при ЧПЭ не возможно точно определить околоклапанные абсцессы, а также для обнаружения микотических аневризм. ПЭТ является новым инструментом для диагностики эндокардита, который возникает в простетических и внутрисердечных устройствах. В настоящее время патологии, выявленные при КТ и ПЭТ включены в Европейские рекомендации в качестве основных критериев.
Инфекционный эндокардит достоверно диагностируется, когда микроорганизмы выявляются гистологически (или культурально) в эндокардиальных вегетациях, полученных в ходе операции на сердце, эмболэктомии или аутопсии. Так как вегетации обычно недоступны для исследования, существуют разнообразные клинические критерии для установления диагноза. К ним относятся пересмотренные критерии Дюка (с чувствительностью и специфичностью > 90%— Диагностические требования к диагнозу инфекционного эндокардита в соответствии с пересмотренными критериями Дюка а также Пересмотренные клинические критерии Дюка для диагностики инфекционного эндокардита) и модифицированные критерии Европейского общества кардиологии (ESC) 2015 года (1).
Критерии ESC аналогичны модифицированным критериям Дюка, но в качестве основных критериев включают результаты расширенной визуализации как указано далее:
Вегетации, абсцесс, псевдоаневризма, внутрисердечная фистула, клапанная перфорация или аневризма или новое частичное раскрывание створок искуссвенного клапана, которые выявлены при эхокардиографии
Аномальная активность вокруг искусственного клапана (имплантированного > 3 мес раньше), обнаруженная при ПЭТ/КТ или ОФЭКТ/КТ с лейкоцитами, меченными радиоактивными изотопами
Околоклапанные поражения, выявленные при КТ сердца
Критерии ESC также отличаются от малых модифицированных критериев Дюка, детализируя, что только лишь выявление бессимптомных сосудистых явлений при визуализации является достаточным.
Читайте также:


