Есть ли вакцина против африканской чумы свиней
федеральная служба по ветеринарному и фитосанитарному надзору
Это контагиозная септическая болезнь домашних свиней, в том числе декоративных, и диких кабанов. Болезнь может проявляться остро, подостро, хронически и бессимптомно, характеризуется лихорадкой, геморрагическим диатезом, воспалительными и некродистрофическими изменениями паренхиматозных органов. Инкубационный период составляет от 3 до 15 суток, а летальность может достигать 100%. В России АЧС регистрируется с 2007 года.
Специфические средства профилактики АЧС не разработаны.
При острой форме характерны: лихорадка до 41-42°С в течение 3-7 дней, угнетение, нарушение гемодинамики - цианоз (посинение) или гиперемия (покраснение) кожи ушей, живота, промежности и хвоста. АЧС сопровождается диареей, иногда с примесью крови, кровянистыми истечениями из носовой полости, клоническими судорогами, у супоросных свиноматок - абортами. Как правило, гибель животных наступает на 5-10 сутки от начала заболевания. Выжившие животные пожизненно остаются вирусоносителями.
Возбудителем АЧС является ДНК-содержащий вирус рода Asfivirus, семейства Asfarviridae, размер его вириона
200 нм. Для вируса АЧС установлено несколько сероиммунотипов и генотипов. Его обнаруживают в крови, лимфе, во внутренних органах, секретах и экскретах больных животных. Вирус устойчив к высушиванию и гниению, разрушается при тепловой обработке при температуре 70°С в течение не менее 0,5 часа; обладает цитопатическим действием и гемадсорбирующими свойствами.
Основным источником возбудителя АЧС являются больные, переболевшие и/или павшие от АЧС домашние свиньи и дикие кабаны, а также их органы, кровь, ткани, секреты, экскреты.
Передача возбудителя АЧС осуществляется путем непосредственного контакта домашней, в том числе декоративной свиньи, дикого кабана с больным или павшим животным, пищевыми продуктами и сырьем, полученными от них, при контакте с контаминированными возбудителем АЧС кормами, одеждой, объектами окружающей среды, включая почву, воду, поверхности помещений, оборудования, транспортные и технические средства.
В эпизоотическом очаге проводится изъятие всех свиней и полученной от них продукции животноводства.
В первой угрожаемой зоне (в радиусе не менее 5 км от эпизоотического очага) в хозяйствах, не отнесенных к IV компартменту проводится изъятие всех свиней и полученной от них продукции животноводства или направление на убой и переработку на предприятия, расположенные в первой угрожаемой зоне.
Во второй угрожаемой зоне (прилегающая к первой угрожаемой зоне территория, радиусом до 100 км от границ эпизоотического очага) с целью выявления циркуляции вируса АЧС проводятся наблюдения за клиническим состоянием свиней с отбором проб от всех подозреваемых в заболевании свиней и их лабораторными исследованиями на АЧС
В бывшем эпизоотическом очаге и первой угрожаемой зоне – через 1 год после отмены карантина. В свободных помещениях, не занятых после уничтожения свиней, до истечения указанного срока разрешается размещение и содержание животных других видов (включая птиц).
Для свиноводческих хозяйств, работающих в режиме закрытого типа – с разрешения специальной комиссии через 8 месяцев после отмены карантина при условии получения отрицательного результата на АЧС при проведении ветеринарного обследования и постановке биологического контроля группы животных сроком не менее чем 60 дней.
- обеспечить безвыгульное содержание свиней;
- соблюдать ветеринарные правила содержания свиней;
- не допускать загрязнения окружающей среды отходами животноводства;
- предоставлять поголовье свиней для проводимых ветслужбой вакцинаций (против классической чумы свиней, рожи);
- ежедекадно обрабатывать свиней и помещение для их содержания от кровососущих насекомых (клещей, вшей, блох), постоянно вести борьбу с грызунами;
- не завозить свиней без согласования с Госветслужбой;
- не использовать необезвреженные корма животного происхождения, особенно боенские отходы;
- ограничить связи с неблагополучными территориями;
- немедленно сообщать о всех случаях заболевания свиней в государственные ветеринарные учреждения по зонам обслуживания.
В качестве материалов использовано приложение к приказу Минсельхоза России от 31 мая 2016 г. № 213
Это острая высококонтагиозная болезнь, характеризующаяся септицемией. Болеют свиньи всех возрастов и пород в любое время года. Болезнь быстро принимает размеры эпизоотии и панзоотии и наносит свиноводству огромный экономический ущерб. Смертельность при этой болезни достигает 100%. В нашей стране не регистрируется, однако имеется опасность заноса ее.
Вирус африканской чумы свиней иммунобиологически отличается от вируса классической чумы свиней. Это ДНК-содержащий вирус семейства Asfarviridae; размер вириона 175—215 нм. Установлено несколько сероиммуно- и генотипов вируса африканской чумы свиней. Его обнаруживают в крови, лимфе, во внутренних органах, секретах и экскретах больных животных. Вирус устойчив к высушиванию и гниению; при температуре 60°C инактивируется в течение 10 минут. Его культивируют в культурах клеток лейкоцитов и костного мозга свиней; он обладает цитопатическим действием и гемадсорбирующими свойствами.
В естественных условиях к африканской чуме свиней восприимчивы домашние и дикие свиньи всех возрастов. Источник возбудителя инфекции — больные животные и вирусоносители. Заражение здоровых свиней происходит при совместном содержании с инфицированными вирусоносителями. Факторы передачи возбудителя — корм, пастбища, транспортные средства, загрязнённые выделениями больных животных.
Африканская чума свиней не имеет никакого отношения к вирусу гриппа A/H1N1 и для человека не опасна.
Употреблять в пищу свинину безопасно, поскольку вирус погибает при термической обработке в 70 градусов. Ограничения на ввоз мясной продукции из карантинных зон связаны, прежде всего, с опасностью распространения вируса на большие территории, а также тем, что перекупщики пытаются организовать реализацию свинины в обход карантинных постов.
Впервые африканская чума свиней зарегистрирована в 1903 году в Южной Африке. На первом этапе естественной истории, до выноса в Португалию (1957) и Испанию (1960), африканская чума свиней имела стереотип типичной природно-очаговой экзотической болезни с естественной циркуляцией вируса в популяциях диких африканских свиней, внутрисемейной передачей и течением в виде персистентной толерантной инфекции; при возникновении первых случаев антропургического цикла на домашних (неаборигенных) свиньях инфекция приобретала острое течение с летальностью до 100%.
Эффективных средств профилактики африканской чумы свиней до настоящего времени не разработано, лечение запрещено.
Эффективных средств профилактики африканской чумы свиней до настоящего времени не разработано, лечение запрещено. В случае появления очага инфекции практикуется тотальное уничтожение больного свинопоголовья бескровным методом, а также ликвидация всех свиней в очаге и радиусе 20 км от него. Больные и контактировавшие с больными животными свиньи подлежат убою с последующим сжиганием трупов.
Владельцам личных подсобных хозяйств, в которых имеется свинопоголовье, необходимо соблюдать ряд правил, выполнение которых позволит сохранить здоровье животных и избежать экономических потерь:
- предоставлять поголовье свиней для проводимых ветслужбой вакцинаций (против классической чумы свиней, рожи);
- содержать поголовье только закрытым (в базах, сараях), не допускать свободного выгула свиней на территории населённых пунктов, особенно в лесной зоне;
- ежедекадно обрабатывать свиней и помещение для их содержания от кровососущих насекомых ( клещей, вшей, блох), постоянно вести борьбу с грызунами;
- не завозить свиней без согласования с Госветслужбой;
- не использовать необезвреженные корма животного происхождения, особенно боенские отходы в рационах свиней;
- ограничить связи с неблагополучными территориями;
- немедленно сообщать о всех случаях заболевания свиней в государственные ветеринарные учреждения по зонам обслуживания.
В случае возникновения африканской чумы на неблагополучное хозяйство накладывается карантин. Все свинопоголовье в данном очаге инфекции уничтожают бескровным способом. Трупы свиней, навоз, остатки корма, малоценные предметы ухода сжигают. Золу закапывают в ямы, смешивая ее с известью. Помещения и территории ферм дезинфицируют горячим 3% раствором едкого натрия, 2% раствором формальдегида.
На расстоянии 10 км вокруг неблагополучного пункта все свинопоголовье убивают, а мясо перерабатывают на консервы. Карантин снимают через 6 месяцев с момента последнего случая падежа, а разведение свиней в неблагополучном пункте разрешается не ранее, чем через год после снятия карантина.
Фернандо Родригез, директор CReSA, рассказывает, на какой стадии находится разработка вакцины против АЧС.

Почему у нас все еще нет вакцины против АЧС?
Об АЧС не вспоминали достаточно долго, особенно, учитывая тот факт, что на территории Субсахарской Африки этот вирус оставался эндемичным с момента первого своего появления, увеличивая уровень нищеты и недоедания в затронутых им регионах. Даже когда это заболевание прописалось в Европе, число исследовательских групп, заинтересовавшихся этой темой, никогда не превышало одной дюжины, при этом, Испания и Португалия были теми странами, в которых таких исследователей было большинство. Поэтому, нет ничего странного в том, что за те 60+ лет, что мы знаем о существовании вируса, было опубликовано всего 1 454 об АЧС в общем, или 167 статей об АЧС и вакцинах.

Вирус АЧС сам по себе, как и его эпидемиологический цикл, является комплексным, у него есть более чем восприимчивый реципиент: свиньи и дикие кабаны в Европе. При этом, ситуация в Африке еще сложнее, поскольку там существуют два естественных резервуара: аргасовые клещи и африканские кабаны-бородавочники.
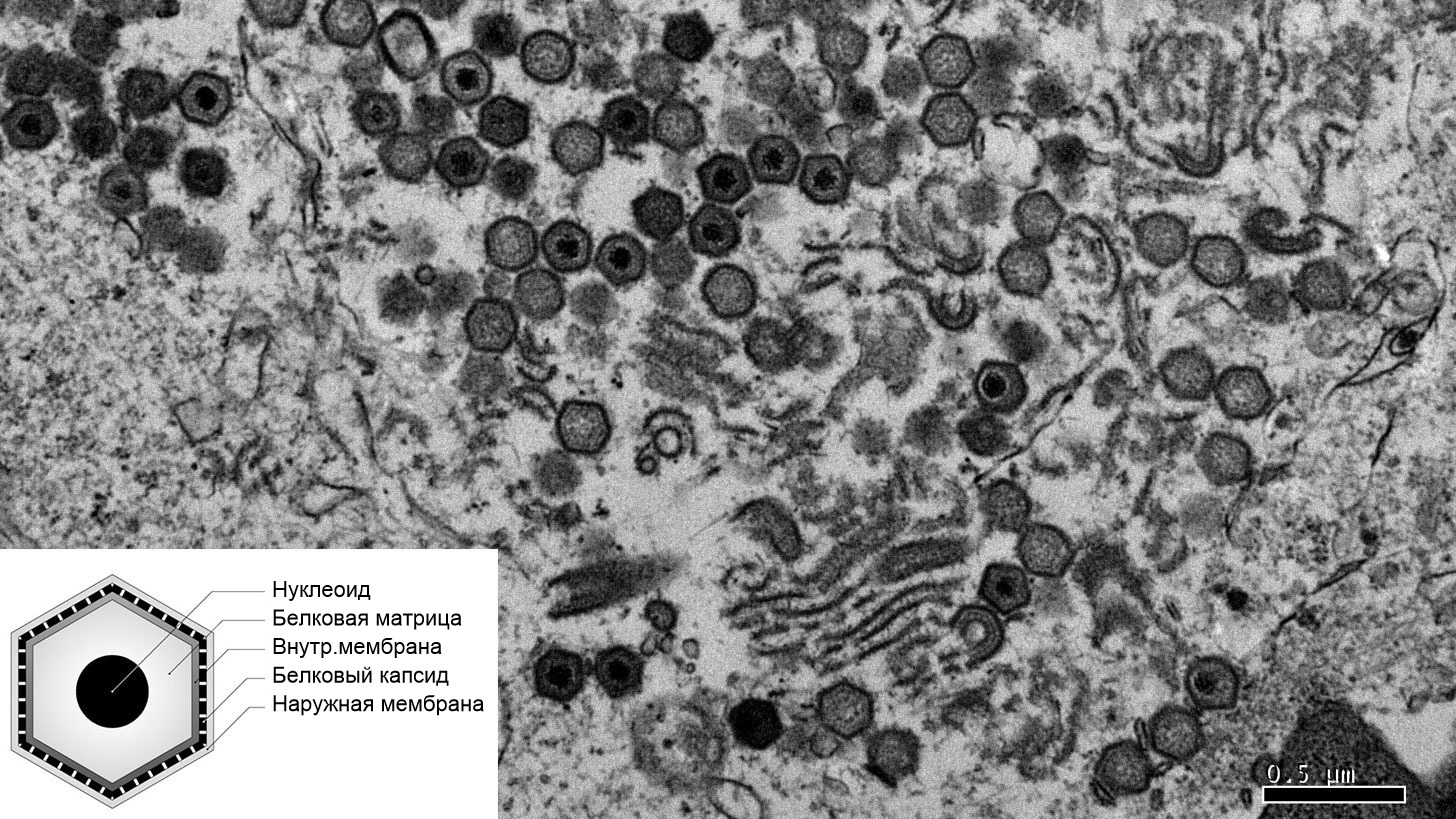
Изображение клетки, зараженной вирусом АЧС, на электронном микроскопе.
Тем не менее, и это абсолютно личная оценка, если что и осложнило ситуацию еще больше, так это наша исторически сложившаяся неспособность исследовать данную проблему основательным и скоординированным образом, при том, что к тому времени (начало 2000 г.г.) лучшие лаборатории были закрыты, поскольку существовало мнение, что этот вирус уже не представляет никакой угрозы. А теперь мы должны спешить.
На какой стадии находятся текущие исследования, направленные на разработку вакцины против АЧС? С какой нормативной базой вы работаете? Когда станет возможно получить вакцину против вируса АЧС?
Несмотря на все то, что пишут в последнее время, в поисках вакцины против АЧС сделаны огромные шаги вперед, и мы ближе, чем когда-либо к тому, чтобы объявить о хороших новостях. Что же касается типа вакцины, можно, в общих чертах, сказать:
- Классические инактивированные вакцины против вируса АЧС (АЧСв) не работают, по крайней мере, таким образом, как это планировалось – скорее всего, по причине их неспособности продуцировать цитотоксичные Т-клетки, требуемые для элиминации зараженных клеток.
- Живые аттенюированные вакцины, полученные как классическими методами, так и путем генетических манипуляций, дают фантастический уровень защиты, как минимум – от материнского вируса. На сегодняшний день считается, что данная стратегия находится ближе всех к рынку и почти все исследовательские группы, как показывает недавно составленный экспертами в данной области отчет Европейской Комиссии, очень на нее надеются. Это будет нелегко, поскольку созданные к настоящему моменту прототипы, в том числе разработанные в лаборатории USDA на Плам-Айленде, а также те, что были получены в сотрудничестве между Молекулярно-биологическим Центром Северо Очоа и CreSA-IRTA, в самом ближайшем будущем должны быть усовершенствованы, особенно в плане их безопасности и технической возможности ДИВЖ (которая позволяет отличить вакцинированных животных от заразившихся естественным путем). Консорциум, который был создан USDA-ARS и CReSA-IRTA, гарантирует оптимизацию прототипов. Интерес, проявленный деловыми кругами, а также финансирование, открытое ЕС позволяют с оптимизмом относиться к возможности выхода аттенюированной вакцины на рынок через 5-10 лет, обязательно при этом учитывая, что данные временные рамки предложены оптимистом-ученым, слабо разбирающимся в корпоративном маркетинге.
- Вакцины аттенюированные vs субъединичные. Тот же самый отчет Еврокомиссии призывает нас вести работу над вакцинами будущего, основанных на субъединицах. Сложность строения вируса, состоящего из более, чем 200 различных белков, а также трудность их введения в живой организм (in vivo) таким образом, чтобы они были оптимально представлены иммунной системе, подсказывают нам быть более консервативными в отношении периодов коммерциализации. Несмотря на их огромные преимущества в плане безопасности и возможности ДИВЖ (DIVA), мы должны учитывать проявляемую ими до настоящего времени невысокую действенность против смертоносных штаммов АЧСв. Нам следует продолжать работать плечом к плечу по обоим направлениям, идентифицируя и защищающий вирус антигены, и иммунологические механизмы, отвечающие за эту защиту. Короче говоря, требуется больше инвестиций на проведение базовых исследований.
Исходя из имеющейся информации, какой ожидается уровень эффективности вакцины?
Всегда непросто экстраполировать лабораторные результаты на полевые условия. Единственное, что мы можем сказать сегодня – это то, что имеющиеся в наших лабораториях прототипы вакцин защищают 100% свиней от ЭКСПЕРИМЕНТАЛЬНОГО ЗАРАЖЕНИЯ грузинским штаммом, толкуя защиту как способность животного избежать гибели (контрольные животные гибнут в течение 10 дней). И это правда, что некоторые животные демонстрируют, в течение непродолжительного периода, сниженное количество вируса, обнаруженного в крови и носовых секрециях, по сравнению с контрольными.
Какими целевыми характеристиками должна эта вакцина обладать ?
Критическое значение имеют уровень безопасности и возможность ДИВЖ. Мы не можем игнорировать тот факт, что это живая вакцина, поэтому ее использование должно производиться при наличии жестких гарантий безопасности. Использование вакцин на основе субъединиц будет намного более простым и менее рестриктивным.
Хотя введение путем инъекций будет, скорее всего, более благосклонно воспринято индустрией, нам не следует забывать и о составах для перорального применения (для использования, например, в приманках для диких кабанов), аналогично тому, как это происходит с проходящими проверку вакцинами против туберкулеза или классической чумы свиней.
Учитывая, какой удар болезнь нанесла за последние годы, достаточно ли ресурсов выделяется в мире на проведения исследований?
Возможно, в наши дни этой проблеме уделяется гораздо больше внимания и для борьбы с ней выделяется больше денег, однако, это не имеет никакого значения, если все не будет продолжаться.
Критика не только в адрес властей, которые зачастую не воспринимают болезнь достаточно серьезно, но также и в адрес исследователей, потому что мы иногда воспринимаем такие обстоятельства как возможность поохотиться на финансирование, не отдавая себя работе полностью в существующих сложнейших условиях. Ограниченность мировых ресурсов, в общих словах, должна заставить нас переосмыслить, каким образом использовать эти ресурсы наиболее рационально. Я пользуюсь представившейся возможностью публично поблагодарить за фонды, инвестированные испанским правительством в наше направление исследований, начиная с 2004 г., а также за их веру в эти исследования еще до того, как вирус АЧС вновь стал угрожать нашей экономике. Это позволило компаниям, вроде Boehringer Ingelheim (сначала), а теперь уже и другим, заинтересоваться нашим прогрессом. Мы считаем это большой удачей.
Полный текст:
На сегодняшний день эффективных мер специфической профилактики и лечения африканской чумы свиней не разработано. Стратегия борьбы с болезнью направлена на быструю диагностику инфицированных животных с последующим убоем и деконтаминационными мероприятиями (стемпинг аут). В настоящем обзоре представлена современная эпизоотическая ситуация по африканской чуме свиней, рассмотрены особенности генетической организации вируса и принципы генетической дифференциации изолятов. Российская Федерация неблагополучна по африканской чуме свиней с 2007 года. С этого времени заболевание является одной из ключевых проблем свиноводческой отрасли нашей страны, нанося огромный прямой и косвенный экономический ущерб. Болезнь продолжает неумолимо распространяться. Так, в январе 2014 года африканская чума свиней была занесена на территорию Литвы, позднее охватила Польшу, Латвию, Эстонию, Румынию, Венгрию, Бельгию, Молдову, а с 2018 года вспышки болезни регистрировали уже и в Азии (Китай, Вьетнам, Монголия). Особая структура вируса, длинный нерасшифрованный геном, включая гены с неизвестной функцией, а также циркуляция 24 генотипов и 9 серотипов вируса являются причиной отсутствия эффективной вакцины против африканской чумы свиней. Показано, что использование большого количества специфических генетических маркеров при определении родства и изучении путей распространения вируса африканской чумы свиней в мире является наиболее точным методом.
Биолог, кандидат биологических наук
1. Анализ изменений генетической структуры и биологических свойств вируса африканской чумы свиней при адаптации к перевиваемой культуре клеток / А. Мазлум, Н. Г. Зиняков, А. С. Першин [и др.] // Ветеринария сегодня. – 2018. – № 4. – Р. 21–25; DOI: 10.29326/2304-196X2018-4-27-21-25.
2. Анализ результатов мониторинговых исследований по выявлению ДНК вируса африканской чумы свиней, проведенных в 2017 г. / Д. Н. Федосеева, Е. В. Аронова, А. А. Варенцова [и др.] // Ветеринария сегодня. – 2018. – № 3. – С. 21–25; DOI: 10.29326/2304-196X-2018-3-26-21-25.
4. African swine fever virus controls the host transcription and cellular machinery of protein synthesis / E. G. Sanchez, A. Quintas, M. Nogal [et al.] // Virus Res. – 2013. – Vol. 173 (1). – P. 58–75; DOI: 10.1016/j.virusres.2012.10.025.
5. African swine fever virus eradication in Africa / M. L. Penrith, W. Vosloo, F. Jori, A. D. Bastos // Virus Res. – 2013. – Vol. 173 (1). – P. 228–246; DOI: 10.1016/j.virusres.2012.10.011.
6. African swine fever virus include multiple mechanisms for the manipulation of interferon responses / S. Correia, S. Ventura, S. Goodbourn, R. М. E. Parkhouse // Cytokine. – 2013. – Vol. 63 (3). – P. 256; DOI: 10.1016/j. cyto.2013.06.058.
7. African swine fever virus isolate, Georgia, 2007 / R. J. Rowlands, V. Michaud, L. Heath [et al.] // Emerg. Infect. Dis. – 2008. – Vol. 14 (12). – P. 1870–1874; DOI: 10.3201/eid1412.080591.
8. African swine fever virus replication and genomics / L. K. Dixon, D. A. Chapman, C. L. Netherton, C. Upton // Virus Res. – 2013. – Vol. 173 (1). – P. 3–14; DOI: 10.1016/j.virusres.2012.10.020.
9. African swine fever virus. EFSA Panel on Animal Health and Welfare (AHAW) // EFSA J. – 2015. – Vol. 13 (7):4163; DOI: 10.2903/j.efsa.2015.4163.
10. An update on the epidemiology and pathology of African swine fever / J. M. Sánchez-Vizcaíno, L. Mur, J. C. Gomez-Villamandos, L. Carrasco // J. Comp. Pathol. – 2015. – Vol. 152 (1). – P. 9–21; DOI: 10.1016/j.jcpa.2014.09.003.
11. Assessment of African swine fever diagnostic techniques as a response to the epidemic outbreaks in Eastern European Union Countries: How to improve surveillance and control programs / C. Gallardo, R. Nieto, A. Soler [et al.] // J. Clin. Microbiol. – 2015. – Vol. 53 (8). – Р. 2555–2565; DOI: 10.1128/JCM.00857-15.
12. Attenuated and non-haemadsorbing (non-HAD) genotype II African swine fever virus (ASFV) isolated in Europe, Latvia 2017 / C. Gallardo, A. Soler, I. Rodze [et al.] // Transbound. Emerg. Dis. – 2019. – Vol. 66 (3). – P. 1399–1404; DOI: 10.1111/tbed.13132.
13. Blome S., Gabriel C., Beer M. Pathogenesis of African swine fever in domestic pigs and European wild boar // Virus Res. – 2013. – Vol. 173 (1). – P. 122–130; DOI: 10.1016/j.virusres.2012.10.026.
14. Breese, Jr. S. S., De Boer C. J. Electron microscope observation of African swine fever virus in tissue culture cells // Virology. – 1966. – Vol. 28 (3). – P. 420–428; DOI: 10.1016/0042-6822(66)90054-7.
15. Comparison of the genome sequences of non-pathogenic and pathogenic African swine fever virus isolates / D. A. Chapman, V. Tcherepanov, C. Upton, L. K. Dixon // J. Gen. Virol. – 2008. – Vol. 89 (Pt. 2). – Р. 397–408; DOI: 10.1099/vir.0.83343-0.
16. Course and transmission characteristics of oral low-dose infection of domestic pigs and European wild boar with a Caucasian African swine fever virus isolate / J. Pietschmann, C. Guinat, M. Beer [et al.] // Arch. Virol. – 2015. – Vol. 160 (7). – P. 1657–1667; DOI: 10.1007/s00705-015-2430-2.
17. Detection of African swine fever antibodies in experimental and field samples from the Russian Federation: implications for control / L. Mur, A. Igolkin, A. Varentsova [et al.] // Transbound. Emerg. Dis. – 2016. – Vol. 63 (5). – P. 436–440; DOI: 10.1111/tbed.12304.
18. Dixon L. K. Molecular cloning and restriction enzyme mapping of an African swine fever virus isolate from Malawi // J. Gen. Virol. – 1988. – Vol. 69 (Pt. 7). – Р. 1683–1694; DOI: 10.1099/0022-1317-69-7-1683.
19. Enhanced discrimination of African swine fever virus isolates through nucleotide sequencing of the p54, p72, and pB602L (CVR) genes / C. Gallardo, D. M. Mwaengo, J. M. Macharia [et al.] // Virus Genes. – 2009. – Vol. 38 (1). – P. 85–95; DOI: 10.1007/s11262-008-0293-2.
20. Genetic characterization of African swine fever virus isolates from soft ticks at the wildlife/domestic interface in Mozambique and identification of a novel genotype / C. J. Quembo, F. Jori, W. Vosloo, L. Heath // Transbound. Emerg. Dis. – 2018. – Vol. 65 (2). – P. 420–431; DOI: 10.1111/tbed.12700.
21. Genetic characterization of African swine fever viruses from a 2008 outbreak in Tanzania / G. Misinzo, J. Magambo, J. Masambu [et al.] // Transbound. Emerg. Dis. – 2011. – Vol. 58 (1). – P. 86–92; DOI: 10.1111/j.1865- 1682.2010.01177.x.
22. Genetic characterization of circulating African swine fever viruses in Nigeria (2007–2015) / P. D. Luka, J. E. Achenbach, F. N. Mwiine [et al.] // Transbound. Emerg. Dis. – 2017. – Vol. 64. – P. 1598–1609; DOI: 10.1111/tbed.12553.
23. Genetic variation among African swine fever genotype II viruses, eastern and central Europe / C. Gallardo, J. Fernández-Pinero, V. Pelayo [et al.] // Emerg. Infect. Dis. – 2014. – Vol. 20 (9). – P. 1544–1547; DOI: 10.3201/ eid2009.140554.
24. Genome sequences derived from pig and dried blood pig feed samples provide important insights into the transmission of African swine fever virus in China in 2018 / X. Wen, X. He, X. Zhang [et al.] // Emerg. Microbes Infect. – 2019. – Vol. 8 (1). – P. 303–306; DOI: 10.1080/22221751. 2019.1565915.
25. Genomic analysis of highly virulent Georgia 2007/1 isolate of African swine fever virus / D. A. Chapman, A. C. Darby, M. Da Silva [et al.] // Emerg. Infect. Dis. – 2011. – Vol. 17 (4). – P. 599–605; DOI: 10.3201/eid1704.101283.
26. Genotyping field strains of African swine fever virus by partial p72 gene characterization / A. D. Bastos, M. L. Penrith, C. Crucière [et al.] // Arch. Virol. – 2003. – Vol. 148 (4). – P. 693–706; DOI: 10.1007/s00705-002-0946-8.
27. In vivo experimental studies of genotype II African swine fever virus (ASFV) isolates currently circulating in two Estonian counties / C. Gallardo, A. Soler, V. Delicado [et al.] // Proc. 10th Annual Meeting EPIZONE, 27–29 September 2016. – Madrid, 2016. – P. 81.
28. Molecular characterization of African swine fever virus (ASFV) isolates circulating in the Eastern European Union countries 2014–2016 / R. Nieto, A. Soler, I. Nurmoja [et al.] // Proc. 10th Annual Meeting EPIZONE, 27–29 September 2016. – Madrid, 2016. – P. 164.
29. Molecular epidemiology of African swine fever in East Africa / B. A. Lubisi, A. D. Bastos, R. M. Dwarka, W. Vosloo // Arch. Virol. – 2005. – Vol. 150 (12). – Р. 2439–2452; DOI: 10.1007/s00705-005-0602-1.
30. Molecular epidemiology of African swine fever virus studied by analysis of four variable genome regions / R. J. Nix, C. Gallardo, G. Hutchings [et al.] // Arch. Virol. – 2006. – Vol. 151 (12). – Р. 2475–2494; DOI: 10.1007/ s00705-006-0794-z.
31. Phylodynamics and evolutionary epidemiology of African swine fever p72-CVR genes in Eurasia and Africa / M. A. Alkhamis, C. Gallardo, C. Jurado [et al.] // PLoS ONE. – 2018. – Vol. 13 (2):e0192565; DOI: 10.1371/ journal.pone.0192565.
32. Phylogenomic analysis of 11 complete African swine fever virus genome sequences / E. P. de Villiers, C. Gallardo, M. Arias [et al.] // Virology. – 2010. – Vol. 400 (1). – P. 128–136; DOI: 10.1016/j.virol.2010.01.019.
33. Tandem repeat sequence in the intergenic region MGF 505 9R/10R is a new marker of the genetic variability among ASF Genotype II viruses / A. Elsukova, I. Shevchenko, A. Varentsova [et al.] // Proc. 10th Annual Meeting EPIZONE, 27–29 September 2016. – Madrid, 2016. – P. 78.
34. Variable and constant regions in African swine fever virus DNA // R. Blasco, M. Agüero, J. M. Almendral, E. Viñuela // Virology. – 1989. – Vol. 168 (2). – P. 330–338; DOI: 10.1016/0042-6822(89)90273-0.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.

С начала августа зарегистрированы очаги заболевания у домашних свиней в Приморском крае и Амурской области, а также заболевание установлено у диких кабанов на территории Приморского края. На территории Европейской части страны болезнь регистрируется на территории Волгоградской, Нижегородской, Тверской, Новгородской, Ленинградской и Ульяновской областей.
Из ближайших зарубежных соседей вспышки АЧС наблюдаются в Китае, Вьетнаме, Монголии. При этом процент устойчивых к вирусу АЧС диких кабанов растет, инкубационный период распространения болезни также увеличился.
Африканская чума свиней – это высококонтагиозная вирусная болезнь свиней, характеризующиеся быстрым распространением и 100% смертностью. В естественных условиях к африканской чуме свиней восприимчивы домашние и дикие свиньи всех возрастов. Естественное заражение происходит при контакте здоровых свиней с больными и вирусоносителями.
В естественных условиях заражение легко происходит при совместном содержании больных свиней со здоровыми, при контакте зараженных диких свиней с домашними, главным образом алиментарным путём. Очень часто заражение происходит при укусе заражёнными клещами, паразитирующими на коже больных или вирусоносителей. Факторами передачи возбудителей африканской чумы являются различные инфицированные объекты внешней среды (транспорт, предметы ухода, фураж, вода, навоз и др.). Особую опасность представляют продукты убоя заражённых свиней и образующиеся при их переработке пищевые продукты и боенские отходы. Механическими переносчиками вируса могут быть люди, а также различные домашние и дикие животные, птицы, грызуны, насекомые (мухи, вши), которые были в контакте с больными и павшими свиньями или находились на инфицированной территории.
В большинстве случаев животные гибнут внезапно, без характерных признаков. Часто у больных свиней на коже, в области внутренней поверхности бедер, на животе, шее, у основания ушей заметны красно – фиолетовые пятна, которые при надавливании не бледнеют. На нежных участках кожи могут появиться язвы.
Лечение болезни не разработано и запрещено. На сегодняшний день вакцины против африканской чумы свиней не существует.
При выявлении случаев заболевания свиней африканской чумой уничтожают бескровным методом не только зараженное поголовье, но и тех животных, которые контактировали с больными и в радиусе десятков километров от очага заражения. Трупы свиней сжигают.
Владельцам личных подсобных хозяйств, в которых имеется свинопоголовье, необходимо соблюдать ряд правил, выполнение которых позволит сохранить здоровье животных и избежать экономических потерь, а именно:
- регистрировать животных в государственном ветеринарном учреждении;
- по требованию ветеринарного врача предоставлять животных для вакцинации против классической чумы свиней;
- не реже 2-х раз в год проводить дегельминтизацию свиней;
- исключить выгульное содержание свиней;
- исключить скармливание свиньям пищевых отходов, не прошедших термическую обработку;
- не приобретать живых свиней в местах несанкционированной торговли. Свиней и корма для них приобретать только с ветеринарными сопроводительными документами, наличие которых гарантирует здоровье животных и качество кормов в ветеринарном отношении;
- исключить доступ птиц, собак, кошек в места содержания животных и места складирования кормов.
- соблюдать зоогигиенические и ветеринарно-санитарные нормы содержания и кормления свиней.
- проводить ежедневный клинический осмотр своего свинопоголовья. Немедленно извещать ветеринарных специалистов государственной ветеринарной службы обо всех случаях внезапного падежа или одновременного массового заболевания животных, а также об их необычном поведении.
Профилактические мероприятия против особо опасных болезней животных специалистами государственных ветеринарных учреждений проводятся бесплатно.
Читайте также:


