Бактериофаг от стрептококк агалактия в сперме
Часть микрофлоры организма составляют условно-патогенные бактерия, такие как стрептококки группы В рода агалактия. В норме они присутствуют в теле человека в низких концентрациях, не оказывая влияния на работу его органов и систем. Воспаление начинается при их интенсивном размножении, под воздействием внешних или внутренних провоцирующих факторов (изменения гормонального фона, падение иммунитета).
Что такое стрептококк агалактия
Группа условно-патогенных бактерий, называемая стрептококками, в небольших концентрациях может присутствовать в организме человека, не вызывая развития инфекции или воспаления. Все микроорганизмы рода Streptococcus по характеру роста на питательных средах подразделяют на гемолитические, негемолитические и зеленящие. Стрептококки из рода агалактия (Streptococcus agalactiae) относятся к грамположительным бета-гемолитическим стрептококкам группы В.
Бактерия попадает в организм после начала половой жизни, обитает во влагалище, прямой кишке, урогенитальном тракте и носоглотке. Существует риск заражения ребенка от инфицированной матери во время родоразрешения или незадолго до его начала). Показателями нормы считают концентрации не более 10 в 4 степени КОЕ/мл. Инфекции, вызываемые стрептококками этого типа при росте их концентраций, особенно опасны для новорожденных и людей пожилого возраста, для которых они чреваты уросепсисом, перитонитом и пневмонией, инфекциями костей и кожи.
К основным путям попадания бактерии рода агалактия в организм относят половой, бытовой, воздушно-капельный, пищевой, и пренатальный или интранатальный (от матери к новорожденному). Активное размножение стрептококков происходит на фоне нарушения баланса нормальной микрофлоры из-за ряда следующих факторов:
- ослабление иммунитета;
- нарушение правил интимной личной гигиены;
- регулярные спринцевания (у женщин);
- гормональные сбои;
- ношение нижнего белья из синтетических тканей;
- незащищенный сексуальный контакт.
Стрептококк агалактия у мужчин активизируется либо после секса без использования презерватива, либо на фоне дисбактериоза кишечника после антибиотикотерапии или в следствие влияния иных факторов. После первоначального инфицирования носитель становится способен передавать бактерию возбудителя своим половым партнерам (самый распространенный путь передачи инфекции).
Отдельную группу риска представляют собой новорожденные. По статистике, носителями стрептококка Agalactiae является около 30% всех здоровых женщин, у которых во время беременности на фоне гормональных изменений могут обостряться вызываемые патогенным микроорганизмом инфекции (циститы, уретриты и др.). Угроза заражения ребенка растет при следующих обстоятельствах:
- возраст матери старше 20 лет;
- аборты или выкидыши в медицинском анамнезе матери;
- преждевременные роды (до 37 недели);
- амнионит;
- хроническая инфекция мочеполовых путей;
- задержка внутриутробного развития;
- лихорадочный синдром во время родов.

Микроорганизмы типа агалактия при интенсивном размножении вызывают инфекционные заболевания мочеполовой системы, сопровождающиеся воспалительным процессом. Активность бактерии сопровождается выделением следующих соединений и токсичных веществ:
- Некротоксинов и летальных токсинов, провоцирующих некроз тканей.
- Лейкоцидина, разрушающего клеточный иммунитет.
- Стрептолизина, способствующего разрушению тканей.
- Амилаза, гиалуронидаза, протеиназа, способствующие распространению стрептококковой инфекции.

Симптомы увеличения концентрации стрептококка агалактии
Бактерия стрептококк агалактия в моче или влагалищном мазке в увеличенных концентрациях свидетельствует о текущем воспалительном инфекционном процессе. В зависимости от типа инфекции, проявляется характерная симптоматика:
- При инфицировании мочевыделительных путей – зуд или жжение в области половых органов, цервикального канала, учащенные болезненные мочеиспускания, отечность и покраснение половых губ или анальных складок, боли в нижней части живота, выделения из мочеиспускательного канала.
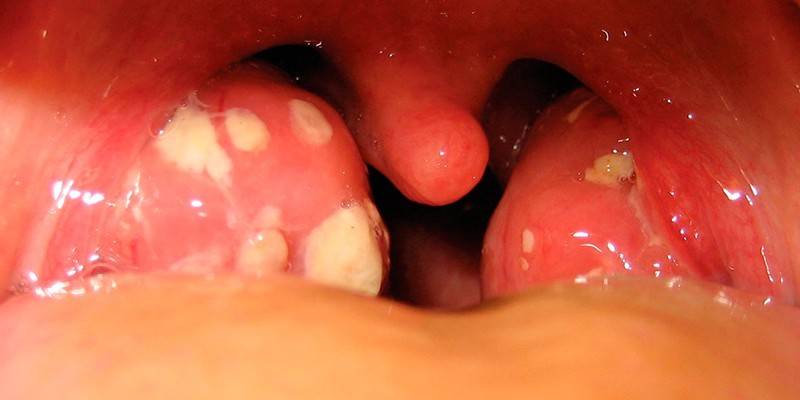
- При стрептококковом тонзиллите (ангине), фарингите и др. бактериальных инфекциях дыхательных путей – лихорадка, признаки тяжелой общей интоксикации, поражение слизистых.
Чем опасен стрептококк агалактия при беременности
Согласно статистике, стрептококки в мазке у женщин почти в 40% случаев обнаруживаются во время беременности. На фоне сниженного иммунитета максимально активное размножение агалактии наблюдается на 33-37 неделе, поэтому на этих сроках обязательно назначаются анализы для выявления возбудителя и его обезвреживания (при необходимости). Факторами, увеличивающими риск инфицирования, являются:
- обнаружения стрептококков этой группы в моче;
- диагностированная угроза преждевременных родов;
- диагностирование стрептококковой инфекции у предыдущих детей.
У беременной женщины агалактии могут вызывать воспаления мочеполовой системы, легких, спровоцировать следующие опасные осложнения беременности и родовой деятельности:
- эндометрит (воспаление внутренней оболочки матки);
- преждевременное отхождение околоплодных вод;
- хориоамнионит (воспаление плодных оболочек);
- выкидыш на любом сроке;
- преждевременное родоразрешение;
- сепсис, менингит, эндокардит(воспаление внутренней оболочки сердца) у новорожденного.
Диагностика
Обнаруживается стрептококк агалактия в мазке из влагалища, уретры или прямой кишки, который может быть назначен при обнаружении кокковой флоры в анализе мочи. После обследования биоматериала методом лабораторной микроскопии проводят посев на питательную среду, помогающий точно идентифицировать тип бактериального заражения, степень концентрации микроорганизмов и их устойчивость к антибактериальным препаратам.
Дополнительно назначаемыми анализами являются скрининг-тесты: ИФА (иммуноферментный анализ) и метод ПЦР (полимеразно-цепной реакции). Остальные лабораторные и инструментальные методы диагностики (общий и биохимический анализ крови, мочи, УЗИ и пр.) назначаются для выявления заболеваний, развитие которых вызвано активным размножением Streptococcus agalactiae.
Лечение streptococcus agalactiae
Необходимость медикаментозного лечения возникает при обнаружении концентраций стрептококков этой группы до 10 в четвертой степени КОЕ/мл и выше, даже если инфекция протекает скрыто. При воспалении мочеполовых органов терапию проходят оба половых партнера, при инфекции смешанного типа возможен прием антибиотиков разных фармакологических групп, при хронической форме заболевания пациенту с острой стадией болезни рекомендован прием иммуностимуляторов, ферментов, прохождение курса физиотерапии.
В зависимости от типа инфекции антибактериальные препараты назначаются в форме средств для перорально приема или в иных лекарственных формах (например, вагинальные таблетки или свечи Флуомизин, Тержинан, Гексикон,). Активность по отношению к агалактии проявляют пенициллины (Оксациллин, аминопенициллины), макролиды (Эритромицин) и Цефалоспорины (Цефазолин).
Если существует опасность заражения ребенка во время родов, матери назначаются внутривенные инъекции, проводимые прямо при родоразрешении, может рекомендоваться антибактериальная санация родовых путей перед родами. После курса антибиотиков и выведения бактерии требуется терапия с применение пробиотиков или энтеросорбентов (например, Атоксила) для восстановления естественной нормальной микрофлоры кишечника.
Профилактика
К профилактическим мерам предотвращения стрептококкового заражение является соблюдение правил личной гигиены и безопасности половых контактов, мероприятия по поддержанию естественного иммунитета, нормального баланса микрофлоры:
- полноценное питание;
- активный образ жизни, занятия спортом;
- здоровый режим дня;
- прием витаминов;
- закаливание организма, избегание переохлаждения;
- полноценный отдых;
- отказ от вредных привычек.

Стрептококк агалактия, беременность и бактериофаги.
В норме у 15 — 30% женщин репродуктивного возраста в 1 мл секрета влагалища может содержаться 10Λ3 КОЕ — 10 Λ5 КОЕ (допускается считать верхней границей нормы 10Λ4 КОЕ) стрептококка агалактия, который относится к ß — гемолитическим стрептококкам. Этот микроорганизм выделяют из влагалища 25 — 45% беременных женщин.
Однако основной резервуар стрептококка агалактия – это микрофлора кишечника, где их количество:
а) вместе с энтерококками не должно превышать:
— у детей до 1 года – 10^5- 10^7 КОЕ в 1 грамме кала;
— у детей старше 1 года и взрослых – 10^5 – 10^6 КОЕ в 1 грамме кала;
б) общее количество кокковых форм во всех возрастных группах должно быть не более 25%;
в) титры энтерококков в сумме со стретококками агалактия не должны превышать титры нормальной кишечной палочки:
— у детей до 1 года – это 10^8 – 10^9 КОЕ в 1 грамме кала;
— у детей старше 1 года и взрослых – это 10^6 – 10^8 КОЕ в 1 грамме кала.
Почему энтерококки? Потому, что энтерококки – это высоко колонизирующие микроорганизмы, которые считают бактериями резерва, в том числе и для стрептококка агалактия. Механизм трансформации до конца не изучен, но этот факт надо обязательно учитывать при оценке микробного сообщества толстого кишечника.
Бессимптомная колонизация влагалища встречается у 25% женщин, причём наиболее высок уровень инфицированности этим стрептококком у женщин моложе 20 лет, что связано с их половой активностью. Однако стрептококк агалактия при определённых условиях у таких женщин является причиной:
— инфекций мочевыводящих путей;
— бактериемий в родах и после них;
— преждевременного излития вод;
— преждевременной родильной деятельности;
— осложнения хирургических ран при кесаревом сечении.
Самая главная причина настороженности врачей к стрептококку агалактия состоит в его способности вызывать менингиты у новорожденных.
При родоразрешении через естественные родовые пути (это вертикальный путь заражения) риск передачи стрептококка агалактия новорожденному при инфицировании матери варьирует в диапозоне 50-70%, а при отсутствии инфицирования – только 8% (это, как правило, горизонтальная передача возбудителя через руки персонала и мединструментарий, обработанный с нарушением санитарно — противоэпдемических правил). На каждые 100 инфицированных новорожденных приходится только один случай клинически явной инфекции. Причём, риск заболевания доношенного ребёнка состаляет – 2%; недоношенного – до 20%, при сроке менее 28 недель беременности – 100%.
— затяжные роды (более 24 часов);
— раннее вскрытие плодного пузыря (оболочки разорвались на 18 часов раньше рождения ребёнка);
— наличие эндометритов и амнионитов;
— недоношенные дети и дети с недостаточным весом при рождении;
— колонизация влагалища матери стрептококком агалактия составляет 10^6 и выше КОЕ в 1 мл секрета;
— во время родов у матери высокая температура;
— ребёнку после рождения требуется реанимация.
В патологии новорождененых:
а) с ранними проявлениями:
— у 30% детей наблюдают сепсис;
— у 35% — пневмонии;
— у остальных 35% — менингиты, развивающиеся у 50% в течение 24 часов, при этом смертность составляет 35%;
б) с поздними проявлениями наблюдают менингиты и сепсис, при этом 10 – 20% погибают, а у 50% выживших детей наблюдаются остаточные явления.
Как предупредить неблагоприятные последствия носительства стрептококка агалактия.
Традиционная медицина предлагает следующие варианты решения данной проблемы:
1) обследоваться обоим партнёрам уже на этапе планирования зачатия ребёнка, так как, помимо колонизации влагалища у женщин, есть бессимптомное носительство этого стептококка в носоглотке и перианальной области (секрет влагалища,слизь с носоглотки и мазок с перианальной области направляется на исследование в бактериологическую лабораторию, серотипирование стрептококков группы В проводят в латекс агглютинации, коагглютинации или ИФА; если возбудитель обнаруживается у одного или сразу у двух партнёров в количестве, превышающим норму (10^4 КОЕ в 1 мл), то следует провести пенициллинотерапию в течение 10 дней, возможно также применение цефалоспоринов и макролидов;
2) при выявлении стрептококков агалактия у беременной в III триместре даже без клинической симптоматики необходима пенициллинотерапия в течение 10 дней, возможно применение цефалоспоринов и макролидов;
3) обследовать всех женщин на наличие стрептококка агалактия на 28-ой неделе беременности и лечить всех выявленных носителей антибиотиками, которые вводят внутривенно во время родовой деятельности;
4) лечить антибиотиками всех женщин, у которых начались преждевременные роды, остальных обследовать на 36 неделе беременности и лечить только выявленных бактерионосителей;
5) лечить всех женщин, у которых обнаруживается хотя бы один факторов риска, связанный с инфицированием стрептококком агалактия, не проводя никаких обследований.
Такой разброс рекомендаций связан со следующими обстоятельствами:
— колонизация влагалища женщины стрептококком агалактия происходит периодически в течение всех девяти месяцев беременности, иногда его там просто нет (?!);
— у 70% женщин, выделенный на 28-й недели беременности, стрептококк агалактия, при повторном обследовании во время родов не обнаруживается;
— положительный результат обследования в 34 недели беременности с большой вероятностью останется таковым во время родов;
— более позднее обследование даст наиболее точный результат, но при этом никто не гарантирует отсутствия у такой женщины факторов риска, например, беременная будет ждать обследования в 35 недель, а у неё начнутся преждевременные роды, когда риск проявления инфекции высок, а на наличие стрептококка агалактия она совсем не обследована.
В связи с выше изложенным, я как врач бактериолог, рекомендую:
1) на этапе планирования зачатия ребёнка, обоим партнёрам к бактериологическому исследованию мазков из носоглотки, перианальной области и секрета влагалища обязательно добавить анализ кала на дисбактериоз с определением чувствительности на случай выделения стрептококка агалактия к:
2) провести лечение выделенного стрептококка агалактия в местах его выделения, но обязательно в кишечнике, фагами с учётом чувствительности к ним этой бактерии; например, заливкой фага во влагалище, приёмом его внутрь через рот и клизмированием кишечника; после курса лечения его эффективность проверить контрольными анализами и при получении отрицательного результата или в случае выделения стрептококка агалактия в пределах нормы, провести закрепляющий результат лекарственным средством – виферон ( суппозитории ректальные, которые обладают в том числе выраженным иммуномодулирующим свойством);
3) при наступлении беременности такой курс лечения проводить профилактически каждый триместр, в его середине;
4) при первичном выявлении стрептококка агалактия из влагалища в период беременности, обязательно определить его чувствительность к фагам и пролечить ими влагалище и обязательно кишечник, можно даже без проведения анализа на дисбактериоз.
Напоминаю, что бактериофаги – это вирусы бактерий и для организма они безопасны, в то время как антибиотики помимо патогенных бактерий, уничтожают микроорганизмы нормальной микрофлоры кишечника, способствуя развитию грибов и плесени, угнетая иммунитет пролеченного ими пациента.
Конечно, такое решение надо принимать совместно с врачом, а при наличии показаний уже во время родов внутривенно ввести бета – лактамы (цефалоспорины 3-его поколения), в качестве альтернативы – уреидопенициллины с амикацином, последний препарат — только в случае жизненных показаний, как того требуют критерии выбора антибиотиков.
Что же касается других препаратов с антибактериальным и противогрибковым действием для местного применения в гинекологии, то в отношении стрептококка агалактия они не эффективны.
1) ПОЛИЖИНАКС ВИРГО — Streptococcus spp. (все группы стрептококков) и анаэробные бактерии, к содержащимся в нём антибиотикам, нечувствительны;
2) Нео-пенотран форте свечи вагинальные — входящий в их состав метронидазол активен в отношении анаэробного стрептококка, в то время как стрептококк агалактия — аэроб, т.е. его рост происходит только в присутствии кислорода воздуха; ссылка на его эффективность в отношении грамположительных бактерий, к которым тоже относится этот микроорганизм, сводится к формулировке относительной устойчивости, т. е. в составе выделенной культуры стрептококка агалактия есть штаммы, которые устойчивы к действию метронидазола;
3) Тержинан, вагинальный суппозиторий – антибиотик широкого спектра действия из группы аминогликозидов, который малоэффективен в отношении Streptococcus spp.
4) Джозамицин – антибиотик в таблетках из группы макролидов, который эффективен только в отношении Streptococcus pyogenes и Streptococcus pneumoniae.
Лечение новорождённых детей с указанной патологией должно проводиться бета-лактамами и макролидами, аминогликозиды назначаются в случае жизненных показаний. Лечение назначается при наличии клинических показаний с учётом вероятного микробного спектра в зависимости от локализации инфекционного процесса, согласно возрасту ребёнка. Одновременно проводится лабораторно-инструментальное обследование новорождённого.
Приведу пример из архива моих консультаций за сентябрь месяц текущего года.
Получив дополнительную информацию в форме ответов на ряд посталенных мной вопросов, я сделала следующие выводы.
1. При госпитализации в реанимационное отделение больницы, Вашего сына стали лечить по жизненным показаниям от инфекции, при которой возбудитель не установлен, что подтверждается назначением меронема. Активность этого препарата против многих известных возбудителей (грамотрицательных, грамположительных аэробов и анаэробов) позволяет назначать его при большинстве тяжёлых и даже жизнеугрожающих инфекций, к которым относятся и госпитальные инфекции.
2. Одновременно, при поступлении ребёнка пропунктировали и исходя из вероятного микробного спектра в зависимости от локализации инфекционного процесса поставили диагноз менингит, возбудителями которых у детей младше 1 месяца являются Streptococci B, D и Enterobacteriaceae, отсюда назначение антибиотика из группы оксазолидинонов – ЗИВОКС, в отношении к которому имеется чувствительность стрептококков группы В и Д, но есть устойчивость бактерий семейства Enterobacteriaceae.
3. Из спинномозговой жидкости выделили S. agalactiae.
4.Установив в бактериологической лаборатории антибиотикочувствительность этого микроорганизма, ребёнку назначали для лечения адаптированный антибиотик – цефепим, который относится к цефалоспоринам 4-го поколения, продолжительность применения этого препарата от 7 до 10 дней.
Мексидол – это ингибитор свободнорадикальных процессов, обладающий также антигипоксическим, стресспротекторным, ноотропным и противоэпилептическим действием. Длительность лечения – 2-6 недель.
С учётом вышеизложенного, я предлагаю:
1. провести альтернативный курс лечения уреидопенициллинами (необходимо, наконец, использовать антибиотики, к которым стрептококки по своей природе чувствительны, даже если бактериологи дают в анализе устойчивость этой выделенной культуры к ним, ибо чувствительность бактерий на чашке не всегда соответствует её чувствительности в организме ребёнка, или взрослого; бывали часто случаи, когда бактерии на чашках устойчивы ко всему необходимому набору антибиотиков, тогда врач звонил мне, узнавал зону умеренной устойчивости антибиотиков, выбирал из них два и проводил два последовательных курса лечения этими препаратами и получал хороший клинический результат, подтверждённый клиническими анализами материала от больного) с амикацином по жизненным показаниям;
2. выбранным антибиотиком из группы бета – лактамов в обязательном порядке пролечить мать одновременно с сыном, несмотря на то, что он не выделен при однократном обследовании из грудного молока или при наблюдении мамы из влагалища или носоглотки в период беременности.
S.agalactiae хотя и выделяется из влагалища 25 – 45% беременных женщин, но его основным резервуаром считают желудочно-кишечный тракт, а исследование кала на микрофлору не является обязательным анализом у беременных, если конечное не было у каждой из них кишечных проявлений. Ребёнку эта бактерия могла попасть только от матери, поскольку она практически не встречается во внешней среде отделений родильного дома (стрептококк агалактия чувствителен к обычным дезинфицирующим средсвам, погибает при обычном мытье рук с мылом и кипячении) и не могла передаться через руки персонала больницы (это горизонтальный путь передачи этого возбудителя).
Надеюсь, я не очень разочаровала Вашего лечащего врача своим ответом.
Выздоравливайте и больше не болейте.
Огневская Татьяна Робертовна.
Уважаемые, мамочки и папы, не стесняйтесь проявлять лечащим врачам свою осведомлённость в вопросах диагностики, лечения и профилактики инфекционных заболеваний. Вы всегда имеете право на правильное и своевременное обследование, и лечение себя, своих детей и близких!

Хронический бактериальный простатит остается актуальной проблемой для дерматовенерологов и урологов. Связано это с тем, что до настоящего времени нет стройных представлений, в полной мере характеризующих его этиологию и патогенез, что затрудняет назначение целенаправленной терапии [1,2,3].
Цель исследования
Анализ анамнестических, возрастных и других данных, полученных при различных методах обследования пациентов хроническим бактериальным простатитом (ХБП).
Материалы и методы
Выясняли анамнез, проводили пальпаторное исследование предстательной железы, ультразвуковое ее сканирование, изучали спермограмму, показатели половых гормонов (тестостерона, фолликулостимулирующего гормона, пролактина, лютеинстимулирующего гормона), микробиоценоз сока простаты (культуральный метод).
Математическую обработку полученных данных проводили с использованием стандартных пакетов прикладных программ Statistica 7,0 и SPSS 16.0 for Windows. Использовали непараметрический критерий Уилкоксона и критерий Манна-Уитни.
Результаты исследования и их обсуждение
Мужчины ХБП были в возрасте от 21 до 69 лет, наибольшую группу (67,5 %) составили пациенты возрастной группы свыше 50 лет, женатыми оказались 95,8 % лиц.
В анамнезе данные о перенесенных инфекциях, передаваемых половым путем (ИППП), сообщили 50,8 % мужчин. При этом в 20,0 % это была гонококковая инфекция, в 10,8 % - трихомонадная, в 20,0% - хламидийная.
У большинства пациентов (62,5%) продолжительность заболевания ХБП составляла от 3 до 5 лет.
Почти все обследуемые были неудовлетворенны своей половой функцией. Из копулятивных нарушений преобладали ускоренная эякуляция (56,0%) и снижение либидо (53,0 %), что, по-видимому, обусловлено не только характером основного заболевания, но и возрастным составом пациентов. Причем достаточно часто больные отмечали нарушение двух (42,0%) и реже - трех (8,3%) составляющих копулятивного цикла.
В таблице 1 отражены результаты пальпаторного исследования простаты.
Результаты пальпаторного исследования простаты
Наличие уплотненных очагов
Как следует из таблицы, при пальпации чаще всего определялись сглаженность бороздки (96,6%) и асимметрия (93,3%) простаты. Традиционные клинические анализы крови и мочи позволили выявить незначительные отклонения от нормальных показателей у 17±3% обследованных, среднее количество лейкоцитов в мазке из уретры составляло 8,46±0,39, в простатическом соке - 15,94±0,69, активная реакция среды - рН=6,83±0,04 и феномен кристаллизации - 2,1±0,07.
Включение в диагностический комплекс ультразвукового сканирования существенно обогатило представление о состоянии простаты в виду информативности и достоверности результатов.
При тщательном анализе всего пакета эхограмм 120 исследуемых пациентов установлено, что те или иные нарушения зарегистрированы в 114 (95,0%) случаев.
Нормальные показатели размеров предстательной железы составляют: 1- продольный 40-45 мм, 2- поперечный -25-35, 3 - передне-задний 35-40. В среднем, предстательная железа у обследованных по всем параметрам была существенно большего размера. Причем, ее продольная величина составляла 52,1±0,07 мм, поперечная - 45,4±0,06 мм и передне-задняя - 40,9±0,07 мм.
Для получения более полной и развернутой картины заболевания у наблюдаемого контингента (120 человек) нами проводились исследование спермы и половых гормонов (табл. 2, 3).
Из представленных в таблице 2 данных видно, что количество неподвижных сперматозоидов составляло 58,0%, что выше признанных нормальными показателей ( 2 до 10 7 колоний в 1 мл.
При сравнении полученных данных по микробиоценозу сока простаты с исследованиями других авторов оказалось, что стафилококки были высеяны у 55,2%, стрептококки - у 6,0% (в нашем исследовании - у 45,6% и у 4,4% соответственно) [4].
Как видим, по приведенным микроорганизмам показатели были близки (p>0,05).
Считают, что инфекция в предстательную железу проникает гематогенным путем, а бактерии локализуются в центральной ее зоне (краниальной), находящейся под влиянием эстрогенов [5].
Заключение
Анамнестические сведения и разносторонний анализ исследуемых показателей свидетельствует о том, что обследуемые хроническим бактериальным простатитом больные были в возрасте старше 50 лет, что указывает на высокую степень риска развития доброкачественной гиперплазии предстательной железы и, поэтому, предполагает тщательное исследование в этом направлении с использованием более полной системы оценок симптомов, включающих датскую шкалу DAN-PSS, клиническую-СPS с динамическим урофлоуметрическим исследованием и определением простатического специфического антигена. У преобладающего большинства наблюдаемых, несмотря на длительное лечение по месту жительства, были ярко выражены все основные признаки ХБП: боли спонтанного характера и при пальпаторном исследовании железы с иррадиацией разной локализации, нарушения мочеиспускания, половой функции и изменение концентрации гормонов, особенно тестостерона. Клинические признаки простатита были подтверждены ультразвуковым сканированием. Наряду с этим, зарегистрированы существенные нарушения микробиоценоза с широким спектром патогенной бактериальной флоры.
Полученные нами данные в дальнейшем были использованы с целью назначения этиопатогенетической терапии.
Рецензенты:
Среди 18 видов и 8 родственных групп бактерий, причисленных к важнейшим патогенам человека, особую роль играют стрептококки. По медицинской значимости они занимают второе место после стафилококков. Из числа стрептококков, патогенных для человека, с середины 80-х гг. ХХ столетия во многих странах мира наблюдается рост заболеваемости, обусловленной β-гемолитическими стрептококками группы А (БГСА, S.pyogenes).
β-гемолитический стрептококк группы А (пиогенный стрептококк, БГСА S.pyogenes) - грамположительный, неспорообразующий, неподвижный микроорганизм. Растёт на кровяном агаре, обладает выраженной гемолитической активностью, каталазанегативный, чувствителен к бацитрацину. Встречается повсеместно, часто колонизирует кожные покровы и слизистые оболочки человека. Главными путями передачи являются воздушно-капельный, контактный и пищевой. Патогенез заболеваний связан с продукцией токсинов: гемолизин, стрептолизин, стрептокиназы А и В, дезоксирибонуклеаза, гиалуронидаза. Основные нозоформы представлены поверхностными (ангины, фарингит, импетиго, рожа), инвазивными (некротизирующий фасциит, миозит, менингит, эндокардит, пневмония, послеродовой сепсис) и токсин-опосредованными инфекциями (скарлатина, синдром токсического шока). Со стрептококковой инфекцией связано также возникновение неврологических расстройств у детей, проявляющихся обсессивно-компульсивными расстройствами (PANDAS-синдром).
Streptococcus pyogenes сохраняет 100% чувствительность к β-лактамным антибиотикам (пенициллинам, цефалоспоринам, карбапенемам). Они остаются единственным классом антибиотиков, к которым у S.pyogenes не развилась резистентность. Актуальной проблемой является устойчивость к макролидам, которая в некоторых регионах мира превышает 30%. Многоцентровое исследование резистентности клинических штаммов S.pyogenes, проведённое в 2000-2001 гг., позволило изучить распространенность устойчивости, прежде всего к макролидам, в различных регионах России. Частота резистентности к эритромицину варьировала и достигала 11,4%, при этом не было обнаружено штаммов, устойчивых к телитромицину, представителю нового класса антибиотиков - кетолидов. Почти в 90% случаев резистентность к макролидам была обусловлена метилированием рибосом, в остальных случаях она была связана с активным выведением (эффлюксом) антибиотика из клетки.
Стрептококковый тонзиллофарингит
Стрептококковый тонзиллофарингит (ангина) - острое общее инфекционное заболевание с преимущественным поражением лимфоидного аппарата и слизистой оболочки глотки, вызванное БГСА. Под рецидивирующим стрептококковым тонзиллофарингитом следует понимать множественные эпизоды заболевания в течение нескольких месяцев с положительными результатами бактериологических и/или экспресс-методов диагностики БГСА, отрицательными результатами исследований между эпизодами заболевания, повышением титров противострептококковых антител после каждого случая болезни.
Этиология: среди бактериальных возбудителей острого тонзиллофарингита наибольшее значение имеет БГСА.
Эпидемиология. В США ежегодно диагностируется 1-1,4 млн. случаев тонзиллофарингита БГСА-этиологии. Передача осуществляется воздушно-капельным, контактным и пищевым путями. Источниками инфекции являются больные, реже - бессимптомные носители. Вероятность заражения увеличивается при высокой обсемененности и тесном контакте. БГСА может вызывать крупные вспышки тонзиллофарингита в организованных коллективах. Чаще болеют дети в возрасте 5-15 лет. Наибольшая заболеваемость - в зимне-весенний период.
Клиническая картина: Инкубационный период составляет от нескольких часов до 2-4 дней. Характерно острое начало с повышения температуры тела до 37,5-39°С, выражена общая интоксикация. Боль в горле бывает так сильно выражена, что у больного нарушается глотание. При осмотре выявляется покраснение нёбных дужек, язычка и задней стенки глотки. Миндалины гиперемированы, отёчны, часто с гнойным налётом желтовато-белого цвета. Налёт рыхлый, пористый, легко удаляется шпателем с поверхности миндалин без кровоточащего дефекта. У всех больных отмечается регионарный лимфаденит.
Кровь: лейкоцитоз, сдвиг лейкоцитарной формулы влево, увеличение СОЭ, появление С-реактивного белка.
Длительность периода разгара (без лечения) составляет 5-7 дней. В дальнейшем, при отсутствии осложнений, основные клинические проявления болезни быстро исчезают.
Осложнения. Особую опасность представляют осложнения стрептококкового тонзиллофарингита, которые делятся на:
- ранние (гнойные), развивающиеся на 4-6-й день от начала заболевания,- отит, синусит, мастоидит, паратонзиллярный абсцесс, шейный лимфаденит, менингит, бактериемия, эндокардит, пневмония;
- поздние (негнойные): постстрептококковый гломерулонефрит, токсический шок, развивающиеся в стадии реконвалесценции (на 8-10-й день от начала болезни) и острая ревматическая лихорадка, развивающаяся через 2-3 нед после купирования симптомов заболевания - опасные, часто приводящие к инвалидизации заболевания.
Диагностика. Чрезвычайно важно своевременно установить этиологию тонзиллофарингита, поскольку, за редким исключением, только ангина стрептококковой этиологии требует антибактериальной терапии. Диагностика включает микробиологическое исследование мазка с поверхности миндалин и/или задней стенки глотки. За рубежом широкое распространение получили методы экспресс-диагностики, основанные на прямом выявлении стрептококкового антигена в мазках с поверхности миндалин и/или задней стенки глотки. Современные тестовые системы позволяют получать результат через 15-20 мин с высокой специфичностью (95-100%), но меньшей, чем при культуральном исследовании, чувствительностью (60-95%), в связи с чем отрицательный результат экспресс-теста всегда должен подтверждаться культуральным исследованием.
Целью антибиотикотерапии острых стрептококковых ангин является эрадикация БГСА, что ведёт не только к ликвидации симптомов инфекции, но и предупреждает ранние и поздние осложнения, а также предотвращает распространение инфекции.
Выбор антибиотиков. Препаратами I ряда для лечения острого стрептококкового тонзиллита являются пенициллин (феноксиметилпенициллин), аминопенициллины и оральные цефалоспорины. У пациентов с доказанной аллергией на β-лактамные антибиотики следует применять макролиды, а при непереносимости последних - линкозамиды.
Носительство БГСА. В среднем около 20% детей школьного возраста являются носителями БГСА в весенне-зимнее время. Учитывая низкий риск развития гнойных и негнойных осложнений, а также незначительную роль в распространении БГСА, хронические носители, как правило, не нуждаются в антибактериальной терапии.
Острая ревматическая лихорадка
Острая ревматическая лихорадка (ОРЛ) может возникать как после тонзиллофарингита с типичной клинической картиной, так и после перенесённой бессимптомной или малосимптомной инфекции. ОРЛ возникает только после инфекций глотки, и никогда после инфекций кожи и мягких тканей. Предположительное объяснение этого феномена состоит в различии иммунного ответа на кожную и глоточную инфекцию и в отсутствии ревматогенного потенциала у штаммов, вызывающих кожные инфекции. Риск развития ОРЛ после нелеченного тонзиллофарингита составляет 1%. К ревматогенным М-серотипам стрептококка относятся 1, 3, 5, 6, 18, 19, 24.
В настоящее время в развитых странах острая ревматическая лихорадка встречается с частотой 0,5 на 100000 детей школьного возраста. В развивающихся странах заболеваемость составляет от 100 до 200 на 100000 детей школьного возраста, ежегодно регистрируется от 10 до 15 млн. новых случаев ОРЛ, которая является основной причиной смерти от сердечно-сосудистой патологии.
Следует отметить, что немотивированная задержка восстановления трудоспособности, слабость, нестойкий субфебрилитет, артралгии, сердцебиение и нерезко повышенная СОЭ, сохраняющиеся после перенесенной ангины, в сочетании с ростом титров противострептококковых антител (антистрептолизин О, антистрептокиназа, антистрептогиалуронидаза, анти-ДНКаза В) могут свидетельствовать о дебюте острой ревматической лихорадки.
В соответствии с рекомендациями ВОЗ для диагностики острой ревматической лихорадки в качестве международных применяются критерии Джонса, пересмотренные Американской кардиологической ассоциацией в 1992 г. (см. табл.). Наличие двух больших критериев или одного большого и двух малых в сочетании с данными, документированно подтверждающими предшествующую БГСА-инфекцию, свидетельствует о высокой вероятности ОРЛ. Однако ни один диагностический критерий не является строго специфичным для ОРЛ, поэтому трудности в раннем распознавании заболевания и дифференциальной диагностике с другими нозологиями сохраняются по-прежнему.
Критерии Джонса, применяемые для диагностики первой атаки ревматической лихорадки (по состоянию на 1992 г.)
Читайте также:


