Анализ кала на иерсиниоз инвитро
Комплексное исследование для выявления возбудителя иерсиниоза (Yersinia enterocolitica) и псевдотуберкулеза (Yersinia pseudotuberculosis), включающее серологические тесты и полимеразную цепную реакцию (ПЦР).
Анализы на иерсиниоз и псевдотуберкулез.
Laboratory Diagnostics of Yersiniosis, Enteropathogenic Yersiniae Lab Panel.
Какой биоматериал можно использовать для исследования?
Венозную кровь, кал.
Как правильно подготовиться к исследованию?
- Исследование рекомендуется проводить до начала приема антибиотиков и других антибактериальных химиотерапевтических препаратов.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Иерсинии - это грамотрицательные, факультативно-анаэробные палочки, относящиеся к семейству Enterobacteriaceae. Известно 11 видов иерсиний, три из которых являются возбудителями заболеваний человека: Yersinia pestis – это возбудитель чумы, Yersinia enterocolitica (Y. enterocolitica) и Yersinia pseudotuberculosis (Y. pseudotuberculosis) – кишечные патогены. Хотя Y. enterocolitica и Y. pseudotuberculosis относятся к разным видам, они имеют много общего, особенно в плане клинической картины и диагностики.
Основной "резервуар" иерсиний - дикие и домашние животные (свиньи, грызуны, овцы, козы, коровы, собаки, кошки и птицы). Считается, что человек не участвует в естественном жизненном цикле этих патогенов ни в качестве промежуточного, ни окончательного хозяина и его заражение, таким образом, носит случайный характер. Как правило, заражение кишечными иерсиниями происходит фекально-оральным путем при употреблении контаминированных продуктов питания (молочные продукты, сырое или плохо приготовленное мясо, особенно свинина). Как Y. enterocolitica, так и Y. pseudotuberculosis сохраняют жизнеспособность в условиях пониженных температур. Случаи передачи инфекции от человека к человеку или при переливании инфицированной крови описаны, но очень редки.
Следует отметить, что не все кишечные иерсинии являются патогенами. Так, к развитию заболевания у человека приводят серотипы Y. enterocolitica O:3, O:8, O:9 и O:5,27 и Y. pseudotuberculosis O:1 и O:2. Только указанные серотипы являются истинно энетропатогенными иерсиниями.
Особенностью энтеропатогенных иерсиний является их тропность к лимфатичекой ткани. Проникая через слизистую оболочку кишечника, эти микроорганизмы попадают в мезентериальные лимфатические узлы. Развивающийся воспалительный ответ сопровождается болью в области живота и диареей, а также мезентериальным лимфаденитом. У иммунокомпетентных лиц заражение энтеропатогенными иерсиниями чаще ограничивается гастроэнтеритом и регионарным лимфаденитом. Если возбудителем заболевания является Y. enterocolitica, говорят об иерсиниозе, если Y. pseudotuberculosis – о псевдотуберкулезе. Иерсиниоз встречается чаще, чем псевдотуберкулез. Как при иерсиниозе, так и при псевдотуберкулезе могут наблюдаться иммунопатологические феномены в виде реактивного артрита и узловатой эритемы. У лиц с иммунодефицитом, а также маленьких детей могут наблюдаться тяжелые формы иерсиниоза и псевдотуберкулеза с диссеминацией бактерий и сепсисом.
Диагностика иерсиниоза и псевдотуберкулеза достаточно сложна. Хотя бактериологический посев кала (крови или других биологических материалов) считается "золотым стандартом" диагностики, он трудноосуществим. Это связано с тем, что энтеропатогенные иерсинии сложно отличить от других кишечных микроорганизмов, которые в норме преобладают в кишечной флоре. После выявлении роста иерсиний проводят дополнительные биохимические тесты, устанавливающие их энтеропатогенность. Кроме того, метод бактериологического посева характеризуется достаточно низкой чувствительностью (для получения результата необходимо 10 3 -10 6 КОЕ в грамме образца биоматериала). Учитывая эти особенности, диагностика иерсиниоза и псевдотуберкулеза носит комплексный характер и включает следующие дополнительные тесты:
- Полимеразная цепная реакция (ПЦР) – один из методов молекулярной диагностики, в ходе которого определяется генетический материал (ДНК) микроорганизма в образце биоматериала (в кале). Основными преимуществами ПЦР являются быстрота получения результата, высокая чувствительность и специфичность. В данное комплексное исследование входит анализ ПЦР на Y. pseudotuberculosis.
- Серологические тесты. Антитела к энтеропатогенным иерсиниям обычно могут быть определены в первые 2-4 недели болезни (IgM-антитела). Следует отметить, что из-за определенного антигенного сходства Yersinia с бактериями других родов (Salmonella, Morganella, Brucella) серологические тесты могут давать ложноположительные результаты. Еще одним недостатком серологических тестов является то, что антитела к иерсиниям (IgG-антитела) сохраняются в течение нескольких лет после инфицирования, что может препятствовать интерпретации результата. Следует помнить, что результат серологических тестов зависит от иммунного статуса организма.
Точность ПЦР и серологических тестов в меньшей степени, чем бактериологического метода, подвержена влиянию антибактериальных препаратов. Однако максимально точный результат теста будет получен при анализе биоматериала, полученного до начала лечения.
Гастроэнтерит, возникающий при инфицировании энтеропатогенными иерсиниями, сложно отличить от сальмонеллеза, кампилобактериоза и других кишечных инфекций. По этой причине часто требуются дополнительные лабораторные анализы.
Для чего используется исследование?
- Для диагностики иерсиниоза и псевдотуберкулеза.
Когда назначается исследование?
- При подозрении на иерсиниоз или псевдотуберкулез: лихорадка, тошнота, боли в животе (боль может локализоваться в правой паховой области), диарея, а также узловатая эритема или реактивный артрит;
- в некоторых случаях при подозрении на острый аппендицит.
Что означают результаты?
Для каждого показателя, входящего в состав комплекса:

Диагностика иерсиниоза и псевдотуберкулеза методом РПГА

Анализ выявляет наличие антител к патогену кишечного иерсинеоза и псевдотуберкулеза и является маркером острой или перенесенной ранее инфекции.
Методика РПГА (реакция пассивной гемагглютинации) проводится следующим образом - на лабораторный планшет вносят тестируемые образцы - исследуемая сыворотка в первой пробе разводится в 10 раз, последующие образцы разводят с двукратным отличием (1:10, 1:20 и так далее). К каждой пробе добавляют иерсиниозный диагностикум (стандартные эритроциты, связанные с антигенами возбудителей инфекции). При наличии в пробах антител происходит их соединение с патогеном, которое проявляется осаждением гемагглютининов. То же самое проделывают и с псевдотуберкулезным диагностикумом. Позитивная реакция оценивается по разведению пробы, в которой произошла агглютинация.
| Сроки выполнения | до 7-10 дней |
| Синонимы (rus) | Реакция пассивной агглютинации с грамотрицательными палочками иерсиниями |
| Cинонимы (eng) | Indirect hemagglutination test from Yersinia pseudotuberculosis, Yersinia enterocoliticа |
| Методы исследования | Полуколичественная реакция непрямой гемагглютинации |
| Подготовка к проведению анализа | Анализ проводится утром, натощак. С последнего приема пищи должно пройти не менее 8 часов. |
| Исключить прием алкоголя не менее чем за 24 часа до взятия биоматериала. | |
| Не рекомендуется сдавать кровь на серологию после флюорографии, рентгена, физиотерапевтических процедур. | |
| Биоматериал и способы его взятия | Кровь, взятие производят в лечебном учреждении из вены. |

Бациллы представляют опасность для человека и животных, они обладают высокой устойчивостью к окружающим условиям, накапливаются и размножаются в почве, воде. В человеческий организм бактерии проникают при уходе за инфицированным животным и употреблении сырой воды, немытых овощей и фруктов, плохо приготовленной рыбы и мяса, некипяченого молока.
Клинические проявления кишечного иерсиниоза и псевдотуберкулеза очень похожи:
- диарея;
- лихорадка;
- спастические боли в животе;
- рвота;
- увеличение лимфоузлов;
- катаральные симптомы.
Отличительным признаком псевдотуберкулеза является появление скарлатиноподобных высыпаний в естественных складках (на шее, в подмышках, паху, вдоль торса), отек стоп ног и кистей рук. Именно поэтому заболевание могут называть скарлатиноподобной лихорадкой. Сходство клинико-этиологических характеристик, механизма зарождения и развития болезни позволяет рассматривать кишечный иерсиниоз и псевдотуберкулез как близкие друг другу кишечные инфекции, различить возбудителей инфекционного процесса можно лишь при помощи лабораторных анализов.
Отрицательный результат свидетельствует об отсутствии заражения иерсиниями.
Условно-диагностическим титром считают итог 1:160 и выше - положительный результат, подтверждающий текущее заболевание.
Рекомендуют двукратное проведение анализа - при появлении первых клинических признаков и через неделю. Окончательный диагноз инфекционного процесса устанавливает квалифицированный специалист.
CMD является одним из лидеров рынка лабораторных услуг и молекулярных технологий России и ближнего зарубежья, главным образом, выполняемых на основе современных молекулярно-генетических методов, таких как ПЦР в режиме реального времени, NASBA, секвенирования, пиросеквенирования, гибридизационных методов.
Мы сами разрабатываем, производим и внедряем в практическое здравоохранение свои диагностические тесты (исследования) для выявления инфекционных, наследственных и генетически обусловленных заболеваний человека, многие из которых являются уникальными и выполняются только в CMD Центрального НИИ Эпидемиологии. Основные наши ПЦР-тесты имеют СЕ-марку в соответствии с Директивой 98/79/ЕС на производство препаратов для in vitro диагностики.
Преимущество и уникальность лаборатории CMD обусловлены научным потенциалом Центрального НИИ Эпидемиологии, который подтверждается квалификацией сотрудников активно взаимодействующих с Всемирной Организацией Здравоохранения (ВОЗ), Международными центрами по контролю за инфекционными заболеваниями, зарубежными клиниками, институтами и университетами; принимающих участие в российских и зарубежных научно-практических мероприятиях; публикующих свои работы в ведущих мировых изданиях.
Более 700 профессионалов, среди которых доценты и профессора, кандидаты и доктора медицинских наук, вносят свой вклад в улучшение качества и расширение спектра предоставляемых услуг, проводят обучение и оказывают методическую, информационную и консультационную поддержку врачам клинических специальностей, специалистам службы санитарно-эпидемиологического надзора, сотрудникам других клинико-диагностических лабораторий. Собственная научная база позволяет CMD быстро внедрять передовые мировые достижения и собственные уникальные разработки в лабораторную медицину.
С 2008 года на базе Центрального НИИ Эпидемиологии функционируют 8 Всероссийских референс-центра по мониторингу за возбудителями инфекционных и паразитарных заболеваний. Часть функций референс-центров напрямую связана с контролем и обеспечением качества проводимых исследований молекулярными методами по всей территории Российской Федерации.
Мы одни из первых, кто в случае возникновения вспышек различных опасных инфекционных заболеваний приходит на помощь и в кратчайшие сроки может предложить их диагностику населению с помощью ПЦР-тестов, разработанных в нашем институте и валидированных на международном уровне. Так, например, мы принимали активное участие в расшифровке вспышки атипичной пневмонии (SARS) (2003 г.), птичьего гриппа (2008 г.), свиного гриппа (2009 г.), лихорадки Эбола (2014 г.) и др.
Наши специалисты активно участвуют в разработке методических рекомендаций, регламентирующих работу молекулярно-биологических лабораторий, а также нормативных и методических документов по эпидемиологии, диагностике, профилактике, лечению инфекционных болезней. Также мы осуществляем методическое руководство и контроль качества молекулярно-диагностической деятельности лабораторий России; оказываем консультативную и практическую помощь лабораториям молекулярной диагностики медицинских учреждений, проводящих текущую и экстренную работу по предотвращению и расшифровке вспышек инфекционных заболеваний.
Наши лаборатории оснащены современным оборудованием ведущих мировых и отечественных производителей: Abbot, Roche, Bio Rad, Beckman Coulter и др. В своей работе мы используем новейшие лабораторные, информационные, медицинские и логистические технологии.
В своей деятельности мы руководствуемся принципом постоянного повышения качества предоставляемых услуг и максимального удовлетворения потребителей через многоуровневую интегрированную систему менеджмента качества (СМК). С ее помощью определяются как общие организационные и функциональные принципы работы всех подразделений, так и роль каждого сотрудника. В лабораториях CMD проводится постоянный контроль качества на основании положений и документов СМК, разработанных в соответствии с рекомендациями Международной организации стандартизации (ISO), Всемирной организации здравоохранения (ВОЗ), международных научных сообществ по клинической химии и гематологии и российскими нормативными документами (приказы МЗ РФ, Государственные стандарты в области лабораторной медицины).
С 2014 года CMD является первой российской медицинской лабораторией, участвующей и подтвердившей высокий уровень качества своих лабораторных исследований в Международной системе внешней оценки качества пре- и постаналитических этапов лабораторных исследований KIMMS (Key Incident Monitoring and Management Systems).
Лабораторная диагностика в CMD – это сочетание больших диагностических возможностей, точности, надежности, эффективности и скорости получения результатов с удобными современными сервисами, доступными ценами и всесторонней поддержкой в проведении диагностического обследования.
Роль генома микрофлоры при воспалительных заболеваниях кишечника

Целью данного исследования была оценка изменений качественного и количественного состава кишечной флоры у больных воспалительными заболеваниями кишечника (ВЗК), анализ генетической предрасположенности к нарушению иммунного ответа при дисбиотических процессах в толстом кишечнике у пациентов с неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК). У большинства обследованных больных ВЗК имелась генетическая предрасположенность к нарушению микробиоценоза кишечника. При этом сочетание полиморфизма TLR-3 с изменениями микрофлоры кишечника свидетельствует о преобладании избыточного иммунного ответа на антигены облигатных и факультативных бактерий у больных НЯК. В то же время у пациентов с БК преобладание полиморфизма TLR-4 в сочетании с наличием условно-патогенной микрофлоры в кишечнике может отражать снижение реактивности к кишечным патогенам.
воспалительные заболевания кишечника, микрофлора кишечника.
Воспалительные заболевания кишечника (ВЗК) представляют серьезную медицинскую и социальноэкономическую проблему [1, 2]. Генетические мутации, увеличивающееся влияние неблагоприятных внешних факторов приводят не только к росту частоты ВЗК, но и к учащению внекишечных поражений и осложнений заболевания [1, 3]. Характер заболеваний (мультифакторный), особенности влияния предрасполагающих и провоцирующих факторов, ведущий патогенетический механизм при различных формах ВЗК существенно различаются. В то же время существует некоторая общность клинических симптомов и этиопатогенетических факторов, существенно затрудняющих дифференциальную диагностику между неспецифическим язвенным колитом (НЯК) и болезнью Крона (БК), что пролонгирует назначение своевременной адекватной терапии данных заболеваний. Рост заболеваемости ВЗК в экономически развитых странах исследователи связывают с увеличением экологической нагрузки, нарушением характера и режима питания, употреблением рафинированных продуктов, высоким уровнем стресса у жителей мегаполисов. Низкая заболеваемость ВЗК отмечается в странах Азии, Японии, Южной Америки. В Российской Федерации по данным 1997 г. заболеваемость НЯК составляла 20,6, а болезнью Крона — 3,4 на 100 000 жителей. По результатам П.Н. Олейникова (1996), частота НЯК в СНГ составляла 0,7–1,0 на 1000 населения. При этом соотношение числа случаев НЯК и БК составляло 1: 10–1: 5. В Украине показатели распространенности ВЗК различны в зависимости от региона. Так, в экологически неблагоприятных промышленных областях частота встречаемости НЯК и БК выше, чем в сельскохозяйственных регионах [5, 6]. Пик роста заболеваемости НЯК в Восточной Украине приходится на вторую половину 90х годов прошлого века, а в настоящее время отмечаются предпосылки к началу роста БК. Частота возникновения (первичная заболеваемость) болезни Крона составляет 2–4 случая на 100 000 жителей, и в последние годы этот показатель возрастает. Встречаемость болезни Крона составляет 30–50 случаев на 100 000 населения и также имеет тенденцию к росту. Значительное число диагностических ошибок, не всегда эффективная терапия приводят к увеличению длительности нетрудоспособности, инвалидизации, а иногда и смерти таких больных, что обусловливает особую актуальность, необходимость глубокого изучения данной патологии [1, 2, 4].
НЯК и БК являются полиэтиологическими заболеваниями, в возникновении которых значительную роль играет наследственная предрасположенность, реализующаяся под воздействием стрессов, пищевых погрешностей и кишечных инфекций посредством иммунологических нарушений. Микрофлора толстой кишки является одним из факторов, определяющих нормальное функционирование слизистого барьера кишечника [1, 2]. Интоксикация продуктами жизнедеятельности бактерий толстого кишечника способна угнетать метаболическую и секреторную активность клеток кишечного эпителия, снижая резистентность слизистых барьеров, а вирусы могут изменять метаболизм колоноцитов, оказывать влияние на местный иммунный ответ [3, 4]. Кишечная палочка и бифидобактерии выполняют витаминообразующую функцию, способствуют синтезу незаменимых аминокислот, принимающих непосредственное участие в процессах регенерации слизистой кишечника [2, 5]. При изменениях микробиоценоза кишечника эти функции микрофлоры нарушаются. Кроме того, при нарушениях баланса анаэробноаэробной флоры изменяется энергообеспечение колоноцитов [5, 6]. При этом нарушается секреторная функция бокаловидных клеток, снижается синтез муцинов, изменяются их состав и свойства, нарушаются соотношения сульфатированных и несульфатированных гликозаминогликанов, что приводит к нарушению защитных свойств слизи и поддерживает дисбактериоз. Нарушается и белковая структура муцинов, что снижает регенераторные возможности слизистой. Следовательно, нарушения микробиоценоза толстого кишечника у больных ВЗК вызваны изменением трофики колоноцитов, нарушением секреторной функции бокаловидных клеток, процессов пролиферации, дифференцировки и регенерации клеток кишечного эпителия.
Дисбиотические процессы в толстом кишечнике непосредственно влияют на изменения мукозного слоя слизистой оболочки толстого кишечника [1, 5]. Облигатная микрофлора кишечника способствует синтезу муцинов. Муцины, в свою очередь, являются трофическим, энергетическим сырьем для жизнедеятельности бактерий, формирования колонизационной резистентности. Вследствие нарушения хотя бы одного из компонентов слизистого барьера кишечника возникает феномен повышенной кишечной проницаемости, и кишечник становится источником поступления в организм большого количества антигенов, токсических соединений, которые способствуют поддержанию воспаления. Воспалительный процесс в кишечнике, вызванный патогенной флорой, ксенобиотиками или аллергенами, стимулирует клетки иммунной системы и поддерживает системный воспалительный процесс. Подтверждением важной роли слизистого барьера кишечника является уменьшение активности заболевания у больных ВЗК после восстановления микробиоценоза кишечника и уменьшения кишечной проницаемости [4, 6].
Характер изменения слизистого барьера кишечника отличается при различных типах ВЗК. При болезни Крона наблюдается нарушение микробиоценоза толстого кишечника за счет микобактерий, псевдомонад, иерсиний, патогенных штаммов эшерихий [1, 4, 6]. В то же время для больных НЯК характерен дисбактериоз со снижением количества бифидобактерий и лактобацилл, облигатной флоры и увеличением факультативных бактерий [2, 4, 5]. При НЯК определяется дефицит защитного слоя муцинов, а при БК отмечается избыток слизеобразования в кишечнике [4]. Одной из причин, определяющих различия в патогенезе изменений свойств кишечного барьера при НЯК и БК, может быть генетическая предрасположенность к восприятию антигенной нагрузки в кишечнике.
Определена локализация генов, ответственных за развитие ВЗК. Наиболее значимые находятся на 16, 22, 10, 2 и 19й хромосомах. Генетическую предрасположенность к ВЗК связывают с полиморфизмом генов NOD2/CARD15, DLG5, TNF, TLR4, IL1, IL10. В нескольких исследованиях было установлено, что домен CARD15, расположенный на 16й хромосоме и кодирующий белок NOD2, приводит к модификации иммунного ответа, изменяет проницаемость слизистого барьера кишечника и достаточно часто выявляется у пациентов с ВЗК, обусловливая тяжелое течение заболевания [10, 12]. Полиморфизм DLG5 также способствует развитию ВЗК, преимущественно БК. В последнее время особое внимание уделяется генам, кодирующим синтез фактора некроза опухолей (TNF) и антагониста рецепторов интерлейкина1 (IL1). Выявлен выраженный полиморфизм гена, находящегося на второй хромосоме и определяющего уровень антагониста рецепторов к IL1 в слизистой оболочке толстой кишки у больных НЯК, который стимулирует активность Т и Влимфоцитов и индуцирует иммунный ответ. В то же время полиморфизм группы генов, определяющих уровень TNF, более характерен для пациентов с болезнью Крона [16].
В настоящее время особое внимание уделяется системе tollподобных рецепторов (TLRs 113), отвечающих за распознавание компонентов клеточной стенки бактерий, активацию каскада провоспалительных цитокинов и интерлейкинов, формирование колонизационной резистентности и бактериальную транслокацию [7–9]. TLR в большом количестве представлены на поверхности кишечного эпителия, а также обнаружены на моноцитах, макрофагах, в системной циркуляции и периферических органах и тканях, что свидетельствует о важной роли tоllподобных рецепторов в регуляции как местного, так и системного иммунного ответа [7, 9]. Тоllподобные рецепторы активируются различными бактериальными или вирусными клеточными компонентами. Рецепторы распознают микробные структуры, так называемый патогенассоциированный микробный паттерн, и являются ключевым звеном в регуляции противомикробной протекции кишечника. Связывание рецепторов с бактериальным или вирусным антигеном приводит к активации факторов ядерной транскрипции (NF B, JAK2), изменению экспрессии провоспалительных цитокинов и индукции воспалительного ответа [7–10]. Повышенная экспрессия TLRs способствует активации цитокинов и интерлейкинов, избыточной продукции TNF, IL1, IL6, IL8 [10, 11]. Точечная мутация в экзоне гена TLR4 (хромосома 9q32–33) приводит к замене аспарагиновой кислоты на глициновую, потере отрицательного заряда в позиции 299 (Asp299Gly), что нарушает распознавание липополисахаридов бактерий как in vitro, так и in vivo, и развитию грамотрицательного сепсиса у животных, снижению ответа на бактериальный эндотоксин в эксперименте у человека [7, 12]. TLR4 экспрессируется не только в кишечнике, но и на кардиомиоцитах, в головном мозге, лейкоцитах периферической крови [1, 7]. Изменение его экспресии может быть обусловлено как внешними факторами, так и генетической предрасположенностью, что может влиять на характер иммунного ответа у пациентов с ВЗК [12–14]. В то же время TLR3 экспрессируется только на дендритных клетках [8, 13, 14, 16], следовательно, может являться первичным звеном, контактирующим с антигеном, распознающим и презентирующим компонентом иммунной системы кишечника. В эксперименте клетки TLR3дефицитных мышей характеризовались сниженной продукцией TNF, IL6, IL12 и нормальным ответом на бактериальные полисахариды [11, 15, 17]. Возможно, различные нарушения экспрессии TLRs в кишечнике вследствие генетической предрасположенности способствуют формированию различных типов ответа на вирусные и бактериальные антигены, изменению качественного и количественного состава кишечной микрофлоры. Поэтому изучение ассоциаций нарушений микрофлоры кишечника в сочетании с анализом мутаций TLRs у пациентов с ВЗК представляется актуальным.
Целью данного исследования была оценка изменений качественного и количественного состава кишечной флоры у больных ВЗК, анализ генетической предрасположенности к нарушению иммунного ответа при дисбиотических процессах в толстом кишечнике у пациентов с НЯК и БК.
Материалы и методы
Анализ полиморфных ДНКлокусов осуществляли методом полимеразной цепной реакции синтеза ДНК с последующей электрофоретической детекцией. Реакция проводилась при следующих условиях: первичная денатурация при 93 °С в течение 1 мин, после которой следовали 35 циклов, состоящих из денатурации при 93 °С в течение 10 с, отжига праймеров при 64 °С в течение 10 с, элонгации при 72 °С в течение 20 с. ПЦР проводили на амплификаторе Gene Amp ® PCR System 2400 (Applied Biosystems). Анализ амплифицированных фрагментов производили путем электрофореза в 3% агарозном геле, окрашенном в бромистом этидии. Визуализацию результатов проводили в ультрафиолетовом трансиллюминаторе TFX20.M (Vilber Lourmat, Франция).
Для оценки изменений кишечного микробиоценоза проводили изучение облигатной и факультативной кишечной флоры, ее количественного и качественного состава. Забор кала проводился утром в стерильную посуду и в течение 1 часа доставлялся в микробиологическую лабораторию. Определяли количество бифидобактерий и лактобацилл, кишечной палочки; изучали количественный и качественный состав факультативной флоры с исследованием количества стафило, стрепто и энтерококков, клебсиелл, протея, энтеробактера, цитобактера, грибов рода Candida. Помимо определения количества микроорганизмов, изучали их ферментативные свойства.
Результаты и обсуждение
Полиморфизм TLR3, TLR4 наблюдался более чем у половины обследованных больных ВЗК — 60 (65,2 %) пациентов. Мутация TLR3 (Phe412Leu) встречалась чаще, чем TLR4, и отмечалась у 37 (41,1 %) больных ВЗК. Преобладающее количество мутаций были гетерозиготными. Полные мутации (Leu/Leu) были отмечены только у 6 (16,2 %) обследованных пациентов с ВЗК. Частота встречаемости точечной мутации TLR3 отличалась в зависимости от типа ВЗК. Гетерозиготные мутации (Phe/Leu) преобладали среди больных НЯК — 24 (64,9 %). Неполные мутации встречались с меньшей частотой при БК — 13 (35,1 %) пациентов. Гомозиготные мутации TLR3 (Leu/Leu) также преобладали среди пациентов с НЯК — 4 (10,8 %), по сравнению с больными БК — 2 (5,4 %) пациента, однако данные отличия не были достоверными. Таким образом, полиморфизм TLR3 чаще наблюдался у больных НЯК, что может свидетельствовать о преобладании избыточного ответа на бактериальные полисахариды как облигатной, так и факультативной микрофлоры кишечника, запускающего каскад провоспалительных цитокинов (TNF, IL6, IL12), играющих ключевую роль в формировании ВЗК.
Мутация TLR4 (Asp299Gly) у обследованных больных наблюдалась несколько реже, чем TLR3, и встречалась только у 23 (25,0 %) пациентов с ВЗК. У всех больных отмечались только гетерозиготные мутации TLR4 (Asp/Gly). Полиморфизм TLR4 превалировал у больных БК — 15 (65,2 %) случаев, в отличие от больных НЯК, среди которых данная мутация наблюдалась лишь у 8 (34,8 %) пациентов. Следовательно, снижение или отсутствие способности к адекватному распознаванию бактериальных липополисахаридов вследствие мутации TLR4 более характерно для больных БК. Это приводит к снижению ответа на бактериальный эндотоксин грамотрицательной флоры, индукции и хронизации воспалительного процесса в кишечнике. Возможно, это объясняет тот факт, что нарушение микробиоценоза толстого кишечника за счет патогенной микрофлоры, кишечные инфекции предшествуют развитию, а также провоцируют обострения у пациентов с болезнью Крона чаще, чем у больных НЯК.
Генетическая предрасположенность с сочетанной мутацией TLR3 и TLR4 наблюдалась только у 9 (9,8 %) больных ВЗК. При этом сочетанные мутации встречались с равной частотой у больных как НЯК, так и БК, что, возможно, связано с небольшим количеством наблюдений.
У всех 92 больных ВЗК были выявлены изменения количества и состава кишечной микрофлоры (табл. 1).
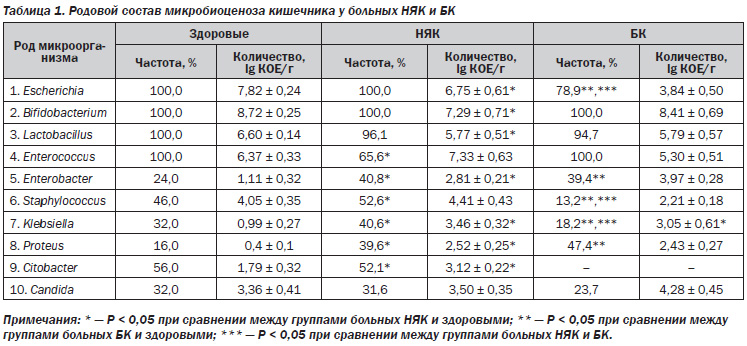
При этом как у больных НЯК, так и БК патогенные микроорганизмы не определялись, а облигатная флора (бифидобактерии, лактобациллы и кишечная палочка) высевались почти у всех пациентов, однако их количество было значительно снижено. У пациентов с БК частота высеваемости E.coli была ниже — 30 (78,9%) случаев, чем у здоровых лиц, причем как ее общего количества, так и кишечной палочки со слабовыраженными ферментативными свойствами за счет увеличения удельного веса гемолизирующей E.coli (до 50 %). У больных НЯК отмечалось только снижение количества кишечной палочки (6,75 ± 0,61). Энтерококки были выделены лишь у 63 (65,6 %) пациентов с НЯК (P Список литературы
1. Григорьев А.В. Желудочнокишечный тракт как среда обитания бактерий. Раздел 1. Морфология желудочнокишечного бактериального биотопа. — Москва; Киев, 2004. — 95 с.
2. Дисбиоз кишечника: Руководство по диагностике и лечению / Под ред. Е.И. Ткаченко, А.Н. Суворова. — СПб.: Спецлит, 2007. — 238 с.
3. Дубинин А.В., Бабин В.Н., Раевский П.М. Трофические и регуляторные связи макроорганизма и микрофлоры // Клиническая медицина. — 1991. — № 7. — С. 2428.
5. Ардатская М.Д. Диагностическое значение короткоцепочечных жирных кислот при синдроме раздраженного кишечника // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 2000. — № 3. — С. 3641.
6. Ардатская М.Д. Дисбактериоз кишечника // Materia Medica. — 2003. — № 2–3. — С. 28.
7. Крючко Т.О. и др. Генетичний поліморфізм Tollподібного рецептора 4 у дітей з атопічною бронхіальною астмою // Клиническая иммунология. Аллергология. Инфектология. — 2011. — № 5. — С. 5254.
8. Толстопятова М.А., Буслаева Г.А., Козлов И.Г. Роль рецепторов врожденного иммунитета в развитии инфекционной патологии у новорожденных детей // Педиатрия. — 2009. — Т. 87, № 1. — С. 115120.
9. Moser M. Dendritic cell regulation of TH1/TH2 development / M. Moser, K.M. Murphy // Nat. Immunol. — 2000. — Vol. 1. — P. 199205.
10. Schwartz D. The Genetics of Innate Immunity / David A. Schwartz // CHEST. — 2002. — Vol. 121. — P. 6268.
11. The TollLike Receptor 4 Asp299Gly and Thr399Ile Polymorphisms Influence the Late Inflammatory Response in Human Endotoxemia / C. Marsik, B. Jilma, C. Joukhadar et al. // Clinical Chemistry. — 2005. — Vol. 51, № 11. — Р. 21782180.
12. Functional Consequences of Tolllike Receptor 4 Polymorphisms / B. Ferwerda, M.B. McCall, K. Verheijen, B.J. Kullberg // Mol. Med. — 2008. — Vol. 14, № 56. — Р. 346352.
14. Medzitov R. Tolllike receptors and innate immunity // Nature Rev. Immunol. — 2001. — 1. — 136144.
15. Harju K., Glumoff V., Hallman M. Ontogeny of TLR2, TLR4 in mice // J. Pediatr. Res. — 2001. — 49. — 8183.
16. Brikos C., O’Neill L.A. Signaling of tolllike receptors // Handb. Exp. Pharmacol. — 2008. — V. 183. — P. 2150.
17. Akira S., Takeda K. Tolllike receptors in innate immunity // Immunology. — 2005. — 17(1). — 114.
Читайте также:


