Алгоритм лабораторной диагностики столбняка
Бактериологическое исследование - исследуется материал, взятый из раны: гной, кусочки тканей, инородные тела, тампоны, закладываемые в рану при перевязке, перевязочный материал, содержащий выделения из раны, в случаях столбняка после родов или аборта берут на исследование выделения из влагалища и матки, при подозрении на столбняк у новорожденного исследованию подвергают выделения из пуповины, при исследовании трупа также берут материал из раны, если она имеется, из различных воспалительных очагов и старых рубцов.
В некоторых случаях столбняка происходит генерализация инфекции, возбудитель может быть обнаружен во внутренних органах. Поэтому берут на исследование от трупа кровь, кусочки печени и селезенки. Исследование материала производится с целью обнаружения в нем столбнячного токсина и возбудителя столбняка.
Обнаружение столбнячного токсина: исследуемый материал растирают в стерильной ступке, добавляют двойной объем физиологического раствора. Часть материала засевают в 2 флакона с жидкой питательной средой. Для постановки реакции нейтрализации на животных экстракт исследуемого материала вводят внутримышечно 2 мышам по 0,5 мл экстракта, а еще двум мышам те же дозы с противостолбнячной сывороткой. В зависимости от количества токсина симптомы столбняка у животных развиваются на первые или вторые сутки. У животных, получивших токсин с противостолбнячной сывороткой симптомы не появляются, что свидетельствует о наличии в исследуемом материале столбнячного токсина.
Одновременно с постановкой реакции нейтрализации производят посев растертого материала в 2 флакона или 2 пробирки с питательной средой (бульон Мартена, бульон Вейнберга) под слоем вазелинового масла. Перед посевом из среды удаляют кислород путем кипячения 15 мин, а затем охлаждают до 40-50 °С и в нее добавляют 0,5 % глюкозы. После культивирования при температуре 35 °С на 2-е, 4-е, 6-е и 10-е сутки микроскопируют мазки из посевов и исследуют культуральную жидкость на наличие столбнячного токсина. Для этого ставят реакцию нейтрализации с противостолбнячной сывороткой. При обнаружении в посеве столбнячного токсина и наличии грамположительных палочек с крупными спорами дают положительный ответ.
Возбудитель дизентерии свиней, морфология, систематика, патогенез, лабораторная диагностика
Дизентерия свиней (Dysenteria suum) – инфекционная болезнь, характеризующаяся дифтерически-геморрагическим поносом и некротическим поражением толстого отдела кишечника. Восприимчивы свиньи всех пород и возрастов, но чаще болеет молодняк в возрасте 1-6 месяцев. Заражение происходит алиментарным путем.
Таксономической положение возбудителя
Treponema hyodysenteria– грамотрицательная спирохета. При микроскопии в темном поле трепонемы имеют форму подвижных нитей с ровными, правильно расположенными завитками и острыми концами. Размеры: (7-20)x(0,3-0,4) мкм. Морфологически различают три формы трепонем свиней: крупные – длиной до 20 мкм и 8-12 завитками, средние – 8-12 мкм с 6-8 завитками и малые – до 8 мкм с 3-4 завитками. Спор и капсул не образуют. Хорошо окрашиваются анилиновыми красителями.
Возбудитель – анаэроб, оптимальная температура 36-38C(при 25 и 30Cне растет),pH7,4-7,6.
Культивируется на специальных средах. К ним относятся:
Плотные: трипсин-агар с 5 % цитратной крови крупного рогатого скота; соевый агар с 5 % крови крупного рогатого скота;
Жидкие: триптический соевый бульон с 10 % сыворотки крови плода коровы и спектиномицина (400 мг/л); МПБ (pH7,4-7,6) с кусочками мелко нарезанной печени коровы, 50 % асцитической жидкости и 1:5000 аскорбиновой кислоты.
Посевы культивируют в анаэробных условиях 4-8 дней. На дне чашки с трипсин-агаром и 5 % крови через 72 часа развивается неправильной формы размером 3-4 мм зона B-гемолиза, в центре которой на поверхности агара редко встречаются мелкие прозрачные колонии или нежная пленка со следами эрозии.
Патогенные для свиней культуры не ферментируют фруктозу, утилизируют пируват, при сбраживании глюкозы образуют водород, углекислоту, ацетат, бутират; нитрат не восстанавливают.
Гемолитические свойства, могут продуцировать эндотоксины.
Попав в организм свиней алиментарным путем, Tr. hyodysenteria достигает толстого кишечника, где фиксируется на слизистой оболочке. Здесь часть бактерий погибает, из них освобождаются вазомоторные субстанции, сенсибилизирующие слизистую оболочку толстого кишечника и повышающие ее проницаемость. Это способствует проникновению возбудителя в подслизистую ткань. Размножение микробов идет одновременно с их разрушением и освобождением токсических продуктов, под действием которых происходят морфологические и физиологические нарушения функции кишечника, что приводит к развитию дисбактериоза. Некротические и воспалительные процессы часто усиливаются другими бактериями (F. necrophorum, Bacteroides fragilisи др.).
Устойчивость.Являясь строгим анаэробом, возбудитель вне организма имеет незначительную устойчивость. В фекальных массах при 0Cсохраняется до 48 дней, при 10C– до 38, при 20C– до 12 дней, в замороженном патматериале – не менее 2 месяцев. При возникновении анаэробных условий в навозной жиже возбудитель может не только длительно сохраняться, но и накапливаться.
Для дезинфекции применяют 4 %-ный (70 o С) раствор гидроокиси натрия и 2 %-ный раствор формальдегида. Возбудитель чувствителен к осарсолу, спирамицину и тилозину, а также мышьяковистым и нитроимидазольным препаратам.
Лабораторная диагностикадизентерии свиней основана на эпизоотологических данных и результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии (основной метод), а также выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и ферментативным свойствам.
Материал для исследования. Для прижизненной диагностики в лабораторию направляют фекалии, для посмертной – слизистую оболочку большой ободочной кишки, которую соскабливают после удаления из кишечника содержимого и промывания водой. От трупов материал берут не позднее чем через 2 ч после гибели животного, материал должен быть исследован в течение 2-4 ч, а при хранении на холоде – 6-8 ч. Из материала готовят суспензию.
Микроскопия препаратов из исходного материала. Поскольку культивирование возбудителя весьма трудоемко, микроскопическое исследование – это основной метод диагностики, доступный практическим лабораториям. Поступивший материал исследуют методом темнопольной, фазово-контрастной или обычной световой микроскопии.
В окрашенных по Граму препаратах видны грамотрицательные извитые клетки со строением, типичным для спирохет. Клетки возбудителя хорошо окрашиваются по Романовскому-Гимзе, фуксином Пфейффера. Разработан также прямой вариант реакции иммунофлюоресценции.
Выделение и идентификация культуры возбудителя. Для первичной изоляции используют селективные среды, например следующие.
Кровяной агар со спектомицином: к перевару Хоттингера добавляют 0,001 % резазурина (индикатор ОКВП), 0,5 % хлорида натрия, 0,25 % глюкозы, 1 % пептона, 2 % агара, кипятят, пропускают через среду азот или оксид углерода (IV) в течение 10-15 минут, устанавливаютpH7,0-7,2, вносят 0,05 % гидрохлорида цистеина. Среду автоклавируют при 110C30 минут, охлаждают до 40-45C, пропуская при этом через среду стерильный обескислороженный газ, после чего вносят 10 % дефибринированной крови барана (или крупного рогатого скота) и 400 мкг/мл спектомицина. Среду разливают в атмосфере оксида углерода (IV).
Культивируют также в жидкой или полужидкой среде, содержащей сердечно-мозговую вытяжку и 10% эмбриональной телячьей или кроличьей сыворотки. На кровяном агаре через 48-96 ч инкубирования при 38Cвырастают плоские просвечивающие колонии диаметром 0,5-3 мм с зоной бета-гемолиза. В полужидком сывороточном агаре возбудитель растет в виде беловатого диффузного облачка ближе к поверхности среды.
После изучения морфологии и культуральных свойств у выделенных бактерий исследуют ферментативную активность.
Биопроба.Трепонемы хорошо размножаются в организме кролика и накапливаются в тестикулах. Фильтрат материала от больных свиней вводят кроликам внутрибрюшинно в дозе 5-7 мл. Через 7-10 дней берут пунктат и микроскопируют. При обнаружении трепонем кроликов убивают и подвергают исследованию (микроскопия, выделение культур).
Серологическая и аллергическая диагностики не применяются.
У переболевших дизентерией свиней иммунитет не формируется. Обнаруживают лишь сывороточные антитела к Tr. hyodysenteria и некоторую степень резистентности к реинфекции.
Биопрепараты для специфической профилактики и терапии не разработаны.
Ознакомьтесь и опишите работу ветеринарной лаборатории, обслуживающей ваш участок. Примите участие в лабораторной диагностике инфекционного заболевания. Опишите подробно порядок этого исследования и его результаты.
Характеристика Киевской государственной городской
лаборатории ветеринарной медицины.
Киевская городская лаборатория ветеринарной медицины входит в состав Объединения ветеринарной медицины города Киева, как самостоятельная структурная единица.
Лаборатория состоит из четырех отделов:
Диагностический отдел, в котором|каком|проводится диагностика инфекционных, паразитарных болезней, лабораторные исследования крови и мочи, микологические|микология|посевы соскобов с животных, проводятся рассечения и принятие патологического материала на исследование.
Отдел организации производства ветеринарно-санитарной экспертизы, биохимии и метрологии, в котором|каком|проводится прием образцов на исследование в другие отделы и проведения ветеринарно-санитарной экспертизы.
Бактериологический отдел– в котором|каком|проводятся определения патологических микроорганизмов|микроорганизма|и их идентификация, количественное определение остаточных количеств антибиотиков, в сырье животного происхождения и пищевой продукции, выдача экспертных выводов относительно пригодности сырья животного и растительного происхождения для производства пищевой продукции, или последующей реализации уже готовой продукции и полуфабрикатов.
Отдел химико-токсикологии радиологии, в котором|каком|проводятся исследования пищевой продукции и сырья животного и растительного происхождения на содержимое|содержание|токсикантів|и радионуклидов|радионуклида|.
В этой связи перед лабораторией появилось задание|задача|чрезвычайной|необычайной|ответственности: уже в текущем году выполнить|исполнить|значительный объем работ относительно|касательно|перевода радиологического|радиология|, химико-токсикологического|токсикология|, микологического|микология|, бактериологического отделов и отдела ветеринарно-санитарной экспертизы к|до|функционированию в соответствии с|соответственно|немецкой системой DAP|согласно требованиям|востребованию|DIHEN|ISO/IEC 17025:2000. Подготовительные работы к|до|аккредитации такого уровня очень затратные. Их выполнение должно вестись|планомерно и поэтапно при четком соблюдении всех требований|востребования|с учетом финансовых возможностей. На данный момент в системе DAP|уже аккредитованы отдел хіміко-токсикології|и радиологии и отдел приема проб на исследование.
Основой системы качества проведения исследований отдела химико-токсикологии и радиологии КМДЛВМ является установка из качества разработанная согласно требованиям „Правил полномочия и аттестации в государственной метрологической системе”, которые утверждены приказом №71 от 29.03.2005 Держспоживстандарту Украины и зарегистрированные в Министерстве юстиции Украины за № 92/10672 от 13.04.2005 года и ДСТУ Иso/iec 17025-2001 „Общие требования к компетентности испытательных и калибровочных лабораторий” иявляется обязательными документами для всех работников Киевской городской государственной лаборатории ветеринарной медицины.
Настоящие документы заключают в себе организационно методические и административные процедуры и методы из|с| организации и проведения измерений (исследований) та ответственность должностных лиц за качество и достоверность результатов проведенных исследований.
Функционирование системы качества обеспечивается:
организационной структурой КМДЛВМ;
материально-техническими ресурсами и испытательным оборудованием, средствами измерительной техники (ЗВТ), помещениями;
нормативной документацией, которая|какая|регламетує|требования к качеству продукции и методов ее испытаний|опробования|(измерений) и анализов;
энергетическими ресурсами, необходимыми для проведения испытаний|опробования|;
персоналом, компетентным в вопросах организации и проведения измерений, анализов;
системой повышения квалификации работников КМДЛВМ.
Ответственность за организацию и проведение измерений (исследований), а также за обеспечение функционирования системы качества полагается на ответственного за метрологическое состояние|стан|в КМДЛВМ.
Ответственность за обеспечение качества измерений (исследований) возложена на персонал КМДЛВМ согласно своих должностных инструкций.
КМДЛВМ предназначена для осуществления ветеринарно-санитарного контроля продукции животного и растительного происхождения согласно Отрасли аттестации.
Объективность и своевременность выполнения исследований (экспертизы) обеспечивает система контроля качества и система мероприятий из обеспечения качества с учетом факторов, которые могут влиять на достоверность и результаты исследований.
Политику в отрасли качества устанавливают как главное|головное|направление КМДЛВМ. Она определяет желаемые|желанные|результаты и помогает использовать ресурсы лаборатории для достижения этих результатов.
Политику в отрасли качества формирует|формующий|и реализует директор лаборатории и применяет как средство для улучшения деятельности лаборатории.
Для достижения цели политики в отрасли качества используются такие ресурсы:
организационные, что обеспечивают проведение измерений на высоком уровне за счет четкого распределения|деления|обязанностей|долга|и контроля за качеством работ, которые выполняются|исполняют|;
материальные ресурсы, то есть помещение, ЗВТ, вспомогательное оборудование;
трудовые ресурсы, которые включают квалифицированный персонал;
наличие необходимой нормативной, методической, правовой, организационной и техніко-експлуатаційної|документации.
Состав|склад| и квалификация персонала изложены в "Паспорте КМДЛВМ " (форма 2).
Работники КМДЛВМ имеют должностные инструкции, которые|какие|устанавливают их функции, права, обязанности|долг|и ответственность.
Должностные инструкции разрабатываются уполномоченным сотрудником и утверждаются директором КМДЛВМ и утверждаются начальником объединения ветеринарной медицины в м Киеве.
Должностные инструкции пересматриваются|просматривают| при изменении|смене| функциональных обязанностей|долга| должностного лица.
Аттестация специалистов, которые проводят метрологические работы, проводится согласно действующего законодательства один раз в пять лет.
Повышение квалификации специалистов лаборатории осуществляется путем:
путем учебы|обучения|на курсах повышения квалификации для работников;
путем проведения семинарских занятий;
Подробная информация относительно|касательно|средств измерительной техники, испытательного и другого лабораторного оборудования приведенная|наведенная|в Паспорте КМДЛВМ (форма 6,8,9).
В КМДЛВМ обеспечены условия для правильной эксплуатации и хранения|сбережения| лабораторного оборудования.
Введение|ввод|в эксплуатацию средств измерительной техники и другого оборудования осуществляется ответственным за метрологическое состояние|стан|КМДЛВМ.
Средства измерительной техники и испытательное оборудование проходят периодическую|периодичную|поверку и метрологическую аттестацию в соответствии с действующими сроками|термином|.
Средства измерительной техники отвечают требованиям|востребованию| нормативной документации на методики выполнения измерений, заявленных в отрасли аттестации.
Лабораторная диагностика бешенства согласно ГОСТ26075-84 .
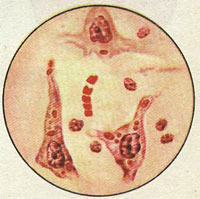
На сегодняшний день в ветеринарии применяется единственный информативный и достаточно точный метод диагностики бешенства у животных. Это посмертное исследование срезов аммоновых рогов головного мозга и обнаружение в них специфических включений - телец Бабеша-Негри. Тельца Бабеша-Негри также присутствуют в цитоплазме нейронов, гиппокампе, клетках Пуркинье коры мозжечка, стволе мозга, гипоталамусе и спинномозговых ганглиях. Данные тельца присутствуют в головном мозге только при бешенстве, наличие их при других заболеваниях, в том числе и при заболеваниях центральной нервной системы, не зафиксировано.
Состоят тельца Бабеша-Негри из тонковолокнистого матрикса и вирусного рибонуклеопротеида, размер телец - около 10 нанометров.
Негри находил эти тельца только в нервной системе у больных животных и всегда у человека. Тельца не обнаружены в слюне и испражнениях. Природа телец до сих пор вызывает споры. Именно поэтому лабораторно исследуется труп павшего или усыпленного животного, подозрительного в заболевании бешенством.
Кроме исследований головного мозга в ветеринарных лабораториях проводится получение вытяжки из мозга и искусственное заражение лабораторных мышей бешенством. Процесс длительный и применяется для подтверждения диагноза.
Исследование на присутствие возбудителя столбняка - С. tetani проводят в следующих случаях:
- для подтверждения клинического диагноза столбняка у больного или умершего;
- для проверки на стерильность перевязочного, шовного материала, изделий медицинского назначения, применяемых для парентерального введения;
- для оценки состояния окружающей среды и эпидзначимых объектов (почва, пыль, воздух в операционных и перевязочных и др.).
Так как клиническая картина столбняка бывает весьма характерна, лабораторная диагностика может служить для подтверждения диагноза чаще всего ретроспективно, поскольку манифестная клиника обычно свидетельствует о далеко зашедшем процессе.
Серологические исследования материала от больных столбняком не имеют диагностического значения.
При типичной клинической картине лабораторная диагностика может не требоваться. Необходимость в ней возникает при спорных и неясных случаях, и когда требуется подтверждение диагноза после операций, абортов, родов на дому без медицинской помощи.
Возбудителем столбняка является Clostridium tetani, прямая палочка длиной 2,4 - 5,0 мкм, диаметром 0,5 - 1,1 мкм, иногда образующая длинные нити. Большинство штаммов подвижны. Споры круглые, располагаются терминально, придавая возбудителю вид булавки или барабанной палочки. Грамположительна, но в старых культурах становится грамотрицательной. Капсулы не образует. Оптимальная температура для роста 37 °С (диапазон роста 14 - 45 °С). На среде Китта-Тароцци рост медленный, с равномерным помутнением и редким газообразованием (с сахоролитическими свойствами не обладает, лишь редкие штаммы ферментируют глюкозу). Культура издает своеобразный неприятный запах выгребной ямы. На кровяном агаре колонии размером 4 - 6 мм, круглые, плоские с неровными краями, полупрозрачные, серые, нередко в виде переплетающихся нитей напоминающих паучков; вокруг колоний - зона гемолиза. В столбике агара колонии в виде комочков ваты. С. tetani обладает слабыми протеолитическими свойствами, медленно гидролизуют желатин, молоко свертывают к 4 - 7 дню в виде мелких хлопьев, затем наступает его пептонизация; не образует индола, восстанавливает нитраты в нитриты.
Главным фактором патогенности С. tetani определяющим патогенез и клинику столбняка, является вырабатываемый им сильнейший экзотоксин. Экзотоксин состоит из двух фракций тетраноспазмина (нейротоксина) и тетополизина (разрушает эритроциты).
Резистентность. Вегетативные формы С. tetani не отличаются особой устойчивостью. При кипячении они разрушаются в течение 5 мин. Напротив, споры С. tetani обладают исключительно высокой резистентностью к различным физическим и химическим воздействиям. Для их разрушения требуется кипячение в течение 1 - 3 часов; автоклавирование при 120 °С они переносят до 40 мин. Споры нечувствительны к низким температурам, к рассеянному солнечному свету. Они практически нечувствительны к химиотерапевтическим препаратам. В высушенном состоянии споры сохраняют жизнеспособность несколько десятков лет, в почве сохраняются длительное время, а при благоприятных условиях могут в ней прорастать и размножаться. Поэтому почва, особенно загрязненная испражнениями животных и человека, является неиссякаемым резервуаром С. tetani и постоянным потенциальным источником заражения людей и животных столбняком.
Возбудитель столбняка распространен повсеместно в почве и других объектах внешней среды, поэтому проблема столбняка имеет глобальное значение. Больной столбняком человек неконтагиозен - передачи возбудителя столбняка от больного не происходит. Основным путем заражения является проникновение возбудителя через поврежденные кожные покровы и слизистые оболочки. Местом входных ворот служат различные раны: огнестрельные, колотые, резаные, занозы, потертости, ожоги, обморожения, травмированные родовые пути (послеродовый или послеабортный столбняк), операционные раны при инфицировании их руками, инструментами или перевязочным материалом. Иногда травмы настолько ничтожные, что входные ворота остаются необнаруженными (криптогенный столбняк). Особенно серьезную глобальную проблему представляет столбняк новорожденных (tetanus neonatorum). Он связан с тем, что в целом ряде развивающихся стран при обработке пуповины применяют такие традиционные методы (при родах на дому), как использование золы, земли, глины, навоза, помета птиц, порошков, приготовленных из различных растительных продуктов и других субстратов, которые часто содержат споры С. tetani. Попадая через пупочный канатик, они и служат причиной столбняка новорожденных. Летальность при этой форме столбняка составляет в среднем 85 % и достигает максимальных значений на 6 - 8 день жизни больного ребенка. По оценке ВОЗ, в 80-х годах XX в. ежегодно в развивающихся странах от столбняка новорожденных умерло более 1 млн. детей, а общее число случаев столбняка в них составляло более 2,5 млн.
4.1. Материал для исследования
Соответственно данным о патогенезе столбнячной инфекции, возбудителя можно обнаружить на месте проникновения в организм. Исследованию подвергают ткани вокруг предполагаемых входных ворот, а также гнойной, перевязочный материал (тампоны), лоскуты одежды, попавшие в рану, и пр. При столбняке у женщин после родов или аборта исследуют выделения из матки, у новорожденных берут выделения из пупка. Гной при большом его количестве (5 - 7 мл.) транспортируют непосредственно в шприце или помещают в стерильную пробирку. Для взятия материала из глубины раны используют стерильные ватные тампоны. Материал для исследования стерильного перевязочного материала и почвы берут как обычно.
При сборе материала от трупа рекомендуется, кроме сказанного, обратить внимание на старые рубцы и воспалительные очаги, а также взять кровь (5 мл) и кусочки печени и селезенки (по 20 г).
4.2. Подготовка проб к исследованию
Микробиологическая диагностика включает в себя следующие 3 этапа:
1) бактериоскопия исходного материала;
2) посев для выделения возбудителя и его идентификации;
3) обнаружение столбнячного токсина.
На первом этапе исследования производят микроскопию нативного материала. Приготовить из растертого материала, а также из гноя и отделяемого ран мазки и окрасить их по Граму. Наличие типичных бацилл с терминальной спорой (барабанные палочки), окрашивающихся по Граму положительно, заставляет настойчиво искать подтверждение бактериологическим методом. Изучение мазка позволяет также ориентироваться в наличии и составе сопутствующей флоры.
Целью второго этапа бактериологического исследования является выделение возбудителя. Для этого собранный для исследования материал, кроме жидкого, переводят в жидкую фазу путем растирания его физиологическим раствором в стерильной фарфоровой ступке. Посев производят в регенерированную среду Китта-Тароцци - в двойное количество пробирок и один ряд пробирок прогревают при 80 °С 20 минут. Эта процедура позволяет избавиться от находящихся в пробе вегетативных форм бактерий и существенно упрощает выделение спорообразующих анаэробов. Исследование гретого и негретого материала в дальнейшем ведут параллельно.
Посевы культивируют при 37 °С. Через 2, 4, 6 и 10 дней приготовляют мазок и микроскопируют после окраски по Граму. Наличие типичных микробов позволяет произвести высев на кровяной агар в чашках (инкубирование в условиях анаэростата) или в высокий столбик агара в пробирках, где наблюдают появление типичных колоний.
На поверхности кровяного агара клостридии столбняка растут в виде нежных прозрачных колоний, похожих на капельки росы, которые быстро распространяются и образуют нежную сетчатую пленку, покрывающую всю чашку и плохо видимую невооруженным глазом. Полезно воспользоваться нейтрализацией гемолизина при помощи антитоксической сыворотки. С этой целью перед посевом половину поверхности агара в чашке смачивают сывороткой, дают подсохнуть и производят посев на всей чашке. Сравнение роста на обеих половинах позволяет обнаружить специфическое угнетение гемолиза на той части чашки, где был нанесен антитоксин (Антитоксическая сыворотка не должна содержать консерванта, который может задержать рост клостридий столбняка).
В пробирки с высоким столбиком агара бульонную культуру высевают из пробирки, которая была предварительно прогрета, чтобы избежать загрязнения аэробами. Для посева агар растапливают и охлаждают до 45 °С. Чтобы получить рост отдельных колоний, посев производят запаянной пастеровской пипеткой, которую смачивают в посевной жидкости, а затем последовательно переносят в 2 - 3 пробирки расплавленного агара, после чего быстро опускают последние в холодную воду, чтобы задержать распространение подвижных клостридий. Через 1 - 2 дня пребывания засеянных пробирок в термостате палочка столбняка вырастает в виде плотных чечевицеобразных колоний или в виде колоний пушинок.
Решающим признаком для диагностики столбняка является обнаружение токсина. Для выявления токсического действия культуры или первичного материала ставят биологический опыт-реакцию нейтрализации на белых мышах. Исходный материал, полученный от больного или трупа, после растирания и посева оставляют в ступке на 1 час для экстрагирования токсина. Экстракт или культуру на жидкой среде фильтруют через ватно-марлевый фильтр. Часть приготовленного фильтрата смешивают с антитоксической сывороткой таким образом, чтобы на каждый мл экстракта приходилось 0,5 мл антитоксической сыворотки, разведенной до содержания 400 АЕ в 1 мл. Двум мышам внутримышечно в бедро задней лапки вводят по 0,5 или по 1 мл фильтрата, а двум - 0,75 или 1,5 мл смеси фильтрата с антитоксином.
Симптомы столбняка развиваются у животных на 2 - 3 сутки в мышцах той стороны, на которой введен токсин (ригидность хвоста, взъерошивание шерсти). Затем быстро наступает паралич, сначала конечностей, а вслед за ними остальных мышц тела. Гибель животного наступает при общем параличе мышц. Мыши погибают в характерной позе, вытянув задние лапки (поза тюленя). У животных, получивших смесь фильтрата с антитоксином, заболевание не наступает. Зараженных животных наблюдают 4 - 5 дней, инкубационный период равен 2 - 4 дням.
Таким образом, наиболее простым и эффективным методом лабораторной диагностики столбняка является биологическая проба на белых мышах.
Перечень нормативно-методической документации:
1 МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ЦЕНТР ГОССАНЭПИДНАДЗОРА В РОСТОВСКОЙ ОБЛАСТИ Методы контроля. Биологические и микробиологические факторы. Лабораторная диагностика столбняка МЕТОДИЧЕСКИЕ УКАЗАНИЯ МУ аксессуары кружевами
2 Утверждаю: /г:^главный Государственный ^- ^щт'арный врач i ' v/ ^. >vnd^pqfetobcкой o6j области ^ 1 Ш 5>>^мавт.а года 4.2. Методы контроля. Биологические и микробиологические факторы. Лабораторная диагностика столбняка МЕТОДИЧЕСКИЕ УКАЗАНИЯ МУ г.ростов-на-дону 2002г.
3 Подготовили: Главный государственный санитарный врач по Ростовской области, д.м.н., проф. Зам. главного врача по эпидвопросам Зав. отделом эпиднадзора за инфекционными и паразитарными болезнями, к.м.н. Зав. отделением микробиологического обеспечения эпиднадзора Врачи-бактериологи Зав. отделом информационных технологий Г.Т. Айдинов М.М. Швагер B.IO. Рыжков Т.В. Митрофанова О.В. Карнаухова Н.Т. Ни коло ва О.И. Симоненко з
5 Главным фактором патогенности С. tetani определяющим патогенез и клинику столбняка, является вырабатываемый им сильнейший экзотоксин. Экзотоксин состоит из двух фракций тетраноспазмина (пейротоксипа) и тетоиолизина (разрушает эритроциты). Резистентность. Вегетативные формы С. tetani не отличаются особой устойчивостью. При кипячении они разрушаются в течение 5 мин. Напротив, споры С. tetani обладают исключительно высокой резистентностью к различным физическим и химическим воздействиям. Для их разрушения требуется кипячение в течение 1-3 часов; автоклавирование при 120 С они переносят до 40 мин. Споры нечувствительны к низким температурам, к рассеянному солнечному свету. Они практически нечувствительны к химиотерапевтическим препаратам. В высушенном состоянии споры сохраняют жизнеспособность несколько десятков лет, в почве сохраняются длительное время, а при благоприятных условиях могут в ней прорастать и размножаться. Поэтому почва, особенно загрязненная испражнениями животных и человека, является неиссякаемым резервуаром С.tetani и постоянным потенциальным источником заражения людей и животных столбняком. 3. Особенности эпидемиологии. Возбудитель столбняка распространен повсеместно в почве и других объектах внешней среды, поэтому проблема столбняка имеет глобальное значение. Больной столбняком человек неконтагиозен - передачи возбудителя столбняка от больного не происходит. Основным путем заражения является проникновение возбудителя через поврежденные кожные покровы и слизистые оболочки. Местом входных ворот служат различные раны: огнестрельные, колотые, резаные, занозы, потертости, ожоги, обморожения, травмированные родовые пути (послеродовый или послеабортный столбняк), операционные раны при инфицировании их руками, инструментами или перевязочным материалом. Иногда травмы настолько ничтожные, что входные ворота остаются необнаруженными (криптогенный столбняк). Особенно серьезную глобальную проблему представляет столбняк новорожденных (tetanus neonatorum). Он связан с тем, что в целом ряде развивающихся стран при обработке пуповины применяют такие традиционные методы (при родах на дому), как использование золы, земли, глины, навоза, помета птиц, порошков, приготовленных из различных растительных продуктов и других субстратов, которые часто содержат споры С.tetani. Попадая через пупочный канатик, они и служат причиной столбняка новорожденных. Летальность при этой форме столбняка составляет в среднем 85% и достигает максимальных значений на 6-8 день жизни больного ребенка. По оценке ВОЗ, в 80-х годах XX в. ежегодно в развивающихся странах от столбняка новорожденных умерло более 1 млн. детей, а общее число случаев столбняка в них составляло более 2,5 млн. 4. Лабораторная диагностика Материал для исследования. 5
6 Соответственно данным о патогенезе столбнячной инфекции, возбудителя можно обнаружить на месте проникновения в организм. Исследованию подвергают ткани вокруг предполагаемых входных ворот, а также гнойной, перевязочный материал (тампоны), лоскуты одежды, попавшие в рану, и пр. При столбняке у женщин после родов или аборта исследуют выделения из матки, у новорожденных берут выделения из пупка. Гной при большом его количестве (5-7 мл.) транспортируют непосредственно в шприце или помещают в стерильную пробирку. Для взятия материала из глубины раны используют стерильные ватные тампоны. Материал для исследования стерильного перевязочного материала и почвы берут как обычно. При сборе материала от трупа рекомендуется, кроме сказанного, обратить внимание на старые рубцы и воспалительные очаги, а также взять кровь (5 мл) и кусочки печени и селезенки (по 20 г) Подготовка проб к исследованию. Микробиологическая диагностика включает в себя следующие 3 этапа: 1) бактериоскопия исходного материала; 2) посев для выделения возбудителя и его идентификации; 3) обнаружение столбнячного токсина. На первом этапе исследования производят микроскопию нативного материала. Приготовить из растертого материала, а также из гноя и отделяемого ран мазки и окрасить их по Граму. Наличие типичных бацилл с терминальной спорой (барабанные палочки), окрашивающихся по Граму положительно, заставляет настойчиво искать подтверждение бактериологическим методом. Изучение мазка позволяет также ориентироваться в наличии и составе сопутствующей флоры. Целью второго этапа бактериологического исследования является выделение возбудителя. Для этого собранный для исследования материал, кроме жидкого, переводят в жидкую фазу путем растирания его физиологическим раствором в стерильной фарфоровой ступке. Посев производят в регенерированную среду Китта-Тароцци - в двойное количество пробирок и один ряд пробирок прогревают при 80 С 20 минут. Эта процедура позволяет избавиться от находящихся в пробе вегетативных форм бактерий и существенно упрощает выделение спорообразующих анаэробов. Исследование гретого и негретого материала в дальнейшем ведут параллельно. Посевы культивируют при 37 С. Через 2, 4, 6 и 10 дней приготовляют мазок и микроскопируют после окраски по Граму. Наличие типичных микробов позволяет произвести высев на кровяной агар в чашках (инкубирование в условиях анаэростата) или в высокий столбик агара в пробирках, где наблюдают появление типичных колоний. На поверхности кровяного агара клостридии столбняка растут в виде нежных прозрачных колоний, похожих на капельки росы, которые быстро распространяются и образуют нежную сетчатую пленку, покрывающую всю чашку и плохо видимую невооруженным глазом. Полезно воспользоваться нейтрализацией гемолизина при помощи антитоксической сыворотки. С этой целью перед 6
7 посевом половину поверхности агара в чашке смачивают сывороткой, дают подсохнуть и производят посев на всей чашке. Сравнение роста на обеих половинах позволяет обнаружить специфическое угнетение гемолиза на той части чашки, где был нанесен антитоксин (Антитоксическая сыворотка не должна содержать консерванта, который может задержать рост клостридий столбняка). В пробирки с высоким столбиком агара бульонную культуру высевают из пробирки, которая была предварительно прогрета, чтобы избежать загрязнения аэробами. Для посева агар растапливают и охлаждают до 45 С. Чтобы получить рост отдельных колоний, посев производят запаянной пастеровской пипеткой, которую смачивают в посевной жидкости, а затем последовательно переносят в 2-3 пробирки расплавленного агара, после чего быстро опускают последние в холодную воду, чтобы задержать распространение подвижных клостридий. Через 1-2 дня пребывания засеянных пробирок в термостате палочка столбняка вырастает в виде плотных чечевицеобразных колоний или в виде колоний пушинок. Решающим признаком для диагностики столбняка является обнаружение токсина. Для выявления токсического действия культуры или первичного материала ставят биологический опыт-реакцию нейтрализации на белых мышах. Исходный материал, полученный от больного или трупа, после растирания и посева оставляют в ступке на 1 час для экстрагирования токсина. Экстракт или культуру на жидкой среде фильтруют через ватно-марлевый фильтр. Часть приготовленного фильтрата смешивают с антитоксической сывороткой таким образом, чтобы на каждый мл экстракта приходилось 0,5 мл антитоксической сыворотки, разведенной до содержания 400 А в 1 мл. Двум мышам внутримышечно в бедро задней лапки вводят по 0,5 или по 1 мл фильтрата, а двум - 0,75 или 1,5 мл смеси фильтрата с антитоксином. Симптомы столбняка развиваются у животных на 2-3 сутки в мышцах той стороны, на которой введен токсин (ригидность хвоста, взъерошивание шерсти). Затем быстро наступает паралич, сначала конечностей, а вслед за ними остальных мышц тела. Гибель животного наступает при общем параличе мышц. Мыши погибают в характерной позе, вытянув задние лапки (поза тюленя). У животных, получивших смесь фильтрата с антитоксином, заболевание не наступает. Зараженных животных наблюдают 4-5 дней, инкубационный период равен 2-4 дням. Таким образом, наиболее простым и эффективным методом лабораторной диагностики столбняка является биологическая проба на белых мышах. 7
Читайте также:


